1 . 以废料铅膏( 、
、 、
、 、
、 等)为原料,制备超细
等)为原料,制备超细 ,实现铅循环再利用的流程如下:
,实现铅循环再利用的流程如下: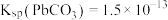 ,
,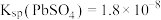 。②
。② 溶解在
溶解在 溶液中(杂质不溶于
溶液中(杂质不溶于 )的溶解度曲线如图所示:
)的溶解度曲线如图所示:
 、
、 、
、 、
、 等)为原料,制备超细
等)为原料,制备超细 ,实现铅循环再利用的流程如下:
,实现铅循环再利用的流程如下: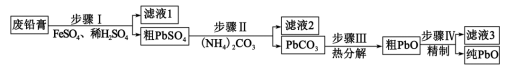
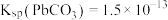 ,
,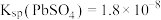 。②
。② 溶解在
溶解在 溶液中(杂质不溶于
溶液中(杂质不溶于 )的溶解度曲线如图所示:
)的溶解度曲线如图所示:
A.步骤Ⅰ发生的主要反应有 |
B.步骤Ⅱ,若滤出的 沉淀中混有 沉淀中混有 ,该滤液中 ,该滤液中 |
| C.过程中为提高产品产率,滤液3应循环使用 |
D.精制的操作是在 用碱溶解,然后趁热过滤、洗涤、干燥 用碱溶解,然后趁热过滤、洗涤、干燥 |
您最近一年使用:0次
解题方法
2 . 由实验操作和现象,可得出相应结论的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别测浓度均为 的 的 和 和 溶液的 溶液的 | 后者大于前者 |  |
| B | 向 溶液中先滴加2滴 溶液中先滴加2滴 溶液,再滴加4滴 溶液,再滴加4滴 溶液 溶液 | 先产生白色沉淀再产生黄色沉淀 |  |
| C | 用 注射器吸入 注射器吸入 和 和 的混合气体,将细管端用橡皮塞封闭。然后将活塞往外拉伸一段距离 的混合气体,将细管端用橡皮塞封闭。然后将活塞往外拉伸一段距离 | 注射器内混合气体的颜色先变浅又逐渐变深 | 其他条件不变,减压,平衡向生成 气体的方向移动 气体的方向移动 |
| D | 加热试管中的聚氯乙烯薄膜碎片 | 试管口润湿的蓝色石蕊试纸变红 | 氯乙烯加聚反应是可逆反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-29更新
|
52次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题
3 . 近日,中科院上海硅酸盐研究所施剑林团队报道了MnOOH催化谷胱甘肽自氧化产生活性氧。某小组以菱锰矿(主要成分为 ,含少量
,含少量 、FeO、CoO、
、FeO、CoO、 、
、 等)为原料制备高纯度MnOOH,流程如下:
等)为原料制备高纯度MnOOH,流程如下:
②几种金属离子沉淀的pH如表所示:
下列叙述正确的是
 ,含少量
,含少量 、FeO、CoO、
、FeO、CoO、 、
、 等)为原料制备高纯度MnOOH,流程如下:
等)为原料制备高纯度MnOOH,流程如下: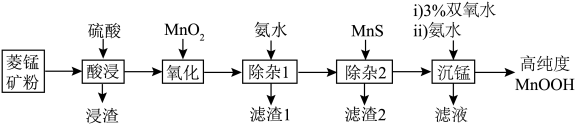
②几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 |  |  |  |  |  |
| 开始沉淀的pH | 2.7 | 7.6 | 4.0 | 7.6 | 8.1 |
| 完全沉淀的pH | 3.7 | 9.6 | 5.2 | 9.2 | 10.1 |
A.滤渣1的成分是 和 和 |
B.“氧化”反应的离子方程式为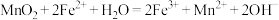 |
C.“除杂2”的原理是 |
D.双氧水氧化 ,滤液一定显酸性 ,滤液一定显酸性 |
您最近一年使用:0次
4 . 下表是常温下 的电离常数和
的电离常数和 的溶度积常数,下列推断正确的是
的溶度积常数,下列推断正确的是
 的电离常数和
的电离常数和 的溶度积常数,下列推断正确的是
的溶度积常数,下列推断正确的是 |  |  |  |
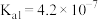 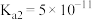 |  |  |  |
A.误饮 的溶液会引起钡中毒,需用一定浓度的 的溶液会引起钡中毒,需用一定浓度的 溶液给钡中毒者洗胃解毒 溶液给钡中毒者洗胃解毒 |
B.由 粉末和水形成的 粉末和水形成的 饱和溶液中, 饱和溶液中, |
C.由 粉末和水形成的 粉末和水形成的 饱和溶液常温下pH约为9.6,则溶液中存在: 饱和溶液常温下pH约为9.6,则溶液中存在: |
D. 的 的 溶液,可将 溶液,可将 完全转化为 完全转化为 |
您最近一年使用:0次
名校
解题方法
5 . 下列实验操作、现象和结论都正确的是
| 实验操作 | 现象与结论 | |
| A | 向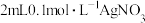 溶液中先滴加 溶液中先滴加 滴 滴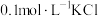 溶液,再滴加 溶液,再滴加 滴 滴 溶液 溶液 | 先产生白色沉淀,再产生黄色沉淀,说明 转化为 转化为 , , 溶解度小于 溶解度小于 |
| B | 将铁锈溶于浓盐酸,滴加 溶液 溶液 | 溶液紫色逐渐褪去,说明铁锈中含有二价铁 |
| C | 常温下,分别测定浓度均为 的 的 溶液和 溶液和 溶液的 溶液的 | 两溶液 均等于 均等于 ,说明常温下, ,说明常温下, 的 的 溶液和 溶液和 溶液中水的电离程度相等 溶液中水的电离程度相等 |
| D | 向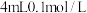 的 的 溶液逐滴加入 溶液逐滴加入 氨水 氨水 | 先产生蓝色沉淀,然后沉淀消失并得到深蓝色溶液,说明 与 与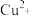 的配位能力比 的配位能力比 与 与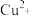 的配位能力强 的配位能力强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 室温下,两种难溶盐 (白色)、
(白色)、 (砖红色)的离子浓度关系曲线如图所示,其中
(砖红色)的离子浓度关系曲线如图所示,其中 。
。
下列说法错误的是
 (白色)、
(白色)、 (砖红色)的离子浓度关系曲线如图所示,其中
(砖红色)的离子浓度关系曲线如图所示,其中 。
。
下列说法错误的是
A. |
B.向 点的混合溶液中,加入硝酸银固体, 点的混合溶液中,加入硝酸银固体, 变小 变小 |
| C.B点条件下能生成白色沉淀,不能生成砖红色沉淀 |
D.向等浓度的 和 和 混合溶液中滴加 混合溶液中滴加 溶液,先产生白色沉淀 溶液,先产生白色沉淀 |
您最近一年使用:0次
2024-03-02更新
|
276次组卷
|
2卷引用:河北省唐山市2023-2024学年高三上学期期末考试化学试题
名校
解题方法
7 . 下列操作能达到相应实验目的的是
| 实验操作 | 实验目的 | |
| A | 向等体积、等pH的两种酸溶液HA和HB中分别加入足量锌粉,充分反应后,HA溶液产生更多的氢气 | 说明Ka(HA)>Ka(HB) |
| B | 向5mL0.1mol/LCuSO4溶液中先加入2mL0.4mol/LNaOH溶液,再加入1mL0.1mol/LNa2S溶液 | 探究常温下Ksp[Cu(OH)2]>Ksp(CuS) |
| C | 向滴有酚酞的碳酸钠溶液中加入适量BaCl2固体,溶液颜色变浅 | 说明碳酸钠溶液中存在水解平衡 |
| D | 向2支盛有5mL不同浓度NaHSO3溶液的试管中,同时加入2mL5%H2O2溶液,观察并比较实验现象 | 探究浓度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-27更新
|
381次组卷
|
2卷引用:辽宁省五校联考2023-2024学年高二上学期期末考试化学试题
名校
解题方法
8 . 硒是典型的半导体材料,在光照下导电性可提高近千倍。如图是从某工厂的硒化银半导体废料(含Ag2Se、Cu单质)中提取硒、银的工艺流程图:
(1)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子程式_______ 。
(2)已知:常温下Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图所示,反应②为_______ (写离子方程式);该反应的化学平衡常数的数量级为_______ 。 、SeO
、SeO 摩尔分数随pH的变化如图所示,则室温下SeO
摩尔分数随pH的变化如图所示,则室温下SeO 的Kh=
的Kh=________ 。_______ (写电极反应式)。

(1)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子程式
(2)已知:常温下Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图所示,反应②为

 、SeO
、SeO 摩尔分数随pH的变化如图所示,则室温下SeO
摩尔分数随pH的变化如图所示,则室温下SeO 的Kh=
的Kh=
您最近一年使用:0次
9 . 常温下,将0.05molBaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是
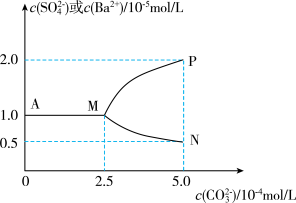

| A.相同温度时,Ksp(BaSO4)>Ksp(BaCO3) |
| B.BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大 |
C.若使 ,全部转化为 ,全部转化为 ,至少要加入 ,至少要加入 |
D.0.05molBaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小为 |
您最近一年使用:0次
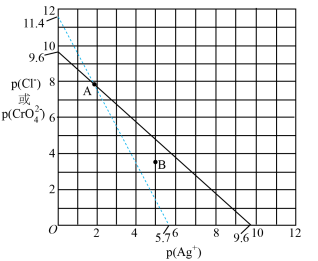
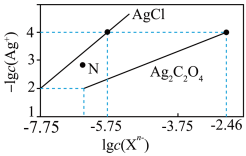
10 . 常温下,用 溶液分别滴定浓度均为
溶液分别滴定浓度均为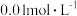 的
的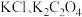 溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O
溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。其中Xn-表示
的水解)。其中Xn-表示 或
或 ,下列叙述错误的是
,下列叙述错误的是
 溶液分别滴定浓度均为
溶液分别滴定浓度均为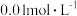 的
的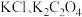 溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O
溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。其中Xn-表示
的水解)。其中Xn-表示 或
或 ,下列叙述错误的是
,下列叙述错误的是 
A.Ksp(Ag2C2O4)的数量级为 |
B. 点表示 点表示 的过饱和溶液 的过饱和溶液 |
C.向c(Cl-)=c(C2O )的混合溶液中滴入 )的混合溶液中滴入 溶液时,先生成 溶液时,先生成 沉淀 沉淀 |
D.常温下,Ag2C2O4(s)+2Cl-(aq) 2AgCl(s)+C2O 2AgCl(s)+C2O 的平衡常数为108.04 的平衡常数为108.04 |
您最近一年使用:0次



