1 . 碲是一种重要的战略稀缺元素,被誉为“现代工业的维生素”,是制造光电、半导体、制冷等元件不可缺少的关键材料。有色金属冶炼厂以电解精炼铜的阳极泥为原料,设计了如图新工艺提取、回收并制备高纯碲:
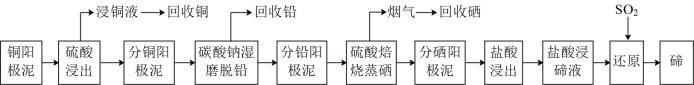
[25℃时,PbSO4和PbCO3的Ksp分别为1.6×10-5(mol·L-1)2、7.4×10-14(mol·L-1)2]
(1)写出冶炼厂电解精炼铜的阴极电极反应式:___ 。
(2)分铜阳极泥(含PbSO4)与Na2CO3混合“湿法球磨”,PbSO4可转化为PbCO3,此反应的化学方程式为___ 。若在1LPbSO4饱和溶液中加入10.6gNa2CO3固体(溶液体积变化忽略不计),则此时溶液中SO 的物质的量浓度为
的物质的量浓度为___ mol/L。
(3)分铅阳极泥经硫酸化焙烧蒸硒,产生的烟气中含SeO2与SO2,烟气在低温区用水吸收可回收硒,此过程中氧化产物和还原产物的物质的量之比为___ 。
(4)分硒阳极泥盐酸浸出液中Te4+用SO2还原可以得到单质碲,发生反应的方程式为:SO2+H2O=H2SO3,___ 。研究表明,Cl-离子浓度为0.1mol·L-1时的活化能比Cl-离子浓度为0.3mol·L-1时的活化能大,说明较高浓度Cl-可作该反应的__ 。
(5)整个工艺路线中可以循环利用的物质有(填化学式)___ 、__ 。

[25℃时,PbSO4和PbCO3的Ksp分别为1.6×10-5(mol·L-1)2、7.4×10-14(mol·L-1)2]
(1)写出冶炼厂电解精炼铜的阴极电极反应式:
(2)分铜阳极泥(含PbSO4)与Na2CO3混合“湿法球磨”,PbSO4可转化为PbCO3,此反应的化学方程式为
 的物质的量浓度为
的物质的量浓度为(3)分铅阳极泥经硫酸化焙烧蒸硒,产生的烟气中含SeO2与SO2,烟气在低温区用水吸收可回收硒,此过程中氧化产物和还原产物的物质的量之比为
(4)分硒阳极泥盐酸浸出液中Te4+用SO2还原可以得到单质碲,发生反应的方程式为:SO2+H2O=H2SO3,
(5)整个工艺路线中可以循环利用的物质有(填化学式)
您最近一年使用:0次
2 . 氮氧化物和硫氧化物污染已经成为一个世界性的环境问题,但只要合理利用也是重要的资源。
(1)亚硝酰氯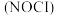 是有机合成中的重要试剂。它可由
是有机合成中的重要试剂。它可由 和
和 在通常条件下反应制得,反应方程式为
在通常条件下反应制得,反应方程式为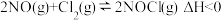 。在一个2L的恒容密闭容器中充入
。在一个2L的恒容密闭容器中充入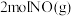 和
和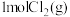 ,在温度分别为T1、T2时测得
,在温度分别为T1、T2时测得 的物质的量(单位:mol)与时间(单位:min)的关系如下表所示:温度/℃
的物质的量(单位:mol)与时间(单位:min)的关系如下表所示:温度/℃
①T1____ T2(填“>"、“<”或“=”)。
②温度为T1℃时,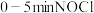 的平均反应速率为
的平均反应速率为___ 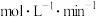 。
。
③温度为T2℃时,在相同容器中,充入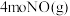 和
和 ,则
,则 的平衡转化率
的平衡转化率___ 50%(填“>”、“<”或“=”)。
④温度为T2℃时,起始时容器内的总压强为P0,则该反应的平衡常数Kp__ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)用石灰乳与 的混合物吸收
的混合物吸收 和
和 可得到
可得到 和
和 ,
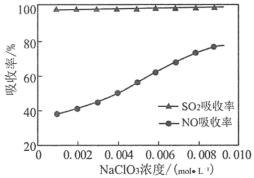
, 浓度变化对
浓度变化对 和
和 吸收率影响如下图所示,
吸收率影响如下图所示, 浓度变化对
浓度变化对 吸收率几乎无影响,而对
吸收率几乎无影响,而对 吸收率影响很大的原因是
吸收率影响很大的原因是___ 。
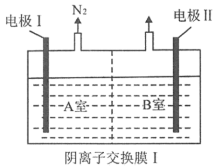
(3)用碱液脱硝是目前研究的课题之一、将NO、NO2通入氢氧化钠溶液中脱硝,可得到 、
、 的混合液。将该混合液和
的混合液。将该混合液和 溶液分别加到下图所示的电解槽中进行电解。写出A室
溶液分别加到下图所示的电解槽中进行电解。写出A室 发生的电极反应式
发生的电极反应式____ 。
(4)用 水悬浮液吸收经
水悬浮液吸收经 预处理过的含
预处理过的含 、
、 的烟气时,清液(
的烟气时,清液( 约为8)中
约为8)中 将
将 转化成
转化成 。
。
①反应的离子方程式为____ 。
② 水悬浮液中加入
水悬浮液中加入 溶液,达到平衡后溶液中
溶液,达到平衡后溶液中
____ [用 、
、 和
和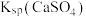 表示]。
表示]。
③ 水悬浮液中加入
水悬浮液中加入 浓溶液能提高
浓溶液能提高 的吸收速率,其主要原因是
的吸收速率,其主要原因是____ 。
(1)亚硝酰氯
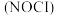 是有机合成中的重要试剂。它可由
是有机合成中的重要试剂。它可由 和
和 在通常条件下反应制得,反应方程式为
在通常条件下反应制得,反应方程式为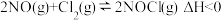 。在一个2L的恒容密闭容器中充入
。在一个2L的恒容密闭容器中充入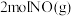 和
和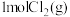 ,在温度分别为T1、T2时测得
,在温度分别为T1、T2时测得 的物质的量(单位:mol)与时间(单位:min)的关系如下表所示:温度/℃
的物质的量(单位:mol)与时间(单位:min)的关系如下表所示:温度/℃| 0 | 5 | 8 | 13 | |
| T1 | 2 | 1.5 | 1.3 | 1.0 |
| T2 | 2 | 1.15 | 1.0 | 1.0 |
②温度为T1℃时,
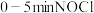 的平均反应速率为
的平均反应速率为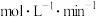 。
。③温度为T2℃时,在相同容器中,充入
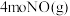 和
和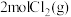 ,则
,则 的平衡转化率
的平衡转化率④温度为T2℃时,起始时容器内的总压强为P0,则该反应的平衡常数Kp
(2)用石灰乳与
 的混合物吸收
的混合物吸收 和
和 可得到
可得到 和
和 ,
, 浓度变化对
浓度变化对 和
和 吸收率影响如下图所示,
吸收率影响如下图所示, 浓度变化对
浓度变化对 吸收率几乎无影响,而对
吸收率几乎无影响,而对 吸收率影响很大的原因是
吸收率影响很大的原因是
(3)用碱液脱硝是目前研究的课题之一、将NO、NO2通入氢氧化钠溶液中脱硝,可得到
 、
、 的混合液。将该混合液和
的混合液。将该混合液和 溶液分别加到下图所示的电解槽中进行电解。写出A室
溶液分别加到下图所示的电解槽中进行电解。写出A室 发生的电极反应式
发生的电极反应式
(4)用
 水悬浮液吸收经
水悬浮液吸收经 预处理过的含
预处理过的含 、
、 的烟气时,清液(
的烟气时,清液( 约为8)中
约为8)中 将
将 转化成
转化成 。
。①反应的离子方程式为
②
 水悬浮液中加入
水悬浮液中加入 溶液,达到平衡后溶液中
溶液,达到平衡后溶液中
 、
、 和
和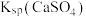 表示]。
表示]。③
 水悬浮液中加入
水悬浮液中加入 浓溶液能提高
浓溶液能提高 的吸收速率,其主要原因是
的吸收速率,其主要原因是
您最近一年使用:0次
2021-04-26更新
|
263次组卷
|
2卷引用:2020年北京高考化学真题变式题11-19
20-21高三上·全国·阶段练习
3 . 钪(Sc)是一种三价金属元素,主要用于生产合金。“赤泥”是铝土矿加工过程中的废料,赤泥中各成分的含量如下表所示:
一种从其中获得氧化钪和钛白粉(TiO2)的生产工艺流程如下图所示:
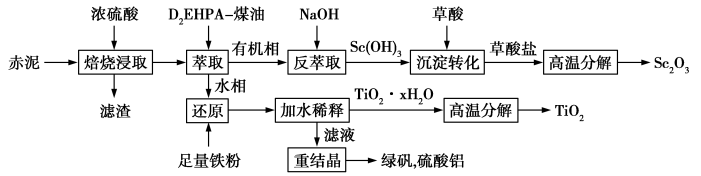
(1)“焙烧浸取”时需要搅拌,目的是_______ ,滤渣中质量分数最高的成分是_______ 。
(2)该工艺条件下,溶液中相关离子开始沉淀和完全沉淀的pH如下表所示:
向“水相”中加入铁粉的目的是___ ,“还原”中反应的离子方程式有__ 。“加水稀释”时应控制溶液的pH为___ 。
(3)“沉淀转化”中,需加入适当过量的草酸,原因是___ ,反应的化学方程式是___ 。
(4)以上过程中得到的Sc2O3再经过反应制得无水ScCl3,熔融后电解可得到金属钪,该反应的阳极反应式为___ 。
| 成分 | SiO2 | Al2O3 | Fe2O3 | TiO2 | Na2O | CaO | Sc2O3 | 其他 |
| 含量/% | 9.20 | 22.62 | 31.84 | 7.91 | 2.16 | 8.58 | 0.01 | 17.68 |
一种从其中获得氧化钪和钛白粉(TiO2)的生产工艺流程如下图所示:

(1)“焙烧浸取”时需要搅拌,目的是
(2)该工艺条件下,溶液中相关离子开始沉淀和完全沉淀的pH如下表所示:
| 离子 | Fe3+ | Fe2+ | Al3+ | TiO2+ |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 0.3 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 | 2.0 |
向“水相”中加入铁粉的目的是
(3)“沉淀转化”中,需加入适当过量的草酸,原因是
(4)以上过程中得到的Sc2O3再经过反应制得无水ScCl3,熔融后电解可得到金属钪,该反应的阳极反应式为
您最近一年使用:0次
名校
解题方法
4 . 锰是一种非常重要的金属元素,在很多领域有着广泛的应用。利用废铁屑还原浸出低品位软锰矿制备MnSO4,然后通过电解制备金属Mn,其工业流程图如图:
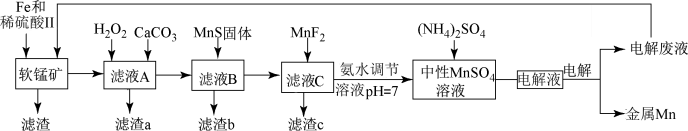
已知:i.低品位软锰矿主要成份有MnO2、Al2O3、Fe2O3、Cu2(OH)2CO3、CaCO3、SiO2等;
ii.常温下部分金属离子以氢氧化物沉淀时的pH;
iii.几种化合物的溶解性或溶度积数据(Ksp)
(1)研究表明,单质Fe和Fe2+都可以还原MnO2。在硫酸存在的条件下,MnO2将Fe氧化为Fe3+的离子方程式是________ 。
(2)滤液A先用H2O2处理,然后加入CaCO3,反应后溶液的pH约为5。滤渣a的主要成分中含有黄铵铁矾[NH4Fe3(SO4)2(OH)6]。
①H2O2的作用是______ (用离子方程式表示)。
②滤渣a中除了黄铵铁矾,主要成分还有X。用平衡移动原理解释产生X的原因_________ 。
(3)MnS固体的作用为_________ (用离子方程式表示)。
(4)滤渣c的成分是________ 。
(5)利用如图装置模拟工业流程图中的“电解”步骤制金属Mn。
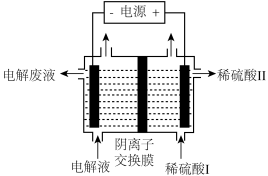
①阳极的电极反应式是_____ 。
②阴极的电极反应为Mn2++2e-=Mn和2H++2e-=H2↑。电极上H2的产生会引起制得的锰起壳开裂,降低产品质量。向滤液C中加入氨水调节溶液pH=7,除了考虑到物质循环利用、降低能耗以外,其他的原因是________ 。
③电解前,向中性MnSO4溶液中加入(NH4)2SO4的作用除了增大溶液导电性之外,还有____ (结合电极反应式和离子方程式解释)。

已知:i.低品位软锰矿主要成份有MnO2、Al2O3、Fe2O3、Cu2(OH)2CO3、CaCO3、SiO2等;
ii.常温下部分金属离子以氢氧化物沉淀时的pH;
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Cu2+ |
| 开始沉淀的pH | 6.8 | 1.8 | 3.7 | 8.6 | 5.2 |
| 沉淀完全的pH | 8.3 | 2.8 | 4.7 | 10.1 | 6.7 |
iii.几种化合物的溶解性或溶度积数据(Ksp)
| MnF2 | CaS | MnS | FeS | CuS |
| 溶于水 | 溶于水 | 2.5×10-13 | 6.3×10-18 | 6.3×10-36 |
(1)研究表明,单质Fe和Fe2+都可以还原MnO2。在硫酸存在的条件下,MnO2将Fe氧化为Fe3+的离子方程式是
(2)滤液A先用H2O2处理,然后加入CaCO3,反应后溶液的pH约为5。滤渣a的主要成分中含有黄铵铁矾[NH4Fe3(SO4)2(OH)6]。
①H2O2的作用是
②滤渣a中除了黄铵铁矾,主要成分还有X。用平衡移动原理解释产生X的原因
(3)MnS固体的作用为
(4)滤渣c的成分是
(5)利用如图装置模拟工业流程图中的“电解”步骤制金属Mn。

①阳极的电极反应式是
②阴极的电极反应为Mn2++2e-=Mn和2H++2e-=H2↑。电极上H2的产生会引起制得的锰起壳开裂,降低产品质量。向滤液C中加入氨水调节溶液pH=7,除了考虑到物质循环利用、降低能耗以外,其他的原因是
③电解前,向中性MnSO4溶液中加入(NH4)2SO4的作用除了增大溶液导电性之外,还有
您最近一年使用:0次
名校
解题方法
5 . 某研究小组探究 AgCl 沉淀向 Ag2S 转化过程中发生了异常,并进一步探究原因:
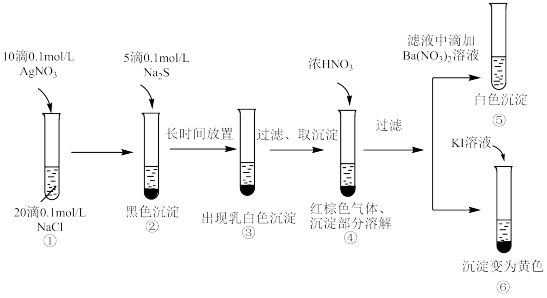
(1)写出试管①中产生白色沉淀的离子方程式:______________________________
(2)用化学方程式表示试管②中产生黑色沉淀的原因:__________________________
(3)试管④中加入浓 HNO3 后的离子反应方程式为:___________________________
(4)该小组为探究③中乳白色沉淀的原因可能与空气中的氧气有关,设计如下装置:
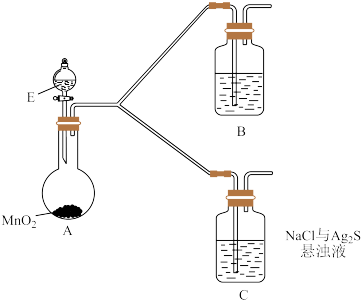
①E中加入的是___________________ 溶液。
②B中盛放的物质是_____________________ 。
③该小组认为 C 中产生沉淀的反应如下(请补充完整):_______
2Ag2S + +
+  + 2H2O
+ 2H2O 2 S +
2 S +  +4
+4
④请解释 B、C 现象不同的原因_________________________________________ 。
(5)为了避免在 AgCl 沉淀向 Ag2S 转化过程中出现异常现象,需要控制的反应条件是________________________________________ 。

(1)写出试管①中产生白色沉淀的离子方程式:
(2)用化学方程式表示试管②中产生黑色沉淀的原因:
(3)试管④中加入浓 HNO3 后的离子反应方程式为:
(4)该小组为探究③中乳白色沉淀的原因可能与空气中的氧气有关,设计如下装置:

现 象 | B:一段时间后, 无明显变化 |
| C:一段时间后,出现乳白色沉淀 |
②B中盛放的物质是
③该小组认为 C 中产生沉淀的反应如下(请补充完整):
2Ag2S +
 + 2H2O
+ 2H2O 2 S +
2 S +  +4
+4
④请解释 B、C 现象不同的原因
(5)为了避免在 AgCl 沉淀向 Ag2S 转化过程中出现异常现象,需要控制的反应条件是
您最近一年使用:0次
名校
解题方法
6 . 研究和深度开发CO、CO2和H2的应用对构建生态文明社会具有重要的意义,已知工业生产中有如下反应:
①CO(g)+2H2(g) CH3OH(g);△H= -99 kJ/mol
CH3OH(g);△H= -99 kJ/mol
②CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H= -58 kJ/mol
CH3OH(g)+H2O(g);△H= -58 kJ/mol
③CO2(g)+H2(g) CO(g)+H2O(g);△H
CO(g)+H2O(g);△H
(1)反应①的化学平衡常数K的表达式为_________________ ;反应③的△H=_________ kJ/mol。
(2)合成气的组成 =2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图1所示。
=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图1所示。

图中的压强P1、P2、 P3由大到小顺序为___________ ;a(CO)值随 温度升高而减小,其原因是_____________ 。
(3)工业生产中需对空气中的CO进行监测。使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图2所示。这种传感器利用了原电池原理,则该电池的负极反应式为______________ 。


(4)某催化剂可将CO2和CH4转化成乙酸。催化剂的催化效率和乙酸的生成速率随温度的变化关系如图3所示。乙酸的生成速率主要取决于温度影响的范围是_________ 。
(5)常温下,将一定量的CO2通入石灰乳中充分反应,达平衡后,溶液的pH为11,则c( )=
)=___________ 。 (已知:Ksp[Ca(OH)2]=5.6×10-6,Ksp(CaCO3) =2.8×10-9)。
①CO(g)+2H2(g)
 CH3OH(g);△H= -99 kJ/mol
CH3OH(g);△H= -99 kJ/mol②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);△H= -58 kJ/mol
CH3OH(g)+H2O(g);△H= -58 kJ/mol③CO2(g)+H2(g)
 CO(g)+H2O(g);△H
CO(g)+H2O(g);△H(1)反应①的化学平衡常数K的表达式为
(2)合成气的组成
 =2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图1所示。
=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图1所示。
图中的压强P1、P2、 P3由大到小顺序为
(3)工业生产中需对空气中的CO进行监测。使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图2所示。这种传感器利用了原电池原理,则该电池的负极反应式为


(4)某催化剂可将CO2和CH4转化成乙酸。催化剂的催化效率和乙酸的生成速率随温度的变化关系如图3所示。乙酸的生成速率主要取决于温度影响的范围是
(5)常温下,将一定量的CO2通入石灰乳中充分反应,达平衡后,溶液的pH为11,则c(
 )=
)=
您最近一年使用:0次
7 . (1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的 SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=c kJ/mol。
则反应 2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 ΔH=____ kJ/mol。
(2)SO2是形成酸雨的主要污染物,燃煤脱硫原理为 2CaO(s)+2SO2(g)+O2(g)⇌2CaSO4(s)。向 10L 恒温恒容密闭容器中加入 3mol CaO,并通入 2mol SO2和 lmol O2发生上述反应,2min时达平衡,此时 CaSO4为1.8mol。0〜2min 内,用 SO2表示的该反应的速率v(SO2)=____ ,其他条件保持不变,若上述反应在恒压条件下进行,达到平衡时 SO2的转化率____ (填“增大”、“减小”或“不变”)。
(3)NO 的排放主要来自于汽车尾气,净化原理为:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH=−746.8kJ/mol。实验测得,v正=k正·c2(NO)·c2(CO),v 逆=k逆·c(N2)·c2(CO2)(k 正、k 逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____ (填“>”“<”或“=”)k逆增大的倍数。
②若在 1L 的密闭容器中充入 1molCO 和 1mol NO,在一定温度下达到平衡时,CO 的转化率为 40%,则k正︰k逆=____ 。
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
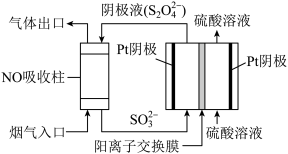
①阴极区的电极反应式为____ 。
②NO 吸收转化后的主要产物为 NH4+,若通电时电路中转移了 0.3mol e-,则此通电过程中理论上吸收的 NO 在标准状况下的体积为____ mL。
(5)欲用 5L Na2CO3溶液将 23.3g BaSO4固体全都转化为 BaCO3,则所用的 Na2CO3溶液的物质的量浓度至少为____ 。[已知:常温下K(BaSO4)=1×10−7、K(BaCO3)=2.5×10−6]。(忽略溶液体积的变化)
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=c kJ/mol。
则反应 2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 ΔH=
(2)SO2是形成酸雨的主要污染物,燃煤脱硫原理为 2CaO(s)+2SO2(g)+O2(g)⇌2CaSO4(s)。向 10L 恒温恒容密闭容器中加入 3mol CaO,并通入 2mol SO2和 lmol O2发生上述反应,2min时达平衡,此时 CaSO4为1.8mol。0〜2min 内,用 SO2表示的该反应的速率v(SO2)=
(3)NO 的排放主要来自于汽车尾气,净化原理为:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH=−746.8kJ/mol。实验测得,v正=k正·c2(NO)·c2(CO),v 逆=k逆·c(N2)·c2(CO2)(k 正、k 逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数
②若在 1L 的密闭容器中充入 1molCO 和 1mol NO,在一定温度下达到平衡时,CO 的转化率为 40%,则k正︰k逆=
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

①阴极区的电极反应式为
②NO 吸收转化后的主要产物为 NH4+,若通电时电路中转移了 0.3mol e-,则此通电过程中理论上吸收的 NO 在标准状况下的体积为
(5)欲用 5L Na2CO3溶液将 23.3g BaSO4固体全都转化为 BaCO3,则所用的 Na2CO3溶液的物质的量浓度至少为
您最近一年使用:0次
2020-05-15更新
|
258次组卷
|
2卷引用:天津市滨海新区2020年4月高三统考化学试题
解题方法
8 .  在工业上可作蓄电池中良好的正极材料。以废铅蓄电池拆解出来的“铅泥”(主要成分为
在工业上可作蓄电池中良好的正极材料。以废铅蓄电池拆解出来的“铅泥”(主要成分为 ,另有少量Pb、
,另有少量Pb、 和
和 等)为原料制备
等)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:

已知:i.常温下,单质铅与盐酸或硫酸几乎都不反应。
ii.铅盐中,(CH3COO)2Pb、Pb(NO3)2均易溶于水, 难溶于水。
难溶于水。
请回答下列问题:
(1)“酸溶”时,Pb和PbO2转化为可溶性Pb2+盐,则“酸溶”时所用的强酸X为____ ;此条件下的氧化性:X___ PbO2(选填“>”或“<”)
(2)用Pb(NO3)2溶液反复多次洗涤沉淀,以达到“除钙”的目的,其原理是_____________ 。
(3)(CH3COO)2Pb属于__________ (选填“强电解质”或“弱电解质”);“滤液3”中除CH3COONa和NaClO外,所含钠盐主要还有___________ (填化学式)
(4)“析铅”反应的离子方程式为____________________ 。
(5)从环境保护的角度分析,该工艺流程可能存在的缺点是_______________ (任写一条)
(6)铅蓄电池中的电解液是H2SO4,放电后两个电极上均沉积有PbSO4。则放电时的负极反应式为___ ;充电时当电极上通过1mol电子,阳极的质量减少__________ g。
 在工业上可作蓄电池中良好的正极材料。以废铅蓄电池拆解出来的“铅泥”(主要成分为
在工业上可作蓄电池中良好的正极材料。以废铅蓄电池拆解出来的“铅泥”(主要成分为 ,另有少量Pb、
,另有少量Pb、 和
和 等)为原料制备
等)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
已知:i.常温下,单质铅与盐酸或硫酸几乎都不反应。
ii.铅盐中,(CH3COO)2Pb、Pb(NO3)2均易溶于水,
 难溶于水。
难溶于水。请回答下列问题:
(1)“酸溶”时,Pb和PbO2转化为可溶性Pb2+盐,则“酸溶”时所用的强酸X为
(2)用Pb(NO3)2溶液反复多次洗涤沉淀,以达到“除钙”的目的,其原理是
(3)(CH3COO)2Pb属于
(4)“析铅”反应的离子方程式为
(5)从环境保护的角度分析,该工艺流程可能存在的缺点是
(6)铅蓄电池中的电解液是H2SO4,放电后两个电极上均沉积有PbSO4。则放电时的负极反应式为
您最近一年使用:0次
解题方法
9 . 最近有科学家提出“绿色自由”的构想:把含有CO2的空气吹入K2CO3溶液中,然后再用高温水气分解出CO2,经与H2化合后转变为甲醇燃料.
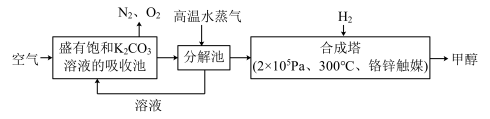
(1)在整个生产过程中饱和K2CO3溶液的作用是_______ ;不用KOH溶液的理由是_________ 。
(2)在合成塔中,每44g CO2与足量H2完全反应生成甲醇时,可放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式_______________ ;转化过程中可循环利用的物质除了K2CO3外,还有___________ 。
(3)请评述合成时选择2×105Pa的理由_____________________________________ 。
(4)BaCO3的溶解平衡可以表示为 BaCO3(s)⇌Ba2++CO32﹣
①写出平衡常数表达式___________________ ;
②用重量法测定空气中CO2的体积分数时,选用Ba(OH)2而不是Ca(OH)2为沉淀剂,原因之一是:25℃时,BaCO3的溶解平衡常数K=2.58×10﹣9,而CaCO3的溶解平衡常数K=4.96×10﹣9;原因之二是_________________________ 。
(5)某同学很快就判断出以下中长石风化的离子方程式未配平:
4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O=2Na++2Ca2++5HCO3﹣+4H4SiO4+3Al2SiO5(OH)4
该同学判断的角度是______________ 。
(6)甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O该电池负极的电极反应式为:CH3OH﹣6e+8OH﹣=CO32﹣+6H2O则正极的电极反应式为:______________ 。

(1)在整个生产过程中饱和K2CO3溶液的作用是
(2)在合成塔中,每44g CO2与足量H2完全反应生成甲醇时,可放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式
(3)请评述合成时选择2×105Pa的理由
(4)BaCO3的溶解平衡可以表示为 BaCO3(s)⇌Ba2++CO32﹣
①写出平衡常数表达式
②用重量法测定空气中CO2的体积分数时,选用Ba(OH)2而不是Ca(OH)2为沉淀剂,原因之一是:25℃时,BaCO3的溶解平衡常数K=2.58×10﹣9,而CaCO3的溶解平衡常数K=4.96×10﹣9;原因之二是
(5)某同学很快就判断出以下中长石风化的离子方程式未配平:
4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O=2Na++2Ca2++5HCO3﹣+4H4SiO4+3Al2SiO5(OH)4
该同学判断的角度是
(6)甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O该电池负极的电极反应式为:CH3OH﹣6e+8OH﹣=CO32﹣+6H2O则正极的电极反应式为:
您最近一年使用:0次
10 . 某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。
【查阅资料】
【实验探究】
(一)探究BaCO3和BaSO4之间的转化,实验操作如下所示:
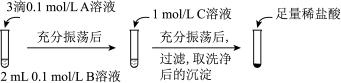
(1)实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入稀盐酸后,__________ 。
(2)实验Ⅱ中加入稀盐酸后发生反应的离子方程式是_________ 。
(3)实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:___________ 。
(二)探究AgCl和AgI之间的转化。
(4)实验Ⅲ:证明AgCl转化为AgI。
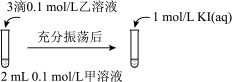
甲溶液可以是______ (填字母代号)。
a AgNO3溶液 b NaCl溶液 c KI溶液
(5)实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①查阅有关资料可知,Ag+可氧化I-,但AgNO3溶液与KI溶液混合总是得到AgI沉淀,原因是氧化还原反应速率__________ (填“大于”或“小于”)沉淀反应速率。设计(-)石墨(s)[I-(aq)//Ag+(aq)]石墨(s)(+)原电池(使用盐桥阻断Ag+与I-的相互接触)如上图所示,则该原电池总反应的离子方程式为________ 。
②结合信息,解释实验Ⅳ中b<a的原因:__________ 。
③实验Ⅳ的现象能说明AgI转化为AgCl,理由是_________ 。
【实验结论】溶解度小的沉淀容易转化为溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化溶解度较大的沉淀越难实现。
【查阅资料】
| 物质 | BaSO4 | BaCO3 | AgI | AgCl |
| 溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(一)探究BaCO3和BaSO4之间的转化,实验操作如下所示:

| 试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
| 实验Ⅰ | ||||
| 实验Ⅱ | BaCl2 | |||
| Na2CO3 | Na2SO4 | …… | ||
| Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
(2)实验Ⅱ中加入稀盐酸后发生反应的离子方程式是
(3)实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:
(二)探究AgCl和AgI之间的转化。
(4)实验Ⅲ:证明AgCl转化为AgI。

甲溶液可以是
a AgNO3溶液 b NaCl溶液 c KI溶液
(5)实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
| 装置 | 步骤 | 电压表读数 |
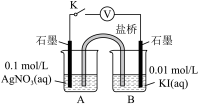 | ||
| ⅰ.按图连接装置并加入试剂,闭合K | a | |
| ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | |
| ⅲ.再向B中投入一定量NaCl(s) | c | |
| ⅳ.重复ⅰ,再向B中加入与ⅲ等量的NaCl(s) | a |
①查阅有关资料可知,Ag+可氧化I-,但AgNO3溶液与KI溶液混合总是得到AgI沉淀,原因是氧化还原反应速率
②结合信息,解释实验Ⅳ中b<a的原因:
③实验Ⅳ的现象能说明AgI转化为AgCl,理由是
【实验结论】溶解度小的沉淀容易转化为溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化溶解度较大的沉淀越难实现。
您最近一年使用:0次



