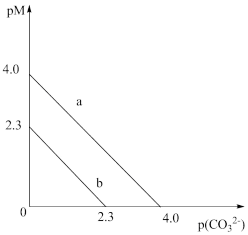
1 . T℃时,两种碳酸盐 (M表示
(M表示 或
或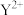 )的沉淀溶解平衡曲线如图所示。已知:
)的沉淀溶解平衡曲线如图所示。已知: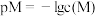 ,
,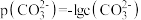 ,
,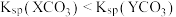 。下列说法正确的是
。下列说法正确的是
 (M表示
(M表示 或
或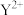 )的沉淀溶解平衡曲线如图所示。已知:
)的沉淀溶解平衡曲线如图所示。已知: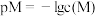 ,
,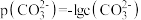 ,
,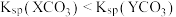 。下列说法正确的是
。下列说法正确的是
A.a表示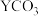 的沉淀溶解平衡曲线 的沉淀溶解平衡曲线 |
B. |
C.T℃时,向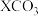 悬浊液中加入饱和 悬浊液中加入饱和 溶液,可能有 溶液,可能有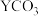 生成 生成 |
D.T℃时,向饱和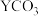 溶液中加入 溶液中加入 溶液,一定能产生 溶液,一定能产生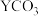 沉淀 沉淀 |
您最近半年使用:0次
2021-12-13更新
|
123次组卷
|
7卷引用:山东省日照市2020届高三校际联合考试(二模)化学试题
2 . 碲是一种重要的战略稀缺元素,被誉为“现代工业的维生素”,是制造光电、半导体、制冷等元件不可缺少的关键材料。有色金属冶炼厂以电解精炼铜的阳极泥为原料,设计了如图新工艺提取、回收并制备高纯碲:
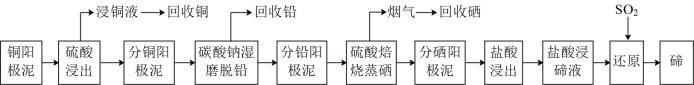
[25℃时,PbSO4和PbCO3的Ksp分别为1.6×10-5(mol·L-1)2、7.4×10-14(mol·L-1)2]
(1)写出冶炼厂电解精炼铜的阴极电极反应式:___ 。
(2)分铜阳极泥(含PbSO4)与Na2CO3混合“湿法球磨”,PbSO4可转化为PbCO3,此反应的化学方程式为___ 。若在1LPbSO4饱和溶液中加入10.6gNa2CO3固体(溶液体积变化忽略不计),则此时溶液中SO 的物质的量浓度为
的物质的量浓度为___ mol/L。
(3)分铅阳极泥经硫酸化焙烧蒸硒,产生的烟气中含SeO2与SO2,烟气在低温区用水吸收可回收硒,此过程中氧化产物和还原产物的物质的量之比为___ 。
(4)分硒阳极泥盐酸浸出液中Te4+用SO2还原可以得到单质碲,发生反应的方程式为:SO2+H2O=H2SO3,___ 。研究表明,Cl-离子浓度为0.1mol·L-1时的活化能比Cl-离子浓度为0.3mol·L-1时的活化能大,说明较高浓度Cl-可作该反应的__ 。
(5)整个工艺路线中可以循环利用的物质有(填化学式)___ 、__ 。

[25℃时,PbSO4和PbCO3的Ksp分别为1.6×10-5(mol·L-1)2、7.4×10-14(mol·L-1)2]
(1)写出冶炼厂电解精炼铜的阴极电极反应式:
(2)分铜阳极泥(含PbSO4)与Na2CO3混合“湿法球磨”,PbSO4可转化为PbCO3,此反应的化学方程式为
 的物质的量浓度为
的物质的量浓度为(3)分铅阳极泥经硫酸化焙烧蒸硒,产生的烟气中含SeO2与SO2,烟气在低温区用水吸收可回收硒,此过程中氧化产物和还原产物的物质的量之比为
(4)分硒阳极泥盐酸浸出液中Te4+用SO2还原可以得到单质碲,发生反应的方程式为:SO2+H2O=H2SO3,
(5)整个工艺路线中可以循环利用的物质有(填化学式)
您最近半年使用:0次
3 . 氮氧化物和硫氧化物污染已经成为一个世界性的环境问题,但只要合理利用也是重要的资源。
(1)亚硝酰氯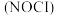 是有机合成中的重要试剂。它可由
是有机合成中的重要试剂。它可由 和
和 在通常条件下反应制得,反应方程式为
在通常条件下反应制得,反应方程式为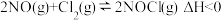 。在一个2L的恒容密闭容器中充入
。在一个2L的恒容密闭容器中充入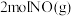 和
和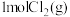 ,在温度分别为T1、T2时测得
,在温度分别为T1、T2时测得 的物质的量(单位:mol)与时间(单位:min)的关系如下表所示:温度/℃
的物质的量(单位:mol)与时间(单位:min)的关系如下表所示:温度/℃
①T1____ T2(填“>"、“<”或“=”)。
②温度为T1℃时,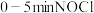 的平均反应速率为
的平均反应速率为___ 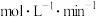 。
。
③温度为T2℃时,在相同容器中,充入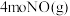 和
和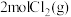 ,则
,则 的平衡转化率
的平衡转化率___ 50%(填“>”、“<”或“=”)。
④温度为T2℃时,起始时容器内的总压强为P0,则该反应的平衡常数Kp__ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
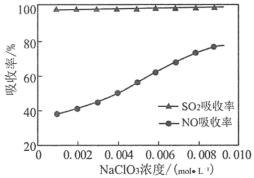
(2)用石灰乳与 的混合物吸收
的混合物吸收 和
和 可得到
可得到 和
和 ,
, 浓度变化对
浓度变化对 和
和 吸收率影响如下图所示,
吸收率影响如下图所示, 浓度变化对
浓度变化对 吸收率几乎无影响,而对
吸收率几乎无影响,而对 吸收率影响很大的原因是
吸收率影响很大的原因是___ 。
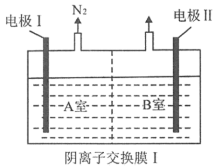
(3)用碱液脱硝是目前研究的课题之一、将NO、NO2通入氢氧化钠溶液中脱硝,可得到 、
、 的混合液。将该混合液和
的混合液。将该混合液和 溶液分别加到下图所示的电解槽中进行电解。写出A室
溶液分别加到下图所示的电解槽中进行电解。写出A室 发生的电极反应式
发生的电极反应式____ 。
(4)用 水悬浮液吸收经
水悬浮液吸收经 预处理过的含
预处理过的含 、
、 的烟气时,清液(
的烟气时,清液( 约为8)中
约为8)中 将
将 转化成
转化成 。
。
①反应的离子方程式为____ 。
② 水悬浮液中加入
水悬浮液中加入 溶液,达到平衡后溶液中
溶液,达到平衡后溶液中
____ [用 、
、 和
和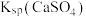 表示]。
表示]。
③ 水悬浮液中加入
水悬浮液中加入 浓溶液能提高
浓溶液能提高 的吸收速率,其主要原因是
的吸收速率,其主要原因是____ 。
(1)亚硝酰氯
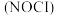 是有机合成中的重要试剂。它可由
是有机合成中的重要试剂。它可由 和
和 在通常条件下反应制得,反应方程式为
在通常条件下反应制得,反应方程式为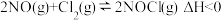 。在一个2L的恒容密闭容器中充入
。在一个2L的恒容密闭容器中充入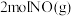 和
和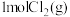 ,在温度分别为T1、T2时测得
,在温度分别为T1、T2时测得 的物质的量(单位:mol)与时间(单位:min)的关系如下表所示:温度/℃
的物质的量(单位:mol)与时间(单位:min)的关系如下表所示:温度/℃| 0 | 5 | 8 | 13 | |
| T1 | 2 | 1.5 | 1.3 | 1.0 |
| T2 | 2 | 1.15 | 1.0 | 1.0 |
②温度为T1℃时,
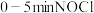 的平均反应速率为
的平均反应速率为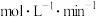 。
。③温度为T2℃时,在相同容器中,充入
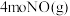 和
和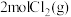 ,则
,则 的平衡转化率
的平衡转化率④温度为T2℃时,起始时容器内的总压强为P0,则该反应的平衡常数Kp
(2)用石灰乳与
 的混合物吸收
的混合物吸收 和
和 可得到
可得到 和
和 ,
, 浓度变化对
浓度变化对 和
和 吸收率影响如下图所示,
吸收率影响如下图所示, 浓度变化对
浓度变化对 吸收率几乎无影响,而对
吸收率几乎无影响,而对 吸收率影响很大的原因是
吸收率影响很大的原因是
(3)用碱液脱硝是目前研究的课题之一、将NO、NO2通入氢氧化钠溶液中脱硝,可得到
 、
、 的混合液。将该混合液和
的混合液。将该混合液和 溶液分别加到下图所示的电解槽中进行电解。写出A室
溶液分别加到下图所示的电解槽中进行电解。写出A室 发生的电极反应式
发生的电极反应式
(4)用
 水悬浮液吸收经
水悬浮液吸收经 预处理过的含
预处理过的含 、
、 的烟气时,清液(
的烟气时,清液( 约为8)中
约为8)中 将
将 转化成
转化成 。
。①反应的离子方程式为
②
 水悬浮液中加入
水悬浮液中加入 溶液,达到平衡后溶液中
溶液,达到平衡后溶液中
 、
、 和
和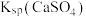 表示]。
表示]。③
 水悬浮液中加入
水悬浮液中加入 浓溶液能提高
浓溶液能提高 的吸收速率,其主要原因是
的吸收速率,其主要原因是
您最近半年使用:0次
2021-04-26更新
|
260次组卷
|
2卷引用:2020年北京高考化学真题变式题11-19
20-21高三上·全国·阶段练习
4 . 钪(Sc)是一种三价金属元素,主要用于生产合金。“赤泥”是铝土矿加工过程中的废料,赤泥中各成分的含量如下表所示:
一种从其中获得氧化钪和钛白粉(TiO2)的生产工艺流程如下图所示:
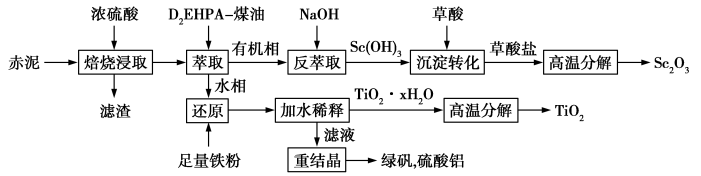
(1)“焙烧浸取”时需要搅拌,目的是_______ ,滤渣中质量分数最高的成分是_______ 。
(2)该工艺条件下,溶液中相关离子开始沉淀和完全沉淀的pH如下表所示:
向“水相”中加入铁粉的目的是___ ,“还原”中反应的离子方程式有__ 。“加水稀释”时应控制溶液的pH为___ 。
(3)“沉淀转化”中,需加入适当过量的草酸,原因是___ ,反应的化学方程式是___ 。
(4)以上过程中得到的Sc2O3再经过反应制得无水ScCl3,熔融后电解可得到金属钪,该反应的阳极反应式为___ 。
| 成分 | SiO2 | Al2O3 | Fe2O3 | TiO2 | Na2O | CaO | Sc2O3 | 其他 |
| 含量/% | 9.20 | 22.62 | 31.84 | 7.91 | 2.16 | 8.58 | 0.01 | 17.68 |
一种从其中获得氧化钪和钛白粉(TiO2)的生产工艺流程如下图所示:

(1)“焙烧浸取”时需要搅拌,目的是
(2)该工艺条件下,溶液中相关离子开始沉淀和完全沉淀的pH如下表所示:
| 离子 | Fe3+ | Fe2+ | Al3+ | TiO2+ |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 0.3 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 | 2.0 |
向“水相”中加入铁粉的目的是
(3)“沉淀转化”中,需加入适当过量的草酸,原因是
(4)以上过程中得到的Sc2O3再经过反应制得无水ScCl3,熔融后电解可得到金属钪,该反应的阳极反应式为
您最近半年使用:0次
名校
解题方法
5 . 根据下列实验操作和现象所得出的结论正确的是
实验内容 | 实验结论 | |
A | 向1mL0.1mol·L-1NaOH溶液中加入2mL0.1mol·L-1CuSO4溶液,振荡后滴加0.5mL葡萄糖溶液,加热未出现红色沉淀 | 葡萄糖中不含有醛基 |
B | 向1mL0.2mol·L-1NaOH溶液中滴入2滴0.1mol·L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol·L-1FeCl3溶液,又生成红褐色沉淀 | 在相同温度下,Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
C | 测定同温度下相同物质的量浓度的碳酸钠和硫酸钠溶液的pH,前者大于后者 | 碳元素非金属性弱于硫 |
D | 向某溶液中滴加少量稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 溶液中不含 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2021-03-07更新
|
1876次组卷
|
5卷引用:江苏省苏州市相城区陆慕高级中学2021届高三上学期期中考试化学试卷
江苏省苏州市相城区陆慕高级中学2021届高三上学期期中考试化学试卷(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题11-13)江苏省镇江第一中学2023-2024学年高三上学期期初阶段学情检测化学试题
名校
解题方法
6 . 有关下列说法中,正确的是
| A.用标准盐酸滴定未知浓度的NaOH溶液,滴定前酸式滴定管尖嘴有气泡未排出,滴定后气泡消失,会造成测定结果偏低。 |
| B.工业废水中的Cu2+、Hg2+等重金属阳离子可以通过加入FeS除去 |
| C.在米汤中加入食盐,可以检验食盐中是否加碘 |
| D.等体积的pH均为2的酸HA和HB的溶液分别与足量的铁粉反应,HA放出的H2多,说明HA酸性强 |
您最近半年使用:0次
2020-12-30更新
|
226次组卷
|
2卷引用:江苏省启东中学2020-2021学年高二上学期第二次月考化学试题
7 . 25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是
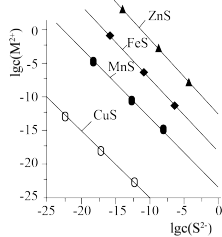

| A.25℃时Ksp(CuS)约为1×10-35 |
| B.向含有ZnS和Na2S的浊液中滴加CuSO4溶液,生成黑色沉淀,可证明:Ksp(CuS)<Ksp(ZnS) |
| C.向Cu2+浓度为10-5mol/L的工业废水中加入ZnS粉末,会有CuS沉淀析出 |
| D.向100mLZn2+、Cu2+浓度均为10-5mol•L-1的混合溶液中逐滴加入10-4mol•L-1的Na2S溶液,Cu2+先沉淀 |
您最近半年使用:0次
2020-12-25更新
|
668次组卷
|
5卷引用:重庆市第八中学2020-2021学年高二上学期第一次月考化学试题
8 . 下列有关实验现象和解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 将氯化铁溶液加热灼烧 | 有固体析出 | 该固体是氯化铁 |
| B | 氯化铜溶液中有氯化铁杂质,加入氧化铜除杂 | 有红褐色物质析出 | 调节pH使铁离子水解平衡右移 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 N2O4的 N2O4的 H>0 H>0 |
| D | 向1 mL 0.l mol/L的AgNO3溶液中加入4滴0.1 mol/L的NaCl溶液,再加10滴0.1 mol/L的NaI溶液,再振荡 | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2020-12-21更新
|
587次组卷
|
6卷引用:天津市静海区四校2020-2021学年高二上学期12月阶段性检测化学试题
天津市静海区四校2020-2021学年高二上学期12月阶段性检测化学试题(已下线)解密10 水溶液中离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)模块十 水溶液中的离子平衡(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)山西省山西师范大学实验学校2021-2022学年高二上学期第二次月考化学试题(已下线)章末综合评价(八)
9 . 已知:Ksp(AgBr)=5.53×10-13Ksp(Ag2CrO4)=1×10-12,Ag2CrO4为砖红色沉淀。现用0.100mol·L-1AgNO3滴定某浓度50.00mLNaCl溶液的滴定曲线如图所示。下列有关描述错误的是( )
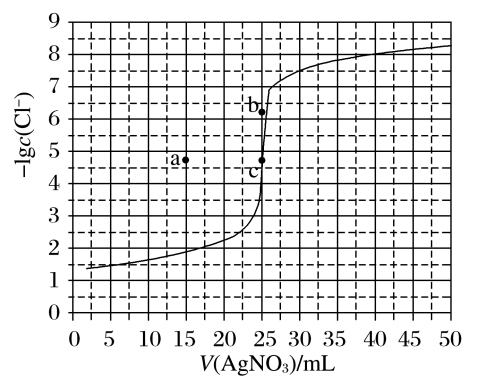

| A.NaCl溶液浓度为0.0500mol/L |
| B.可以选择K2CrO4作为滴定NaCl溶液的指示剂 |
| C.相同实验条件下,滴定同浓度的NaBr,反应终点可能在b点 |
| D.相同实验条件下,若滴定0.0400mol/LNaCl,反应终点c移到a |
您最近半年使用:0次
2020-12-09更新
|
547次组卷
|
2卷引用:吉林省长春市实验中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
10 . 锰是一种非常重要的金属元素,在很多领域有着广泛的应用。利用废铁屑还原浸出低品位软锰矿制备MnSO4,然后通过电解制备金属Mn,其工业流程图如图:
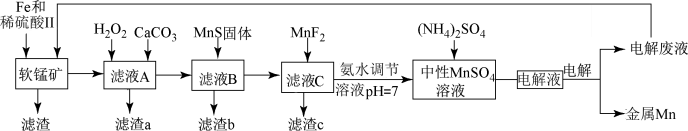
已知:i.低品位软锰矿主要成份有MnO2、Al2O3、Fe2O3、Cu2(OH)2CO3、CaCO3、SiO2等;
ii.常温下部分金属离子以氢氧化物沉淀时的pH;
iii.几种化合物的溶解性或溶度积数据(Ksp)
(1)研究表明,单质Fe和Fe2+都可以还原MnO2。在硫酸存在的条件下,MnO2将Fe氧化为Fe3+的离子方程式是________ 。
(2)滤液A先用H2O2处理,然后加入CaCO3,反应后溶液的pH约为5。滤渣a的主要成分中含有黄铵铁矾[NH4Fe3(SO4)2(OH)6]。
①H2O2的作用是______ (用离子方程式表示)。
②滤渣a中除了黄铵铁矾,主要成分还有X。用平衡移动原理解释产生X的原因_________ 。
(3)MnS固体的作用为_________ (用离子方程式表示)。
(4)滤渣c的成分是________ 。
(5)利用如图装置模拟工业流程图中的“电解”步骤制金属Mn。
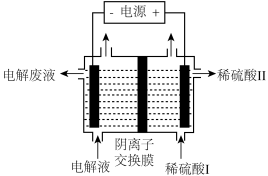
①阳极的电极反应式是_____ 。
②阴极的电极反应为Mn2++2e-=Mn和2H++2e-=H2↑。电极上H2的产生会引起制得的锰起壳开裂,降低产品质量。向滤液C中加入氨水调节溶液pH=7,除了考虑到物质循环利用、降低能耗以外,其他的原因是________ 。
③电解前,向中性MnSO4溶液中加入(NH4)2SO4的作用除了增大溶液导电性之外,还有____ (结合电极反应式和离子方程式解释)。

已知:i.低品位软锰矿主要成份有MnO2、Al2O3、Fe2O3、Cu2(OH)2CO3、CaCO3、SiO2等;
ii.常温下部分金属离子以氢氧化物沉淀时的pH;
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Cu2+ |
| 开始沉淀的pH | 6.8 | 1.8 | 3.7 | 8.6 | 5.2 |
| 沉淀完全的pH | 8.3 | 2.8 | 4.7 | 10.1 | 6.7 |
iii.几种化合物的溶解性或溶度积数据(Ksp)
| MnF2 | CaS | MnS | FeS | CuS |
| 溶于水 | 溶于水 | 2.5×10-13 | 6.3×10-18 | 6.3×10-36 |
(1)研究表明,单质Fe和Fe2+都可以还原MnO2。在硫酸存在的条件下,MnO2将Fe氧化为Fe3+的离子方程式是
(2)滤液A先用H2O2处理,然后加入CaCO3,反应后溶液的pH约为5。滤渣a的主要成分中含有黄铵铁矾[NH4Fe3(SO4)2(OH)6]。
①H2O2的作用是
②滤渣a中除了黄铵铁矾,主要成分还有X。用平衡移动原理解释产生X的原因
(3)MnS固体的作用为
(4)滤渣c的成分是
(5)利用如图装置模拟工业流程图中的“电解”步骤制金属Mn。

①阳极的电极反应式是
②阴极的电极反应为Mn2++2e-=Mn和2H++2e-=H2↑。电极上H2的产生会引起制得的锰起壳开裂,降低产品质量。向滤液C中加入氨水调节溶液pH=7,除了考虑到物质循环利用、降低能耗以外,其他的原因是
③电解前,向中性MnSO4溶液中加入(NH4)2SO4的作用除了增大溶液导电性之外,还有
您最近半年使用:0次



