1 . 以软锰矿、石灰石和含SO2的工业尾气为原料可制备K2SO4、Mn3O4,如图是该生产的工艺流程:

下列判断正确的是

下列判断正确的是
| A.反应Ⅰ是CaCO3转化为CaSO3 |
| B.反应Ⅱ是NH3提供碱性环境,微溶物转化为难溶物 |
| C.反应Ⅲ加入的试剂a是氨水 |
| D.反应Ⅳ利用了SO2的氧化性和酸性 |
您最近一年使用:0次
名校
2 . 下列化学实验中的操作、现象及结论都正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向苯中滴入少量浓溴水,充分振荡,静置 | 下层接近无色 | 说明苯与溴发生了取代反应 |
| B | 向蛋白质溶液中加入适量CuSO4溶液并充分混合 | 溶液中有沉淀析出 | CuSO4溶液使蛋白质发生变性 |
| C | 向AgI沉淀中滴入KCl溶液 | 有白色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| D | 向适量淀粉溶液中加入少量稀硫酸,加热约5 min,冷却后再加入新制Cu(OH)2浊液并加热 | 混合液中无红色沉淀出现 | 说明淀粉没有发生水解反应生成葡萄糖 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 下列实验方案中,不能达到实验目的是
| 选项 | 实验目的 | 实验方案 |
| A | 验证Ksp(BaSO4) <Ksp(BaCO3) | 室温下,将BaSO4投入饱和Na2CO3溶液中充分反应,向过滤后所得固体中加入足量盐酸,固体部分溶解且有无色无味气体产生 |
| B | 验证氧化性:Br2>I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静止,可观察到下层液体呈紫色 |
| C | 验证酸性:HCN<CH3COOH | 室温下,用pH试纸测得0.100 mol·L-1 CH3COOH溶液的pH值约为3,0.100 mol·L-1 HCN溶液的pH值约为5 |
| D | 验证Fe3+能催化H2O2分解,且该分解反应为放热反应 | 向FeCl3溶液中滴入几滴30%的H2O2溶液,有气体产生,一段时间后,FeCl3溶液颜色加深 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
4 . 下列实验操作所对应的现象以及结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用坩埚钳夹住一小块用砂纸打磨过的铝箔,在酒精灯上加热 | 铝箔熔化并滴落 | 金属铝的熔点较低 |
| B | 先向某溶液滴加H2O2,然后再滴加几滴KSCN 溶液 | 溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 在KI 溶液中滴加少量氯水,再加入CCl4,充分振荡 | 液体分层,下层溶液呈紫红色 | 氯的非金属性强于碘 |
| D | 向1mL 0.1mol/L MgCl2 溶液中先滴1~2 滴2 mol/L NaOH溶液,再滴加2 滴0.1mol/L FeCl3溶液,静置 | 先有白色沉淀生成,后白色沉淀变为红褐色 | Ksp[Mg(OH)2]< Ksp[Fe(OH)3] |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 高铁酸钾是一种高效的多功能水处理剂,具有强氧化性。制备高铁酸钾方法很多。
(1)干法制备高铁酸钾。将Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物。此制备反应中,氧化剂与还原剂的物质的量之比为_____________________ 。
(2)湿法制备高铁酸钾。工业上常采用NaClO氧化法生产,原理如下:
a.3NaClO+2Fe(NO3)3+ 10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
b.Na2FeO4+2KOH =K2FeO4+2NaOH
主要的生产流程如图:

①流程图中“转化”是在某低温下进行的,说明此温度下的溶解度S(K2FeO4)_____ S(Na2FeO4)(填“>”“<”或“=”)。
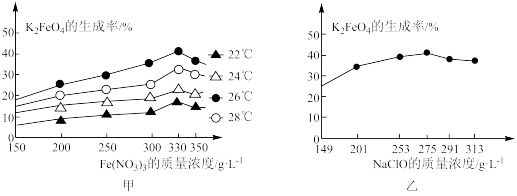
②湿法制备中,反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。如图,图甲为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图乙为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。工业生产中最佳温度为_________ ℃,此时Fe(NO3)3与NaClO 两种溶液最佳质量浓度之比为______________ 。
③若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:_____________________ 。若Fe( NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式为__________________________________ 。
(3)K2FeO4在水溶液中易水解:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑。
4Fe(OH)3+8OH-+3O2↑。
①在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用__________ 溶液(填序号)。
A.H2O B.CH3COOK、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
②K2FeO4在处理水的过程中所起的作用有_______________________ 。
(4)室温下,向含有Fe3+的CuSO4溶液中加入Cu(OH)2可使Fe3+转化为Fe(O H)3沉淀,从而除去Fe3+。该反应的平衡常数为_____________________ 。(已知常温下的溶度积常数:Ksp[Cu(OH)2]=2.0×10-20, Ksp[Fe(OH)3]=4.0×10-38)。
(1)干法制备高铁酸钾。将Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物。此制备反应中,氧化剂与还原剂的物质的量之比为
(2)湿法制备高铁酸钾。工业上常采用NaClO氧化法生产,原理如下:
a.3NaClO+2Fe(NO3)3+ 10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
b.Na2FeO4+2KOH =K2FeO4+2NaOH
主要的生产流程如图:

①流程图中“转化”是在某低温下进行的,说明此温度下的溶解度S(K2FeO4)
②湿法制备中,反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。如图,图甲为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图乙为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。工业生产中最佳温度为

③若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:
(3)K2FeO4在水溶液中易水解:4FeO42-+10H2O
 4Fe(OH)3+8OH-+3O2↑。
4Fe(OH)3+8OH-+3O2↑。①在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
A.H2O B.CH3COOK、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
②K2FeO4在处理水的过程中所起的作用有
(4)室温下,向含有Fe3+的CuSO4溶液中加入Cu(OH)2可使Fe3+转化为Fe(O H)3沉淀,从而除去Fe3+。该反应的平衡常数为
您最近一年使用:0次
6 . 下列叙述正确的是
| A.pH=5 的CH3COOH 溶液和pH=5 的NH4Cl 溶液中,c(H+)不相等 |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH 和Kw均减小 |
| C.0.1mol/LC6H5ONa 溶液中: c(Na+)>c(C6H5O-)>c(H+)>c(OH-) |
| D.在0.1mol/LNa2S 溶液中加入AgCl 固体,溶液中S2-)下降 |
您最近一年使用:0次
名校
7 . 25℃时,5种银盐的溶度积常数(Ksp)分别是:
下列说法正确的是
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A.氯化银、溴化银和碘化银的溶解度依次增大 |
| B.将硫酸银溶解于水后,向其中加入少量硫化钠固体,不能得到黑色沉淀 |
| C.在5mL1.5×10-5 mol•L-1的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3mol•L-1的AgNO3溶液,不能观察到白色沉淀 |
| D.在烧杯中放入6.24 g 硫酸银固体,加200 g 水,经充分溶解后,所得饱和溶液的体积为200 mL,溶液中Ag + 的物质的量浓度为0.2 mol•L-1。 |
您最近一年使用:0次
8 . 工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
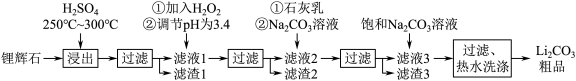
已知:①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量FeO、MgO等。
②Li2O·Al2O3·4SiO2+H2SO4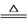 Li2SO4+Al2O3·4SiO2·H2O
Li2SO4+Al2O3·4SiO2·H2O
③某些物质的溶解度(S)如下表所示。
④Fe3+完全沉淀时pH为3.4
(1)为提高原料浸出速率,除升高温度外还可采取的措施是__________ (任写一条)。
(2)在滤液1中加入H2O2的目的是__________ (用离子方程式表示);调节pH最佳试剂是__________ (填序号 )。
(3)从滤渣中分离出Al2O3的流程如下图所示,请写出生成沉淀的离子方程式__________ 。

(4)向滤液2中加入Na2CO3溶液的作用是__________ 。
(5)“过滤、热水洗涤”步骤中,“热水洗涤”的原因是__________ ;证明沉淀已洗净的操作是__________ 。

已知:①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量FeO、MgO等。
②Li2O·Al2O3·4SiO2+H2SO4
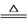 Li2SO4+Al2O3·4SiO2·H2O
Li2SO4+Al2O3·4SiO2·H2O③某些物质的溶解度(S)如下表所示。
| T℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)为提高原料浸出速率,除升高温度外还可采取的措施是
(2)在滤液1中加入H2O2的目的是
| A.CuO | B.CuCO3 | C.MgO | D.NH3·H2O |

(4)向滤液2中加入Na2CO3溶液的作用是
(5)“过滤、热水洗涤”步骤中,“热水洗涤”的原因是
您最近一年使用:0次
名校
9 . 下列有关实验现象或事实解释正确的是( )。
| 选项 | 实验现象或事实 | 解释 |
| A | 检验待测液中S 时,先滴入稀盐酸,再滴入BaCl2溶液 时,先滴入稀盐酸,再滴入BaCl2溶液 | 先滴入盐酸可排除Ag+、C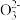 、S 、S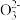 等离子的干扰 等离子的干扰 |
| B | 制备乙酸乙酯时,导管应伸入试管至饱和Na2CO3溶液的液面上方 | 乙酸乙酯易溶于碳酸钠溶液,防止发生倒吸 |
| C | 向Fe(NO3)2溶液中加入稀硫酸,试管口有红棕色气体产生 | 溶液中N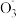 被Fe2+还原为NO2 被Fe2+还原为NO2 |
| D | 含Mg(HCO3)2的硬水长时间充分加热,最终得到的沉淀物的主要成分为Mg(OH)2,而不是MgCO3 | Ksp(MgCO3)<Ksp[Mg(OH)2] |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
10 . 下列实验操作规范且能达到目的的是
| 实验目的 | 实验操作 | |
| A | 配制Fe(NO3)2 溶液 | 将一定质量的Fe(NO3)2 固体先溶解于一定浓度的硝酸中,再用蒸馏水稀释 |
| B | 证明Ksp(AgI)<Ksp(AgCl) | 向10滴0.1mol·L-1硝酸银溶液中加入1mL0.1mol·L-1氯化钠溶液,再滴加1mL0.1mol·L-1KI溶液。先出现白色沉淀,后变为黄色沉淀 |
| C | 测定醋酸钠溶液的pH | 用玻璃棒蘸取待测溶液,点在湿润的pH试纸上 |
| D | 证明纯碱溶液呈碱性是由CO32-水解引起的 | 向Na2CO3溶液中加入酚酞试液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



