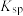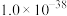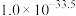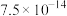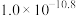名校
解题方法
1 . 工业上以方铅矿( ,含少量
,含少量 和软锰矿
和软锰矿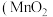 ,含少量
,含少量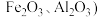 为原料,制备
为原料,制备 和
和 的工艺流程如图所示。
的工艺流程如图所示。 难溶于冷水,易溶于热水;
难溶于冷水,易溶于热水;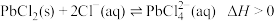
②常温下,某些难溶物质的 如下表:
如下表:
回答下列问题:
(1)方铅矿和软锰矿预先粉碎的目的是_____________ ;“热浸取”时, 参与反应的离子方程式为
参与反应的离子方程式为__________________________ 。
(2)“操作X”是_____________ ;若溶液中 的浓度为
的浓度为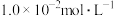 ,则“调
,则“调 ”的范围是
”的范围是_____________ (当离子浓度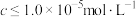 时,可认为该离子沉淀完全;忽略溶液体积变化)。
时,可认为该离子沉淀完全;忽略溶液体积变化)。
(3)“转化”过程中反应能够发生的原因是_______________________ ;“滤液”可循环使用,应当将其导入到____________ 操作中(填操作单元的名称)。
(4)“沉锰”过程中发生反应的离子方程式为____________________________________ 。
 ,含少量
,含少量 和软锰矿
和软锰矿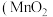 ,含少量
,含少量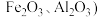 为原料,制备
为原料,制备 和
和 的工艺流程如图所示。
的工艺流程如图所示。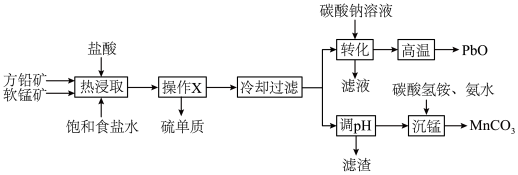
 难溶于冷水,易溶于热水;
难溶于冷水,易溶于热水;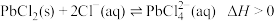
②常温下,某些难溶物质的
 如下表:
如下表:物质 |
|
|
|
|
|
|
|
|
|
|
|
(1)方铅矿和软锰矿预先粉碎的目的是
 参与反应的离子方程式为
参与反应的离子方程式为(2)“操作X”是
 的浓度为
的浓度为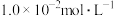 ,则“调
,则“调 ”的范围是
”的范围是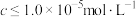 时,可认为该离子沉淀完全;忽略溶液体积变化)。
时,可认为该离子沉淀完全;忽略溶液体积变化)。(3)“转化”过程中反应能够发生的原因是
(4)“沉锰”过程中发生反应的离子方程式为
您最近一年使用:0次
名校
2 . 硫酸四氨合铜晶体[Cu(NH3)4]SO4·H2O可用作杀虫剂、印染助剂等,常温下在空气中与水、二氧化碳反应生成铜的碱式盐,晶体变成绿色,在热水中易分解。某研究性学习小组通过如下实验制备该晶体并测定晶体中铜元素的质量分数。
(1)实验室需配制250mL1.00mol/L的CuSO4溶液,用到的玻璃仪器除了下图展示的部分仪器外还需要_______ (填仪器名称)。________ 。
(3)步骤Ⅱ中不用蒸发浓缩、冷却结晶的方式制备粗产品的原因为________ 。
(4)硫酸四氨合铜晶体中铜元素质量分数的测定
ⅰ.准确称取wg固体配成100mL溶液,取25mL溶液于锥形瓶中,加5mL1mol/L稀硫酸和100mL水使其溶解。
ⅱ.加入足量10%的KI溶液,加入淀粉溶液做指示剂,用cmol/LNa2S2O3标准溶液滴定至溶液呈浅蓝色。
ⅲ.再加入足量10%KSCN溶液,摇匀后,溶液蓝色加深,再继续用Na2S2O3标准溶液滴定至蓝色刚好消失,重复操作3次,平均消耗Na2S2O3溶液的体积为VmL。
已知:Cu2++I-=CuI+I2(未配平),I2+2 =
= +2I-;CuI沉淀表面易吸附I2;Ksp[CuSCN]=1.77×10-13,Ksp[CuI]=1.27×10-12。
+2I-;CuI沉淀表面易吸附I2;Ksp[CuSCN]=1.77×10-13,Ksp[CuI]=1.27×10-12。
①滴定时加入KSCN的目的是________ (用离子方程式表示)。
②Cu2+与I-反应时,一般在pH=3-4的弱酸性环境中进行、试解释pH值不能过高的原因______ 。
③硫酸四氨合铜晶体中铜元素的质量分数为_______ %(用含c、w、V的式子表示)。
(5)下列情况能造成晶体中铜元素质量分数测定结果偏低的是______(填字母编号)。

(1)实验室需配制250mL1.00mol/L的CuSO4溶液,用到的玻璃仪器除了下图展示的部分仪器外还需要
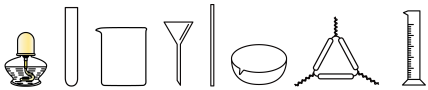
(3)步骤Ⅱ中不用蒸发浓缩、冷却结晶的方式制备粗产品的原因为
(4)硫酸四氨合铜晶体中铜元素质量分数的测定
ⅰ.准确称取wg固体配成100mL溶液,取25mL溶液于锥形瓶中,加5mL1mol/L稀硫酸和100mL水使其溶解。
ⅱ.加入足量10%的KI溶液,加入淀粉溶液做指示剂,用cmol/LNa2S2O3标准溶液滴定至溶液呈浅蓝色。
ⅲ.再加入足量10%KSCN溶液,摇匀后,溶液蓝色加深,再继续用Na2S2O3标准溶液滴定至蓝色刚好消失,重复操作3次,平均消耗Na2S2O3溶液的体积为VmL。
已知:Cu2++I-=CuI+I2(未配平),I2+2
 =
= +2I-;CuI沉淀表面易吸附I2;Ksp[CuSCN]=1.77×10-13,Ksp[CuI]=1.27×10-12。
+2I-;CuI沉淀表面易吸附I2;Ksp[CuSCN]=1.77×10-13,Ksp[CuI]=1.27×10-12。①滴定时加入KSCN的目的是
②Cu2+与I-反应时,一般在pH=3-4的弱酸性环境中进行、试解释pH值不能过高的原因
③硫酸四氨合铜晶体中铜元素的质量分数为
(5)下列情况能造成晶体中铜元素质量分数测定结果偏低的是______(填字母编号)。
| A.用Na2S2O3标准溶液滴定前,滴定管下端尖嘴有气泡,达到终点时气泡消失 |
| B.配制溶液时,加入的稀硫酸过量,使少量I-被O2氧化成I2 |
| C.用Na2S2O3标准溶液滴定时,滴定前仰视读数,滴定后俯视读数 |
| D.没有加入10%KSCN溶液,直接用Na2S2O3标准溶液滴定至蓝色刚好消失 |
您最近一年使用:0次
名校
3 . 金属矿物常以硫化物形式存在,如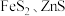 等。
等。
Ⅰ.掺烧 和
和 ,用于制铁精粉和硫酸
,用于制铁精粉和硫酸
(1)已知: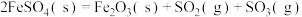 为吸热反应。
为吸热反应。 时,
时, 固体在
固体在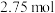 氧气中完全燃烧生成气态
氧气中完全燃烧生成气态 和
和 固体,放出
固体,放出 热量。
热量。
① 与
与 反应的热化学方程式为
反应的热化学方程式为_________ 。
②将 与
与 掺烧(混合燃烧),其目的包括
掺烧(混合燃烧),其目的包括_________ (填字母)。
 节约燃料和能量
节约燃料和能量  为制备硫酸提供原料
为制备硫酸提供原料  减少空气污染
减少空气污染
(2) 常带一定量的结晶水。
常带一定量的结晶水。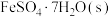 分解脱水反应的能量变化如图所示。
分解脱水反应的能量变化如图所示。
_________  。
。
②为维持炉内温度基本不变, 所带结晶水越多,掺烧比
所带结晶水越多,掺烧比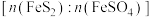 应
应_________ 。(填“增大”“减小”或“不变”)。
Ⅱ.浸出法处理
(3) 难溶于水,处理
难溶于水,处理 常使用酸浸法,两步反应依次为:
常使用酸浸法,两步反应依次为:
ⅰ.
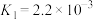
ⅱ.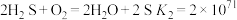
①平衡常数 的表达式为
的表达式为_________ 。
②仅发生反应ⅰ时, 酸浸效果不好,结合平衡常数说明原因:
酸浸效果不好,结合平衡常数说明原因:_________ 。
(4)从平衡移动角度解释通入 在
在 酸浸过程中的作用:
酸浸过程中的作用:_________ 。
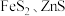 等。
等。Ⅰ.掺烧
 和
和 ,用于制铁精粉和硫酸
,用于制铁精粉和硫酸(1)已知:
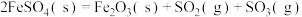 为吸热反应。
为吸热反应。 时,
时, 固体在
固体在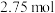 氧气中完全燃烧生成气态
氧气中完全燃烧生成气态 和
和 固体,放出
固体,放出 热量。
热量。①
 与
与 反应的热化学方程式为
反应的热化学方程式为②将
 与
与 掺烧(混合燃烧),其目的包括
掺烧(混合燃烧),其目的包括 节约燃料和能量
节约燃料和能量  为制备硫酸提供原料
为制备硫酸提供原料  减少空气污染
减少空气污染(2)
 常带一定量的结晶水。
常带一定量的结晶水。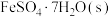 分解脱水反应的能量变化如图所示。
分解脱水反应的能量变化如图所示。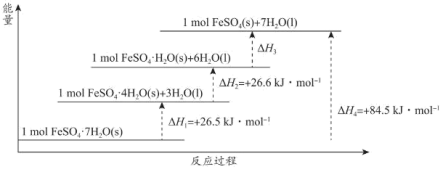

 。
。②为维持炉内温度基本不变,
 所带结晶水越多,掺烧比
所带结晶水越多,掺烧比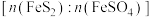 应
应Ⅱ.浸出法处理

(3)
 难溶于水,处理
难溶于水,处理 常使用酸浸法,两步反应依次为:
常使用酸浸法,两步反应依次为:ⅰ.

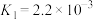
ⅱ.
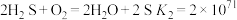
①平衡常数
 的表达式为
的表达式为②仅发生反应ⅰ时,
 酸浸效果不好,结合平衡常数说明原因:
酸浸效果不好,结合平衡常数说明原因:(4)从平衡移动角度解释通入
 在
在 酸浸过程中的作用:
酸浸过程中的作用:
您最近一年使用:0次
名校
解题方法
4 . 工业利用闪锌矿(主要成分ZnS,还含有FeS、CuFeS2、石英及F-、Cl-等杂质)富氧酸浸提取锌,同时实现环保除铁的工艺流程如图1:
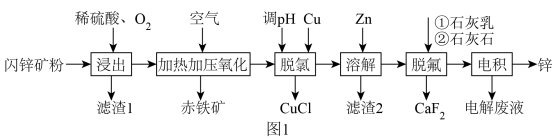
已知:酸性条件下,亚铜离子易发生歧化反应。
回答下列问题:
(1)将闪锌矿粉碎成粉的目的是________________ ,Zn的价层电子排布图为__________________ 。
(2)浸出步骤中,ZnS涉及到的离子反应方程式为________________ 。
(3)结合反应原理,解释加热加压氧化流程中加压的目的________________ 。
(4)“脱氯”环节中的离子方程式为________________ 。
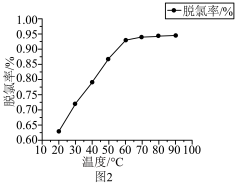
(5)“电积”时,F-、Cl-会腐蚀电极板,需提前除净。“脱氯”时,脱氯率随温度的变化如图2,60℃之前,脱氯率不断提高的原因可能为________________ 。
(6)脱氟过程中,加入石灰乳和石灰石,使F-转化为CaF2沉淀,实际操作过程中,CaF2沉淀往往还夹杂着CaCO3沉淀,则此时剩余溶液中
_______________ 。(已知常温下 ,
,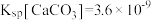 )
)

已知:酸性条件下,亚铜离子易发生歧化反应。
回答下列问题:
(1)将闪锌矿粉碎成粉的目的是
(2)浸出步骤中,ZnS涉及到的离子反应方程式为
(3)结合反应原理,解释加热加压氧化流程中加压的目的
(4)“脱氯”环节中的离子方程式为
(5)“电积”时,F-、Cl-会腐蚀电极板,需提前除净。“脱氯”时,脱氯率随温度的变化如图2,60℃之前,脱氯率不断提高的原因可能为

(6)脱氟过程中,加入石灰乳和石灰石,使F-转化为CaF2沉淀,实际操作过程中,CaF2沉淀往往还夹杂着CaCO3沉淀,则此时剩余溶液中

 ,
,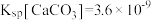 )
)
您最近一年使用:0次
5 . 2030年全球新能源动力电池镍消费量将达到2020年全球镍产量的近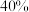 。工业上由某含镍废渣精矿(主要成分为
。工业上由某含镍废渣精矿(主要成分为 ,还有
,还有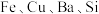 的氧化物)为原料制备碱式碳酸镍
的氧化物)为原料制备碱式碳酸镍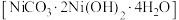 的流程如图1所示。
的流程如图1所示。

已知: 时,
时,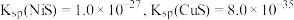
回答下列问题:
(1)滤渣I的主要成分为___________ (填化学式)。“除杂1”时,加入的 的作用是
的作用是___________ (用离子方程式表示)。
(2)“除杂2”时发生反应的离子方程式为 ,从平衡常数角度分析选择
,从平衡常数角度分析选择 的原因
的原因___________ ;实验测得此工序中加入 的物质的量与“除杂1”所得溶液
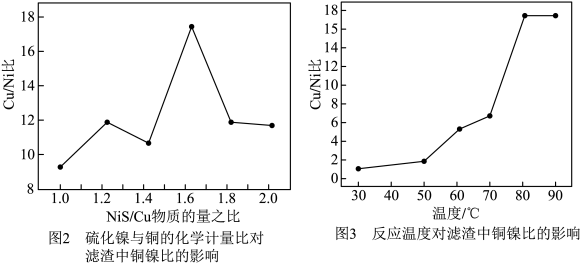
的物质的量与“除杂1”所得溶液 的物质的量之比、反应温度对“除杂2”所得滤渣中铜镍比的关系分别如图2和图3所示。则最佳的加入
的物质的量之比、反应温度对“除杂2”所得滤渣中铜镍比的关系分别如图2和图3所示。则最佳的加入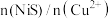 之比和反应温度分别为
之比和反应温度分别为___________ 。
(3)“萃取”过程表示为下式: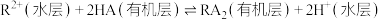 。则“反萃取”所加试剂X为
。则“反萃取”所加试剂X为___________ (填化学式)。
(4)“沉镍”时无气体产生,则该过程反应的离子方程式为___________ 。
(5)将一定量的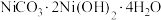 在空气中煅烧得到镍的某种氧化物Q为
在空气中煅烧得到镍的某种氧化物Q为 ,同时生成标况下
,同时生成标况下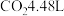 ,则Q的化学式为
,则Q的化学式为___________ 。
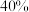 。工业上由某含镍废渣精矿(主要成分为
。工业上由某含镍废渣精矿(主要成分为 ,还有
,还有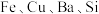 的氧化物)为原料制备碱式碳酸镍
的氧化物)为原料制备碱式碳酸镍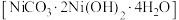 的流程如图1所示。
的流程如图1所示。
已知:
 时,
时,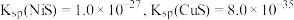
回答下列问题:
(1)滤渣I的主要成分为
 的作用是
的作用是(2)“除杂2”时发生反应的离子方程式为
 ,从平衡常数角度分析选择
,从平衡常数角度分析选择 的原因
的原因 的物质的量与“除杂1”所得溶液
的物质的量与“除杂1”所得溶液 的物质的量之比、反应温度对“除杂2”所得滤渣中铜镍比的关系分别如图2和图3所示。则最佳的加入
的物质的量之比、反应温度对“除杂2”所得滤渣中铜镍比的关系分别如图2和图3所示。则最佳的加入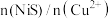 之比和反应温度分别为
之比和反应温度分别为
(3)“萃取”过程表示为下式:
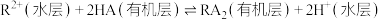 。则“反萃取”所加试剂X为
。则“反萃取”所加试剂X为(4)“沉镍”时无气体产生,则该过程反应的离子方程式为
(5)将一定量的
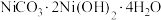 在空气中煅烧得到镍的某种氧化物Q为
在空气中煅烧得到镍的某种氧化物Q为 ,同时生成标况下
,同时生成标况下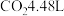 ,则Q的化学式为
,则Q的化学式为
您最近一年使用:0次
名校
解题方法
6 . 含镉( )废水是危害严重的重金属离子废水,处理含镉废水常采用化学沉淀法。常温下,
)废水是危害严重的重金属离子废水,处理含镉废水常采用化学沉淀法。常温下, 、
、 、
、 、
、 。
。
(1)沉淀 效果最佳的试剂是
效果最佳的试剂是___________ (填编号)。
a. b.
b. c.
c.
(2)若采用生石灰处理含镉废水最佳 为11此时溶液中
为11此时溶液中
___________ 。
(3)若加入 替代
替代 实现沉淀转化。
实现沉淀转化。
①写出碳酸钙处理 的离子方程式:
的离子方程式:___________ 。
②工业常选用 的主要原因是
的主要原因是___________ 。
③若反应前溶液中的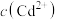 为
为 ,反应后溶液中
,反应后溶液中 为
为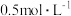 ,则原溶液中
,则原溶液中 的去除率为
的去除率为___________ 。
 )废水是危害严重的重金属离子废水,处理含镉废水常采用化学沉淀法。常温下,
)废水是危害严重的重金属离子废水,处理含镉废水常采用化学沉淀法。常温下, 、
、 、
、 、
、 。
。(1)沉淀
 效果最佳的试剂是
效果最佳的试剂是a.
 b.
b. c.
c.
(2)若采用生石灰处理含镉废水最佳
 为11此时溶液中
为11此时溶液中
(3)若加入
 替代
替代 实现沉淀转化。
实现沉淀转化。①写出碳酸钙处理
 的离子方程式:
的离子方程式:②工业常选用
 的主要原因是
的主要原因是③若反应前溶液中的
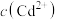 为
为 ,反应后溶液中
,反应后溶液中 为
为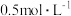 ,则原溶液中
,则原溶液中 的去除率为
的去除率为
您最近一年使用:0次
名校
解题方法
7 . 软锰矿的主要成分为 ,还含有
,还含有 等杂质,工业上用软锰矿制取
等杂质,工业上用软锰矿制取 的流程如图:
的流程如图:

已知:部分金属阳离子完全沉淀时的 如下表:
如下表:
(1)“浸出”过程中 转化为
转化为 的离子方程式为
的离子方程式为___________ 。
(2)第1步除杂中形成滤渣1的主要成分为___________ (填化学式),调 至
至 所加的试剂,可选择
所加的试剂,可选择___________ (填字母)。
a. b.
b. c.
c. d.氨水
d.氨水
(3)第2步除杂,主要是将 转化为相应氟化物沉淀除去,写出
转化为相应氟化物沉淀除去,写出 除去
除去 的离子方程式:
的离子方程式:___________ ,该反应的平衡常数为___________ (结果保留一位小数)(已知: 的
的 ;
; 的
的 )。
)。
(4)取少量 溶于水,配成溶液,测其
溶于水,配成溶液,测其 发现该溶液显酸性,原因是
发现该溶液显酸性,原因是___________ (用离子方程式表示)。
 ,还含有
,还含有 等杂质,工业上用软锰矿制取
等杂质,工业上用软锰矿制取 的流程如图:
的流程如图:
已知:部分金属阳离子完全沉淀时的
 如下表:
如下表:| 金属阳离子 |  |  |  |  |
完全沉淀时的 | 3.2 | 5.0 | 10.4 | 12.4 |
(1)“浸出”过程中
 转化为
转化为 的离子方程式为
的离子方程式为(2)第1步除杂中形成滤渣1的主要成分为
 至
至 所加的试剂,可选择
所加的试剂,可选择a.
 b.
b. c.
c. d.氨水
d.氨水(3)第2步除杂,主要是将
 转化为相应氟化物沉淀除去,写出
转化为相应氟化物沉淀除去,写出 除去
除去 的离子方程式:
的离子方程式: 的
的 ;
; 的
的 )。
)。(4)取少量
 溶于水,配成溶液,测其
溶于水,配成溶液,测其 发现该溶液显酸性,原因是
发现该溶液显酸性,原因是
您最近一年使用:0次
8 . 利用含锶(Sr)废渣制备 晶体的流程如下:
晶体的流程如下:

已知:i.含锶废渣中Sr主要以 和
和 的形式存在;
的形式存在;
ii.25℃,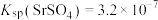 ,
,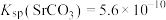 。
。
请回答下列问题:
(1)转化
①转化前,含锶废渣需要粉碎研磨的目的是___________ 。
②转化过程中,向 溶液中加入氨水,提高溶液pH,目的是提高
溶液中加入氨水,提高溶液pH,目的是提高___________ (填粒子符号)的浓度,将 转化为
转化为 。
。
(2)溶出
溶出过程发生反应的离子方程式是___________ 。
(3)纯化
溶出液中除含有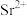 外,还含有
外,还含有 和少量的
和少量的 、
、 等杂质,其中
等杂质,其中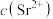 与
与 近似相等。纯化过程涉及操作如下:
近似相等。纯化过程涉及操作如下:

已知:iii.25℃, 和
和 沉淀时的pH(当金属离子浓度为
沉淀时的pH(当金属离子浓度为 时,可认为沉淀完全):
时,可认为沉淀完全):
iv. 和
和 在不同温度下的溶解度:
在不同温度下的溶解度:
①为除去溶液中的 和
和 ,应调节pH的范围为
,应调节pH的范围为___________ 。25℃时,
___________ 。
②滤液1中加入适量NaOH调节pH至14和升温至90℃有利于 析出的原因是
析出的原因是___________ 。
③90℃时,
___________ (填“>”或“<”) 。
。
④操作X是加热浓缩、___________ 、___________ 、洗涤、干燥。
 晶体的流程如下:
晶体的流程如下:
已知:i.含锶废渣中Sr主要以
 和
和 的形式存在;
的形式存在;ii.25℃,
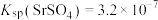 ,
,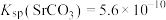 。
。请回答下列问题:
(1)转化
①转化前,含锶废渣需要粉碎研磨的目的是
②转化过程中,向
 溶液中加入氨水,提高溶液pH,目的是提高
溶液中加入氨水,提高溶液pH,目的是提高 转化为
转化为 。
。(2)溶出
溶出过程发生反应的离子方程式是
(3)纯化
溶出液中除含有
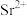 外,还含有
外,还含有 和少量的
和少量的 、
、 等杂质,其中
等杂质,其中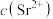 与
与 近似相等。纯化过程涉及操作如下:
近似相等。纯化过程涉及操作如下:
已知:iii.25℃,
 和
和 沉淀时的pH(当金属离子浓度为
沉淀时的pH(当金属离子浓度为 时,可认为沉淀完全):
时,可认为沉淀完全):| 氢氧化物 | 开始沉淀 | 沉淀完全 | 沉淀开始溶解 |
 | 2.3 | 4.1 | —— |
 | 4.0 | 5.2 | 7.8 |
 和
和 在不同温度下的溶解度:
在不同温度下的溶解度:| 温度/℃ 溶解度/g 氢氧化物 | 20 | 40 | 60 | 80 | 90 |
 | 1.77 | 3.95 | 8.42 | 20.2 | 44.5 |
 | 0.173 | 0.141 | 0.121 | 0.094 | 0.086 |
 和
和 ,应调节pH的范围为
,应调节pH的范围为
②滤液1中加入适量NaOH调节pH至14和升温至90℃有利于
 析出的原因是
析出的原因是③90℃时,

 。
。④操作X是加热浓缩、
您最近一年使用:0次
名校
解题方法
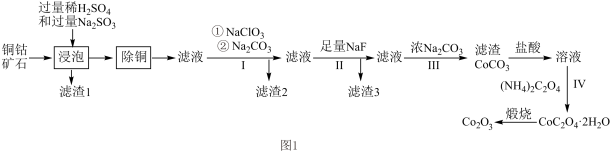
9 . 三氧化二钴( )在工业、电子等领域都有着广阔的应用前景。以铜钴矿石[主要成分为
)在工业、电子等领域都有着广阔的应用前景。以铜钴矿石[主要成分为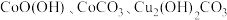 和
和 ,还有少量铁、镁、钙的氧化物]为原料制备三氧化二钴(
,还有少量铁、镁、钙的氧化物]为原料制备三氧化二钴( )的工艺流程如图1所示。
)的工艺流程如图1所示。
已知:常温下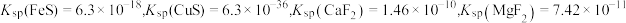 。
。
回答下列问题:
(1)CoO(OH)中Co的化合价为___________ ;“浸泡”过程中CoO(OH)与 反应的离子方程式为
反应的离子方程式为___________ 。
(2)“浸泡”过程中浸出温度和浸出pH对浸出率的影响分别如图2、图3所示。
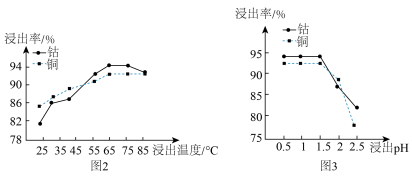
①矿石粉末“浸泡”的适宜条件应是___________ 。
②图3中铜、钴浸出率下降的可能原因是___________ 。
(3)“除铜”过程中,加入FeS固体得到更难溶的CuS,写出“除铜”反应的离子方程式_______ 。
(4)向“除铜”后的滤液中加入 的主要目的是
的主要目的是___________ 。过程Ⅲ中加入浓 得到滤渣后又加入盐酸溶解,其目的是
得到滤渣后又加入盐酸溶解,其目的是___________ 。
(5)在过程Ⅱ中加入足量的NaF可将 以沉淀形式除去,若所得滤液中
以沉淀形式除去,若所得滤液中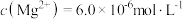 ,则滤液中
,则滤液中 为
为___________ (保留2位有效数字)。
 )在工业、电子等领域都有着广阔的应用前景。以铜钴矿石[主要成分为
)在工业、电子等领域都有着广阔的应用前景。以铜钴矿石[主要成分为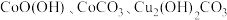 和
和 ,还有少量铁、镁、钙的氧化物]为原料制备三氧化二钴(
,还有少量铁、镁、钙的氧化物]为原料制备三氧化二钴( )的工艺流程如图1所示。
)的工艺流程如图1所示。
已知:常温下
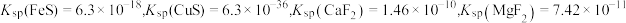 。
。回答下列问题:
(1)CoO(OH)中Co的化合价为
 反应的离子方程式为
反应的离子方程式为(2)“浸泡”过程中浸出温度和浸出pH对浸出率的影响分别如图2、图3所示。

①矿石粉末“浸泡”的适宜条件应是
②图3中铜、钴浸出率下降的可能原因是
(3)“除铜”过程中,加入FeS固体得到更难溶的CuS,写出“除铜”反应的离子方程式
(4)向“除铜”后的滤液中加入
 的主要目的是
的主要目的是 得到滤渣后又加入盐酸溶解,其目的是
得到滤渣后又加入盐酸溶解,其目的是(5)在过程Ⅱ中加入足量的NaF可将
 以沉淀形式除去,若所得滤液中
以沉淀形式除去,若所得滤液中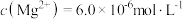 ,则滤液中
,则滤液中 为
为
您最近一年使用:0次
名校
解题方法
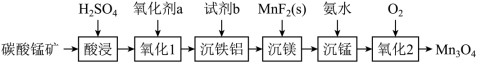
10 . 四氧化三锰是电子工业生产锰锌铁氧体软磁材料的重要原料。以碳酸锰矿(主要成分为MnCO3,还含有少量FeCO3、Al2O3、MgO和SiO2等杂质)为原料制备高品位四氧化三锰的一种工艺流程如下:
已知:①金属离子生成氢氧化物沉淀的pH见表中数据(“完全沉淀”时溶液中金属离子浓度≤1.0×10-5mol∙L-1):
②Ksp(MgF2)=8.0×10-1l;Ksp(MnF2)=5.6×10-3
回答下列问题:
(1)提高“酸浸”效果的方法有___________ 、___________ (任写两种)。
(2)“氧化1”步骤中,氧化剂a可选用MnO2,发生反应的离子方程式为___________ ,为了检验氧化是否完全可选用的试剂是___________ (写化学式)。
(3)“沉铁铝”步骤中,若浸取液中c(Mn2+)=0.1mol∙L﹣1,则须调节溶液的pH范围是___________ 。(加入氧化剂a和试剂b时,溶液体积的变化忽略不计)
(4)“沉镁”步骤中,沉淀转化反应的平衡常数K值等于___________ 。
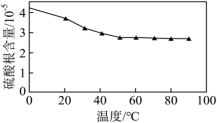
(5)“沉锰”步骤中,杂质含量直接影响四氧化三锰的品位,实验测得温度对四氧化三锰中硫酸根含量的影响如图所示,实际生产中综合考虑选择50°C为宜,不选择更高温度的原因是___________ 。
(6)“氧化2”步骤中发生反应的化学方程式为___________ 。

已知:①金属离子生成氢氧化物沉淀的pH见表中数据(“完全沉淀”时溶液中金属离子浓度≤1.0×10-5mol∙L-1):
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Mg2+ | Mn2+ |
| 恰好完全沉淀时的PH | 5.4 | 3.2 | 9.5 | 11.1 | 9.4 |
回答下列问题:
(1)提高“酸浸”效果的方法有
(2)“氧化1”步骤中,氧化剂a可选用MnO2,发生反应的离子方程式为
(3)“沉铁铝”步骤中,若浸取液中c(Mn2+)=0.1mol∙L﹣1,则须调节溶液的pH范围是
(4)“沉镁”步骤中,沉淀转化反应的平衡常数K值等于
(5)“沉锰”步骤中,杂质含量直接影响四氧化三锰的品位,实验测得温度对四氧化三锰中硫酸根含量的影响如图所示,实际生产中综合考虑选择50°C为宜,不选择更高温度的原因是

(6)“氧化2”步骤中发生反应的化学方程式为
您最近一年使用:0次
2024-02-02更新
|
173次组卷
|
2卷引用:四川省绵阳南山中学实验学校2023-2024学年高三上学期1月月考理科综合试题