1 . 已知25℃时,Ksp[Mg(OH)2]=1.8×10-11、Ksp[Cu(OH)2]=2.2×10-20。在c(Mg2+)=c(Cu2+)的酸性溶液中,逐滴加入NaOH稀溶液使pH慢慢增大,下列判断正确的是
| A.Mg2+先沉淀 | B.Cu2+先沉淀 |
| C.同时沉淀 | D.Mg2+和Cu2+均不可能沉淀 |
您最近一年使用:0次
2021-06-27更新
|
3572次组卷
|
19卷引用:山西大学附属中学校2022-2023学年高二上学期11月期中考试化学试题
山西大学附属中学校2022-2023学年高二上学期11月期中考试化学试题贵州省2020年12月学业水平考试化学试题湖北省十堰市城区普高协作体2021-2022学年高二上学期期中考试化学试题湖南省衡阳市田家炳实验中学2021-2022学年高二上学期期中考试化学试题吉林省长春市第五中学2022-2023学年高二上学期期中考试化学试题江苏省泰州市兴化市2022-2023学年高二下学期4月期中考试化学试题课前-3.4.2 沉淀溶解平衡的应用-课前、课中、课后(人教版2019选择性必修1)(已下线)第3章 水溶液中的离子反应与平衡(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)3.4.1 难溶电解质的沉淀溶解平衡(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)黑龙江省牡丹江市第三高级中学2021-2022学年高二上学期期末考试化学试题贵州省普通高中2022年7月学业水平考试化学试题(已下线)第33练 沉淀溶解平衡-2023年高考化学一轮复习小题多维练(全国通用)山东省济宁市微山县第二中学2021-2022学年高二12月月考化学试题广东省广州市海珠外国语实验中学2022-2023学年高二上学期12月月考化学试题3.4.2沉淀溶解平衡原理的应用 课后第三章 第四节 沉淀溶解平衡 第1课时 沉淀溶解平衡与溶度积河南省驻马店市“逐梦计划”大联考2023-2024学年高二上学期12月期末考试化学试题江西省宜春市丰城市第九中学2023-2024学年高一下学期第一次月考化学试题(日新班)宁夏开元学校2023-2024学年高二上学期期末考试化学试题
名校
解题方法
2 . 已知25℃时,AgCl的溶度积Ksp=1.8×10-10 mol2·L-2,则下列说法正确的是
| A.向饱和AgCl水溶液中加入盐酸, Ksp变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl沉淀析出 |
| D.在AgCl的悬浊液中加入Na2S溶液,AgCl转化为Ag2S,因为AgCl溶度积大于Ag2S |
您最近一年使用:0次
3 . 钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s)⇌Sr2+(aq)+SO (aq) Ksp=2.5×10-7
(aq) Ksp=2.5×10-7
SrCO3(s)⇌Sr2+(aq)+CO (aq) Ksp=2.5×10-9
(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为________ ;该反应的平衡常数表达式为_____ ;该反应能发生的原因是________ (用沉淀溶解平衡的有关理论解释)。
(2)对于上述反应,实验证明增大CO 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
①升高温度,平衡常数K将________ 。
②增大CO 的浓度,平衡常数K将
的浓度,平衡常数K将___________ 。
已知:SrSO4(s)⇌Sr2+(aq)+SO
 (aq) Ksp=2.5×10-7
(aq) Ksp=2.5×10-7SrCO3(s)⇌Sr2+(aq)+CO
 (aq) Ksp=2.5×10-9
(aq) Ksp=2.5×10-9(1)将SrSO4转化成SrCO3的离子方程式为
(2)对于上述反应,实验证明增大CO
 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。①升高温度,平衡常数K将
②增大CO
 的浓度,平衡常数K将
的浓度,平衡常数K将
您最近一年使用:0次
4 . 如图是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的沉淀溶解平衡曲线。下列有关说法正确的是( )
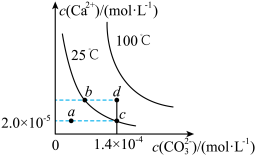

A.CaCO3(s) Ca2+(aq)+CO32—(aq) ΔH<0 Ca2+(aq)+CO32—(aq) ΔH<0 |
| B.a、b、c、d四点对应的溶度积Ksp相等 |
| C.25 ℃时CaCO3的Ksp=2.8×10-9 |
| D.温度不变,挥发水分,可使溶液由a点变到c点 |
您最近一年使用:0次
2019-12-07更新
|
219次组卷
|
11卷引用:山西省康杰中学2017-2018学年高二上学期期中考试化学试题
山西省康杰中学2017-2018学年高二上学期期中考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期期中考试化学试题黑龙江省鹤岗市第一中学2019-2020学年高二上学期期中考试化学试题重庆市凤鸣山中学2018-2019学年高二上学期期中考试化学试题(已下线)2017-2018学年上学期期末复习备考之精准复习模拟题高二化学选修4(B卷)(已下线)解密13 沉淀溶解平衡——备战2018年高考化学之高频考点解密(已下线)2019年4月12日 《每日一题》三轮复习——难溶电解质溶解平衡苏教版选修四化学反应原理专题3第四单元 难溶电解质的沉淀溶解平衡 同步检测试卷江西省萍乡市莲花中学2019-2020高一下学期3月特色班月考化学试题山西省吕梁市2020-2021学年高二上学期期末考试化学试题新疆伊犁新源县2021-2022学年高二上学期期末考试化学试题
5 . 下列叙述中正确的是
| A.100℃时,Kw= 10-12,则该温度下,NaCl溶液呈酸性 |
| B.25℃时,pH=12的溶液一定是碱溶液,pH=2的溶液一定是酸溶液 |
| C.等温下,AgCl在浓度均为0.1 mol•L-1的NaCl溶液、MgCl2溶液中Ksp相等 |
| D.等温下,饱和溶液的导电能力,BaCO3强于BaSO4,则Ksp(BaCO3)<Ksp(BaSO4) |
您最近一年使用:0次
2019-05-06更新
|
108次组卷
|
2卷引用:【全国百强校】山西省忻州市第一中学2018-2019学年高二下学期期中考试化学试题
名校
6 . 下列实验过程可以达到实验目的的是
| 选项 | 实验目的 | 实验过程 |
| A | 移取15.00 mLKI溶液 | 向20 mL量筒加入KI溶液至刻度线15处,然后倒出 |
| B | 制取并纯化SO2 | 将浓硫酸滴入Na2SO3中,生成的气体依次通过饱和NaHCO3溶液、浓硫酸 |
| C | 比较BaSO4和BaSO3的Ksp | 向盛有BaCl2溶液的试管中先加入Na2SO3溶液,然后加入Na2SO4,观察现象 |
| D | 探究H2O2的还原性 | 向盛有2mL酸性KMnO4溶液的试管中滴加浓的H2O2溶液,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-05-06更新
|
212次组卷
|
3卷引用:【全国百强校】山西省忻州市第一中学2018-2019学年高二下学期期中考试化学试题
名校
7 . 下列关于难溶电解质溶解平衡的说法正确的是
| A.可直接根据Ksp的数值大小比较难溶电解质在水中的溶解度大小 |
| B.在AgCl的饱和溶液中,加入蒸馏水,Ksp(AgCl)不变 |
| C.难溶电解质的溶解平衡过程是可逆的,且在平衡状态时,v溶解=v沉淀=0 |
| D.25℃时,Ksp(AgCl)>Ksp(AgI),向 AgCl 的饱和溶液中加入少量KI固体,一定有黄色沉淀 |
您最近一年使用:0次
2019-03-20更新
|
574次组卷
|
6卷引用:山西省吕梁市岚县中学2019—2020学年高二上学期期末考试化学试题(实验班、重点班)
名校
8 . 已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mol·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图象(实线)。下列叙述正确的是
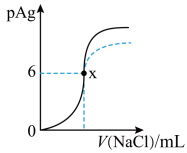

| A.原AgNO3溶液的物质的量浓度为0.1mol·L-1 |
| B.图中x点表示溶液中Ag+已经完全沉淀 |
| C.图中x点的坐标为(10,6) |
| D.若把NaCl溶液换成0.1mol·L-1NaI溶液,则图象在终点后变为虚线部分 |
您最近一年使用:0次
2019-02-14更新
|
943次组卷
|
9卷引用:山西省长治市第二中学2019-2020学年高二上学期期中考试化学试题
山西省长治市第二中学2019-2020学年高二上学期期中考试化学试题福建省福州市第八中学2016-2017学年高二下学期期末考试(理)化学试题【市级联考】福建省泉州市2019届高三上学期单科质量检查化学试题【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高二下学期第一次月考(开学)化学试题河北省武邑中学2019-2020学年高二12月月考化学试题西藏自治区昌都市第一高级中学2020届高三下学期第一次模拟考试理综化学试题(已下线)福建省霞浦第一中学2018-2019学年高二下学期第一次月考化学试题(B卷)(已下线)小题必刷34 沉淀溶解平衡、溶度积常数及其应用——2021年高考化学一轮复习小题必刷(通用版本)甘肃省兰州市2019届高三二诊理综化学试题
名校
解题方法
9 . 未来脑教学云平台*按要求回答下列问题∶
(1)常温下,向VL 0.1mol/L的醋酸溶液中加水稀释,下列说法中正确的是___________ (填字母)。
A.溶液中导电粒子的数目将减少
B.由水电离的c(H+)浓度将减小
C.溶液中 不变
不变
D. 溶液中 将减小
将减小
E.醋酸的电离程度将增大,c(H+)也增大
(2)①常温下,将0.1mol/L的硫酸V1mL与0.1mol/LNaOH溶液V2mL混合后,溶液的pH=1则V1∶V2=___________ (忽略溶液体积的变化)。
②常温下,若溶液由pH=3的盐酸V1mL与pH=11的某碱BOH溶液V2mL混合而得,则下列假设和结论都正确的是____________ (填字母)。
A.若混合后溶液呈中性,则c(H+)+c (OH-)=2×10-7h$mol/L
B.若V1=V2,则混合后溶液的pH一定等于7
C.若V1=V2,则混合后一定有∶c(Cl-)>c(B+)>c(H+)>c(OH-)
D.混合后的溶液中一定有c(B+)+c(H+)=c(Cl-)+c (OH-)
(3)常温下,浓度均为0.1mol/L的五种溶液的pH如下表所示∶
①写出向NaClO溶液中通入少量CO2的离子方程式___________________ 。
②将浓度均为0.01mol/L下列溶液分别加水稀释10倍,pH变化最小的是________ (填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③常温下,等浓度的醋酸与醋酸钠组成的混合溶液pH=6,则c(CH3COO-)-c(CH3COOH)= ________________ (填准确数值)。
(4)已知常温下Ksp(AgCl)=1.0×10-10,Ksp (CH3COOAg)=9.0×10-4。常温下,CH3COOAg若要在NaCl溶液中开始转化为AgCl沉淀,则NaCl的浓度必须不低于_______________ 。
(1)常温下,向VL 0.1mol/L的醋酸溶液中加水稀释,下列说法中正确的是
A.溶液中导电粒子的数目将减少
B.由水电离的c(H+)浓度将减小
C.溶液中
 不变
不变D. 溶液中
 将减小
将减小E.醋酸的电离程度将增大,c(H+)也增大
(2)①常温下,将0.1mol/L的硫酸V1mL与0.1mol/LNaOH溶液V2mL混合后,溶液的pH=1则V1∶V2=
②常温下,若溶液由pH=3的盐酸V1mL与pH=11的某碱BOH溶液V2mL混合而得,则下列假设和结论都正确的是_
A.若混合后溶液呈中性,则c(H+)+c (OH-)=2×10-7h$mol/L
B.若V1=V2,则混合后溶液的pH一定等于7
C.若V1=V2,则混合后一定有∶c(Cl-)>c(B+)>c(H+)>c(OH-)
D.混合后的溶液中一定有c(B+)+c(H+)=c(Cl-)+c (OH-)
(3)常温下,浓度均为0.1mol/L的五种溶液的pH如下表所示∶
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
②将浓度均为0.01mol/L下列溶液分别加水稀释10倍,pH变化最小的是
A.HCN B.HClO C.H2CO3 D.CH3COOH
③常温下,等浓度的醋酸与醋酸钠组成的混合溶液pH=6,则c(CH3COO-)-c(CH3COOH)= _
(4)已知常温下Ksp(AgCl)=1.0×10-10,Ksp (CH3COOAg)=9.0×10-4。常温下,CH3COOAg若要在NaCl溶液中开始转化为AgCl沉淀,则NaCl的浓度必须不低于
您最近一年使用:0次
2016-12-09更新
|
888次组卷
|
2卷引用:山西省康杰中学2017-2018学年高二上学期期中考试化学试题



