名校
1 . 一定温度下,将足量的AgCl分别加入下列物质中,AgCl的溶解度由大到小的排列顺序是
①30mL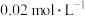 NaCl溶液
NaCl溶液
②20mL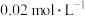 CaCl2溶液
CaCl2溶液
③40mL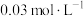 HCl溶液
HCl溶液
④10mL蒸馏水
⑤50mL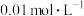 AgNO3溶液
AgNO3溶液
①30mL
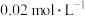 NaCl溶液
NaCl溶液 ②20mL
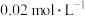 CaCl2溶液
CaCl2溶液③40mL
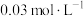 HCl溶液
HCl溶液 ④10mL蒸馏水
⑤50mL
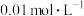 AgNO3溶液
AgNO3溶液| A.④>⑤>①>③>② | B.④>①>③>②>⑤ |
| C.⑤>④>②>①>③ | D.④>③>⑤>②>① |
您最近一年使用:0次
名校
解题方法
2 . 根据实验目的,下列操作及现象、结论都正确的是
| 实验目的 | 操作及现象 | 结论 | |
| A | 比较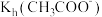 和 和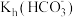 的大小 的大小 | 25℃时, 分别测浓度均为 的 的 和 和 溶液的pH,后者pH大 溶液的pH,后者pH大 | 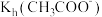 < 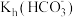 |
| B | 比较 和 和 的大小 的大小 | 将pH相同的 溶液和 溶液和 溶液均稀释10倍后,用pH计测量, 溶液均稀释10倍后,用pH计测量, 的pH大 的pH大 |   |
| C | 比较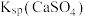 和 和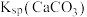 的大小 的大小 | 向饱和CaSO4溶液中滴加相同浓度的Na2CO3溶液,产生白色沉淀 | 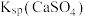 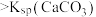 |
| D | 比较Cu2+和Fe3+对 分解的催化效果 分解的催化效果 | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和FeCl3溶液,后者生成气体的速率快 | 催化效果 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-11更新
|
196次组卷
|
2卷引用:山东省淄博市2022-2023学年高二上学期期末考试化学试题
3 . 一种废电解质渣(Ni、Fe、Cu及NH4F)制备NiCO3的工艺流程如下:

已知:①25℃时,一些金属氢氧化物沉淀时的pH如下:
②25℃时, ,
, ,
, ;
;
③某离子沉淀完全时,其浓度
下列说法错误的是

已知:①25℃时,一些金属氢氧化物沉淀时的pH如下:
 |  |  |  | |
| 开始沉淀的pH | 2.3 | 6.8 | 4.2 | 7.0 |
| 完全沉淀的pH | 3.2 | 8.3 | 6.7 | 9.5 |
 ,
, ,
, ;
;③某离子沉淀完全时,其浓度

下列说法错误的是
A.“洗脱”可去除 ,所得滤液显酸性 ,所得滤液显酸性 |
| B.“酸浸”可选用30%盐酸代替20%硝酸 |
| C.“调pH”应调整pH的范围为6.7~7.0 |
D.“沉镍”使 沉淀完全,应控制溶液中 沉淀完全,应控制溶液中 |
您最近一年使用:0次
2023-02-11更新
|
252次组卷
|
2卷引用:山东省淄博市2022-2023学年高二上学期期末考试化学试题
解题方法
4 . 下列有关实验操作、现象和结论都正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 将二氧化碳通入氯化钡溶液中,产生沉淀 | 盐酸的酸性大于碳酸 |
| B | 向铜与浓硫酸反应后的溶液中加水后溶液变蓝 | 反应后有Cu2+生成 |
| C | 室温时,将等体积、等物质的量浓度的FeCl3、CuSO4溶液分别加入等体积的30%的H2O2溶液中 | 探究Fe3+、Cu2+的催化效果的优劣 |
| D | 向相同物质的量浓度的NaCl、NaI混合溶液中滴加少量稀AgNO3溶液,先有黄色沉淀生成 | 相同温度时Ksp(AgI)<Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-11更新
|
245次组卷
|
2卷引用:山东省日照市2022-2023学年高三上学期期末校际考试化学试题
22-23高二上·辽宁朝阳·阶段练习
名校
解题方法
5 . 下列对有关实验现象的解释或所得结论不正确的是
| 实验操作 | 现象 | 解释或结论 | |
| A | 向2mL 0.1mol/L Na2S溶液中滴加0.1mol/LZnSO4溶液至不再有沉淀产生,再滴加几滴0.1mol/L CuSO4 溶液 | 先产生白色沉淀,又出现黑色沉淀 | Ksp(ZnS)>Ksp(CuS) |
| B | 用蒸馏水溶解CuCl2固体,并继续加水稀释 | 溶液由绿色逐渐变为蓝色 | [CuCl4]2-+4H2O 4Cl-+[Cu(H2O)4]2+正向移动 4Cl-+[Cu(H2O)4]2+正向移动 |
| C | 将25℃ 0.1mol/L 的 Na2SO3溶液加热到40℃,用传感器监测溶液pH变化 | 溶液的pH逐渐减小 | 温度升高,SO 的水解增大程度小于水的电离增大程度,导致最终c(H+)升高 的水解增大程度小于水的电离增大程度,导致最终c(H+)升高 |
| D | 向某补血口服液中滴加酸性KMnO4溶液 | 酸性KMnO4溶液紫色褪去 | 该补血口服液中一定含有Fe2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-05更新
|
217次组卷
|
4卷引用:山东省济南市2022届高三3月高考模拟考试(一模)(选择题6-10)
(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题6-10)(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(选择题6-10)河北省邢台市临城县等4地邢台市第二中学等2校2022-2023学年高三上学期12月月考化学试题辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期1月月考化学试题
6 . 以含锌废液(主要含有硫酸锌,同时含少量硫酸亚铁、硫酸锰杂质)为原料制备某碱式碳酸锌 的工艺流程如图所示:
的工艺流程如图所示:

已知氢氧化物从开始沉淀到沉淀完全的pH范围: 沉淀的pH是2~3.3,
沉淀的pH是2~3.3, 沉淀的pH是7.8~9.2,
沉淀的pH是7.8~9.2, 沉淀的pH是5.4~8.0。
沉淀的pH是5.4~8.0。
(1)有同学认为“氧化除锰”加入的试剂 中硫的化合价为+7价,你同意该同学的结论吗?
中硫的化合价为+7价,你同意该同学的结论吗?_______ (填“同意”或“不同意”),理由是_______ 。
(2)为了不引入新的杂质,试剂X可能为_______ (填化学式)。能用Zn“调节pH”吗?_______ (填“能”或“不能”),请说明理由:_______ 。
(3)请写出“沉锌”时发生反应的离子方程式:_______ 。
(4)“过滤”后需洗涤沉淀,请说明确认沉淀洗净的方法:_______ 。
 的工艺流程如图所示:
的工艺流程如图所示:
已知氢氧化物从开始沉淀到沉淀完全的pH范围:
 沉淀的pH是2~3.3,
沉淀的pH是2~3.3, 沉淀的pH是7.8~9.2,
沉淀的pH是7.8~9.2, 沉淀的pH是5.4~8.0。
沉淀的pH是5.4~8.0。(1)有同学认为“氧化除锰”加入的试剂
 中硫的化合价为+7价,你同意该同学的结论吗?
中硫的化合价为+7价,你同意该同学的结论吗?(2)为了不引入新的杂质,试剂X可能为
(3)请写出“沉锌”时发生反应的离子方程式:
(4)“过滤”后需洗涤沉淀,请说明确认沉淀洗净的方法:
您最近一年使用:0次
名校
7 . 常温下,保持某含少量 浊液的水体中
浊液的水体中 与空气中
与空气中 的平衡,调节水体
的平衡,调节水体 ,水体中
,水体中 与
与 的关系如下图所示(其中X为
的关系如下图所示(其中X为 或
或 ).下列说法错误的是
).下列说法错误的是

 浊液的水体中
浊液的水体中 与空气中
与空气中 的平衡,调节水体
的平衡,调节水体 ,水体中
,水体中 与
与 的关系如下图所示(其中X为
的关系如下图所示(其中X为 或
或 ).下列说法错误的是
).下列说法错误的是
A.曲线Ⅱ表示 与 与 的关系 的关系 |
B.该温度下, 的电离常数 的电离常数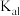 的数量级为 的数量级为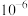 |
C.a点的水体中: |
D.向水体中加入适量 固体,可使溶液由b点变到c点 固体,可使溶液由b点变到c点 |
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出生成Mg(OH)Cl关反应的化学方程式_______ 。
(2)用电解法制取金属镁时,需要无水氯化镁。需要在干燥的HCl气流中加热MgCl2·6H2O,才能得到无水MgCl2,其原因是_______ 。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_______ 沉淀(填化学式)。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
Ⅱ.现有常温下的0.1mol·L-1纯碱溶液。
(4)你认为该溶液呈碱性的原因是(用离子方程式表示):_______ 。
(5)已知25℃时,Kh=2×10-4,则当溶液中c(HCO ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=_______
(6)0.1mol·L-1 Na2CO3溶液中c(OH-)-c(H+)=_______ [用含c(HCO )、c(H2CO3)的关系式表示]
)、c(H2CO3)的关系式表示]
(7)向Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:_______
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出生成Mg(OH)Cl关反应的化学方程式
(2)用电解法制取金属镁时,需要无水氯化镁。需要在干燥的HCl气流中加热MgCl2·6H2O,才能得到无水MgCl2,其原因是
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
Ⅱ.现有常温下的0.1mol·L-1纯碱溶液。
(4)你认为该溶液呈碱性的原因是(用离子方程式表示):
(5)已知25℃时,Kh=2×10-4,则当溶液中c(HCO
 ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=(6)0.1mol·L-1 Na2CO3溶液中c(OH-)-c(H+)=
 )、c(H2CO3)的关系式表示]
)、c(H2CO3)的关系式表示](7)向Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:
您最近一年使用:0次
名校
解题方法
9 . 填空。
(1)水在25℃和95℃时电离平衡曲线如图。

①已知在25℃时,将 的
的 溶液与
溶液与 的
的 溶液均升温至35℃,两溶液
溶液均升温至35℃,两溶液 变化分别为
变化分别为_______ (填字母)。
A.增加、减小 B.增加、增加 C.减小、不变 D.不变、减小
②在曲线B所对应的温度下,将 的
的 溶液与
溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则
,则 溶液与
溶液与 溶液的体积比为
溶液的体积比为_______ 。
(2)常温下, 溶液
溶液 约为3,
约为3,
_______  ,通入
,通入 气体(忽略溶液体积的变化)至
气体(忽略溶液体积的变化)至 ,则
,则 的电离度约为。
的电离度约为。_______ 。
(3)已知25℃,弱酸的电离平衡常数如表:
① 可以被
可以被 溶液捕获,若所得溶液
溶液捕获,若所得溶液 ,
, 主要转化为
主要转化为_______ (写离子符号);若所得溶液中 ,则溶液
,则溶液
_______ 。
②下列微粒可以大量共存的是_______ (填字母)。
A. 、
、 B.
B. 、
、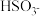 C.
C. 、
、 D.
D. 、
、
③少量 通入
通入 溶液中的离子方程式为
溶液中的离子方程式为_______ 。
(1)水在25℃和95℃时电离平衡曲线如图。

①已知在25℃时,将
 的
的 溶液与
溶液与 的
的 溶液均升温至35℃,两溶液
溶液均升温至35℃,两溶液 变化分别为
变化分别为A.增加、减小 B.增加、增加 C.减小、不变 D.不变、减小
②在曲线B所对应的温度下,将
 的
的 溶液与
溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则
,则 溶液与
溶液与 溶液的体积比为
溶液的体积比为(2)常温下,
 溶液
溶液 约为3,
约为3,
 ,通入
,通入 气体(忽略溶液体积的变化)至
气体(忽略溶液体积的变化)至 ,则
,则 的电离度约为。
的电离度约为。(3)已知25℃,弱酸的电离平衡常数如表:
| 弱酸 | 电离平衡常数( ) ) |
 |  |
 |  |
 |  |
 可以被
可以被 溶液捕获,若所得溶液
溶液捕获,若所得溶液 ,
, 主要转化为
主要转化为 ,则溶液
,则溶液
②下列微粒可以大量共存的是
A.
 、
、 B.
B. 、
、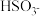 C.
C. 、
、 D.
D. 、
、
③少量
 通入
通入 溶液中的离子方程式为
溶液中的离子方程式为
您最近一年使用:0次
10 . 锇酸钾晶体 微溶于冷水,常用作催化剂。由含锇约
微溶于冷水,常用作催化剂。由含锇约 的锇吸收液(主要成分为
的锇吸收液(主要成分为 ,含少量
,含少量 及
及 、
、 杂质)精制提纯锇酸钾的工业流程如下:
杂质)精制提纯锇酸钾的工业流程如下: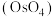 的熔点为
的熔点为 ,沸点为
,沸点为 ,易挥发
,易挥发
回答下列问题:
(1)“沉锇”得到难溶物 ,该化合物中锇元素的化合价为
,该化合物中锇元素的化合价为_______ 。
(2)检验滤液1和滤液2中金属阳离子的实验方法是_______ 。
(3)“溶解、蒸馏”步骤中,先加入50%硫酸得到 溶液,再加入
溶液,再加入 反应后蒸馏出
反应后蒸馏出 ,生成
,生成 的离子反应方程式为
的离子反应方程式为_______ 。
(4) 用
用 溶液吸收后又得到
溶液吸收后又得到 溶液,吸收液中仍然存在少量
溶液,吸收液中仍然存在少量 杂质,“吸收、分离”操作加入甲醇的目的是
杂质,“吸收、分离”操作加入甲醇的目的是_______ 。流程中从初始的锇吸收液到“吸收、分离”操作的目的是_______ 。
(5)“转化”时须加入过量 溶液,用平衡原理解释其原因
溶液,用平衡原理解释其原因_______ 。
(6)已知: 。锇吸收液中
。锇吸收液中 、
、 浓度分别为
浓度分别为 和
和 ,若取
,若取 废液,则至少需加入
废液,则至少需加入_______  才能使废液中
才能使废液中 、
、 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。
 微溶于冷水,常用作催化剂。由含锇约
微溶于冷水,常用作催化剂。由含锇约 的锇吸收液(主要成分为
的锇吸收液(主要成分为 ,含少量
,含少量 及
及 、
、 杂质)精制提纯锇酸钾的工业流程如下:
杂质)精制提纯锇酸钾的工业流程如下:
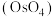 的熔点为
的熔点为 ,沸点为
,沸点为 ,易挥发
,易挥发回答下列问题:
(1)“沉锇”得到难溶物
 ,该化合物中锇元素的化合价为
,该化合物中锇元素的化合价为(2)检验滤液1和滤液2中金属阳离子的实验方法是
(3)“溶解、蒸馏”步骤中,先加入50%硫酸得到
 溶液,再加入
溶液,再加入 反应后蒸馏出
反应后蒸馏出 ,生成
,生成 的离子反应方程式为
的离子反应方程式为(4)
 用
用 溶液吸收后又得到
溶液吸收后又得到 溶液,吸收液中仍然存在少量
溶液,吸收液中仍然存在少量 杂质,“吸收、分离”操作加入甲醇的目的是
杂质,“吸收、分离”操作加入甲醇的目的是(5)“转化”时须加入过量
 溶液,用平衡原理解释其原因
溶液,用平衡原理解释其原因(6)已知:
 。锇吸收液中
。锇吸收液中 、
、 浓度分别为
浓度分别为 和
和 ,若取
,若取 废液,则至少需加入
废液,则至少需加入 才能使废液中
才能使废液中 、
、 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。
您最近一年使用:0次
2022-11-09更新
|
275次组卷
|
2卷引用:山东省潍坊市2022-2023学年高三上学期期中考试化学考试题



