1 . 电化学方法是化工生产及生活中常用的一种方法。回答下列问题:
I.闸门由钢质材料制作,长期浸于水中,通常采用如图装置对闸门进行保护。

(1)a、b间用导线连接时,X可以是___________ ,其保护方法的名称是___________ 。
(2)a、b间外接电源也可保护钢闸门,某员工因粗心把a错接到电源的正极,导致加快了钢闸门的腐蚀,检验阳极产物时加入___________ 溶液,现象为有蓝色沉淀生成。
Ⅱ.二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺如图所示:
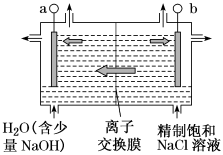
(3)图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。产生ClO2的电极发生___________ 反应(填“氧化”或“还原”),对应的电极反应式为___________ 。
(4)外电路每通过10NA电子时,生成的ClO2物质的量是___________ mol
(5)a极区溶液的pH___________ (填“增大”“减小”或“不变”),图中离子交换膜应使用___________ (填“阴”或“阳”)离子交换膜。
I.闸门由钢质材料制作,长期浸于水中,通常采用如图装置对闸门进行保护。

(1)a、b间用导线连接时,X可以是
(2)a、b间外接电源也可保护钢闸门,某员工因粗心把a错接到电源的正极,导致加快了钢闸门的腐蚀,检验阳极产物时加入
Ⅱ.二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺如图所示:

(3)图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。产生ClO2的电极发生
(4)外电路每通过10NA电子时,生成的ClO2物质的量是
(5)a极区溶液的pH
您最近一年使用:0次
解题方法
2 . 根据所学电化学知识填空。
(1)如图为锌铜原电池的装置示意图,其中盐桥内装有含饱和KCl溶液的琼胶。请回答下列问题:
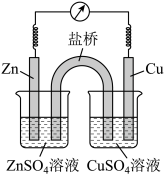
①Zn电极为电池的_______ (填“正极”或“负极”)。
②写出电极反应式:Zn电极_______ ,Cu电极_______ 。
③盐桥中向CuSO4溶液中迁移的离子是_______ (填离子符号)。
(2)金属腐蚀现象在生产生活中普遍存在,依据下列两种腐蚀现象回答下列问题:
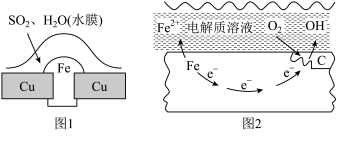
①图1中被腐蚀的金属为_______ (填化学式);图2中金属腐蚀类型属于_______ (填字母)。
A.化学腐蚀 B.析氢腐蚀 C.吸氧腐蚀
②图2中铁的生锈过程中正极反应式为_______ 。
(1)如图为锌铜原电池的装置示意图,其中盐桥内装有含饱和KCl溶液的琼胶。请回答下列问题:

①Zn电极为电池的
②写出电极反应式:Zn电极
③盐桥中向CuSO4溶液中迁移的离子是
(2)金属腐蚀现象在生产生活中普遍存在,依据下列两种腐蚀现象回答下列问题:

①图1中被腐蚀的金属为
A.化学腐蚀 B.析氢腐蚀 C.吸氧腐蚀
②图2中铁的生锈过程中正极反应式为
您最近一年使用:0次
名校
解题方法
3 . 电化学是研究化学能与电能转换的装置、过程和效率的科学,应用极其广泛。回答下列问题:
(1)下列化学反应在理论上可以设计成原电池的是______________ (填序号)。
I.CaO(s)+H2O(l) = Ca(OH)2 ΔH <0
II.C(s)+H2O(g) = CO(g)+H2(g) ΔH >0
III.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) ΔH <0
VI.2H2(g)+O2(g) = 2H2O(1) ΔH <0
(2)下图容器中均盛有稀硫酸。
①装置A 中的能量转化方式是_____________________________ ,装置 C 电池总反应为____________________________________________________________ 。
②装置D中铜电极上观察到的现象_____________________________ ,溶液中的 H+移向_____________ (填“Cu”或“Fe”)极附近。
③四个装置中的铁被腐蚀时由快到慢的顺序是______________ (填字母)。
(1)下列化学反应在理论上可以设计成原电池的是
I.CaO(s)+H2O(l) = Ca(OH)2 ΔH <0
II.C(s)+H2O(g) = CO(g)+H2(g) ΔH >0
III.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) ΔH <0
VI.2H2(g)+O2(g) = 2H2O(1) ΔH <0
(2)下图容器中均盛有稀硫酸。

①装置A 中的能量转化方式是
②装置D中铜电极上观察到的现象
③四个装置中的铁被腐蚀时由快到慢的顺序是
您最近一年使用:0次
4 . 钢铁工业是国家工业的基础,钢铁生锈现象却随处可见,为此每年国家损失大量资金。
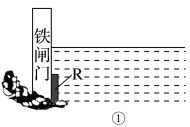
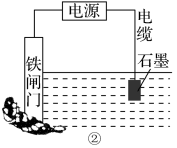
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的正极电极反应式为:_____________
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用图①所示的方案,其中焊接在铁闸门上的固体材料R可以采用________ 。
A.铜 B.钠 C.锌 D.石墨
(3)图②所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的__________ 极。
(4)钢铁的防护除了用电化学保护方法之外,在钢铁制品表面镀铜也可以有效地防止其腐蚀,电镀的装置如图所示:
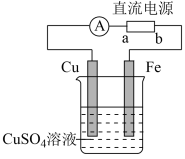
①电镀装置图的“直流电源”中,______  填“a”或“b”
填“a”或“b” 是正极。Fe电极反应式为
是正极。Fe电极反应式为_________ ;
②接通电源前,装置图中的铜、铁两个电极质量相等,电镀完成后,将两个电极取出,用水小心冲洗干净、烘干,然后称量,二者质量之差为5.12g,由此计算电镀过程中电路中通过电子的物质的量为________ 。
③上述铁镀件破损后,铁更容易被腐蚀。请简要说明镀铜铁镀件破损后,铁更容易被腐蚀的原因:______ 。


(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的正极电极反应式为:
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用图①所示的方案,其中焊接在铁闸门上的固体材料R可以采用
A.铜 B.钠 C.锌 D.石墨
(3)图②所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的
(4)钢铁的防护除了用电化学保护方法之外,在钢铁制品表面镀铜也可以有效地防止其腐蚀,电镀的装置如图所示:

①电镀装置图的“直流电源”中,
 填“a”或“b”
填“a”或“b”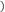 是正极。Fe电极反应式为
是正极。Fe电极反应式为②接通电源前,装置图中的铜、铁两个电极质量相等,电镀完成后,将两个电极取出,用水小心冲洗干净、烘干,然后称量,二者质量之差为5.12g,由此计算电镀过程中电路中通过电子的物质的量为
③上述铁镀件破损后,铁更容易被腐蚀。请简要说明镀铜铁镀件破损后,铁更容易被腐蚀的原因:
您最近一年使用:0次
5 . 实际生产生活中,钢铁等金属因电化学腐蚀损失巨大,而电化学在金属制备和加工中也发挥着重要的作用。
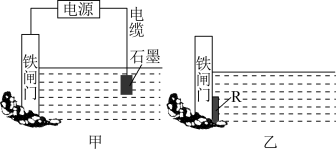
(1)生活中钢铁腐蚀以吸氧腐蚀为主,该腐蚀过程中正极的电极反应式为_____ 。金属的两种常见电化学防护方法如下图所示,图甲中铁闸门连接电源的_____ (填“正极”或“负极”),图乙所示金属的防护方法称为_____ 。
(2)某科研单位利用 —空气质子交换膜燃料电池制备高纯铬和硫酸的简单装置如下图所示:
—空气质子交换膜燃料电池制备高纯铬和硫酸的简单装置如下图所示:
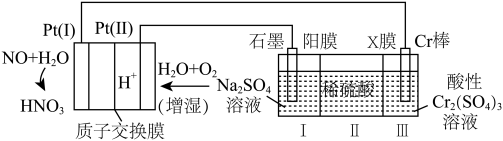
① (Ⅱ)电极为
(Ⅱ)电极为_____ (填“正极”“负极”“阴极”或“阳极”), (Ⅰ)电极上发生的电极反应式为
(Ⅰ)电极上发生的电极反应式为_____ 。
②X膜为_____ 交换膜(填“阴离子”或“阳离子”)。
③理论上, (Ⅱ)电极上参加反应的
(Ⅱ)电极上参加反应的 标况下为1.68L,则
标况下为1.68L,则 棒增重
棒增重_____ g,Ⅰ室内溶液质量减少_____ g(忽略溶液挥发)。
(1)生活中钢铁腐蚀以吸氧腐蚀为主,该腐蚀过程中正极的电极反应式为

(2)某科研单位利用
 —空气质子交换膜燃料电池制备高纯铬和硫酸的简单装置如下图所示:
—空气质子交换膜燃料电池制备高纯铬和硫酸的简单装置如下图所示:
①
 (Ⅱ)电极为
(Ⅱ)电极为 (Ⅰ)电极上发生的电极反应式为
(Ⅰ)电极上发生的电极反应式为②X膜为
③理论上,
 (Ⅱ)电极上参加反应的
(Ⅱ)电极上参加反应的 标况下为1.68L,则
标况下为1.68L,则 棒增重
棒增重
您最近一年使用:0次
解题方法
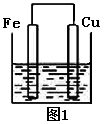
6 . 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:
(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为______________ ,铜片周围溶液会出现___________ 的现象。
(2)若2 min后测得铁片和铜片之间的质量差为1.2g,计算:导线中流过的电子的物质的量为_________________ mol;
(3)金属的电化学腐蚀的本质是形成了原电池。如下图所示,烧杯中都盛有稀硫酸。
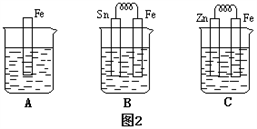
①图2 B中的Sn为________ 极,Sn极附近溶液的pH(填增大、减小或不变)___________ 。
②图2 C中被腐蚀的金属是___________ 。比较A、B、C中纯铁被腐蚀的速率由快到慢的顺序是______ 。
(4)人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
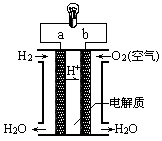
①氢氧燃料电池的总反应化学方程式是:___________________ 。
②电池工作一段时间后硫酸溶液的浓度_____________ (填“增大”、“减小”或“不变”)。
(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为
(2)若2 min后测得铁片和铜片之间的质量差为1.2g,计算:导线中流过的电子的物质的量为
(3)金属的电化学腐蚀的本质是形成了原电池。如下图所示,烧杯中都盛有稀硫酸。


①图2 B中的Sn为
②图2 C中被腐蚀的金属是
(4)人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①氢氧燃料电池的总反应化学方程式是:
②电池工作一段时间后硫酸溶液的浓度
您最近一年使用:0次
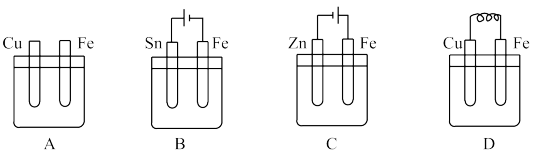
7 . Ⅰ.(1)研究钢铁的防腐蚀措施意义重大。利用如图装置,可以模拟铁的电化学防护,其中Y为NaCl。为减缓铁的腐蚀:
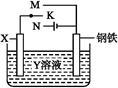
①若X为碳棒,开关K应置于__ (填字母,下同)处,②若X为锌, 开关K应置于__ 处。
(2)在城市中地下常埋有纵横交错的管道和输电线路,地上还铺有地铁、城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道形成回路时,就会引起后者的腐蚀。为表示其原理,某班级的学生绘制了下列装置图(假设电极材料均为铁,电解质均为NaCl溶液)。
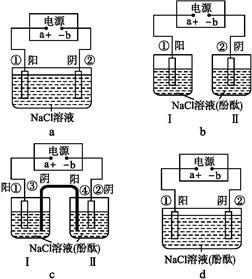
你认为其中能合理模拟金属管道的腐蚀原理的是__ ;图c中的总反应方程式是___ ;
Ⅱ.1 L某溶液中含有的离子如下表:

用惰性电极电解该溶液,当电路中有5 mol e-通过时,溶液的c(H+)=__ mol/L (忽略电解时溶液体积的变化及电极产物可能存在的溶解现象)。

①若X为碳棒,开关K应置于
(2)在城市中地下常埋有纵横交错的管道和输电线路,地上还铺有地铁、城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道形成回路时,就会引起后者的腐蚀。为表示其原理,某班级的学生绘制了下列装置图(假设电极材料均为铁,电解质均为NaCl溶液)。

你认为其中能合理模拟金属管道的腐蚀原理的是
Ⅱ.1 L某溶液中含有的离子如下表:

用惰性电极电解该溶液,当电路中有5 mol e-通过时,溶液的c(H+)=
您最近一年使用:0次
解题方法
8 . 根据信息填空
(1)用如图所示的装置进行铝热法炼铁实验,写出铝热法炼铁反应的化学方程式:_______ 。
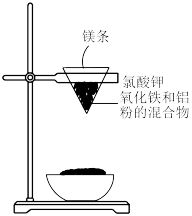
(2)已知:Fe+2FeCl3=3FeCl2,利用这一反应,设计一个原电池,画出示意图,标明电极材料名称,电解质溶液______ 。该原电池中,三价铁离子向_______ (填“正极”或“负极”)移动。负极的电极反应式为_______

(3)古代《药性论》中有关铅丹(Pb3O4)的描述是治惊悸狂走,呕逆,消渴,铅丹(Pb3O4)也可作为防锈用涂料,呈红褐色,又名红丹。
①铅丹可用PbO在空气中加热制备,请写出有关反应的化学方程式_______ 。
②铅丹曾用于铁制品防锈,请举例说明铁制品防锈的其它方法_______ (只填一种方法)。
(1)用如图所示的装置进行铝热法炼铁实验,写出铝热法炼铁反应的化学方程式:

(2)已知:Fe+2FeCl3=3FeCl2,利用这一反应,设计一个原电池,画出示意图,标明电极材料名称,电解质溶液

(3)古代《药性论》中有关铅丹(Pb3O4)的描述是治惊悸狂走,呕逆,消渴,铅丹(Pb3O4)也可作为防锈用涂料,呈红褐色,又名红丹。
①铅丹可用PbO在空气中加热制备,请写出有关反应的化学方程式
②铅丹曾用于铁制品防锈,请举例说明铁制品防锈的其它方法
您最近一年使用:0次
名校
解题方法
9 . 如图所示是原电池的装置图。请回答:

(1)若C为NaCl溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为___________ ;反应进行一段时间后,向两电极附近溶液滴加酚酞试剂,___________ (填“A”或“B”)电极周围溶液显红色。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为___________ ,B(负极)极材料为___________ ,溶液C为___________ 。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是___________ (填“正极”或“负极”),c电极的反应方程式为___________ 。若线路中转移1mol电子,则上述CH3OH燃料电池消耗的O2在标准状况下的体积为___________ L。

(1)若C为NaCl溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是
您最近一年使用:0次
10 . I.肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。 已知在25℃、l0lkPA时,16gN2H4在氧气中完全燃烧生成氮气和H2O,放出热量312kJ。
(1)该条件下,N2H4完全燃烧的热化学方程式为______________
(2)传统制备肼的方法是以NAClO氧化NH3,制得肼的稀溶液,该反应的方程式为______________
II.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
(1)铁在潮湿的空气中容易被腐蚀,写出铁发生电化学腐蚀时,负极的电极反应式______________
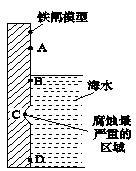
(2)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。图中A、B、C、D四个区域,生成铁锈最多的是_______ (填字母)
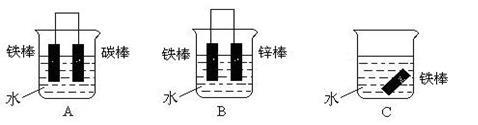
(3)下列各个装置中铁棒被腐蚀由难到易的顺序是______ (填字母)
(1)该条件下,N2H4完全燃烧的热化学方程式为
(2)传统制备肼的方法是以NAClO氧化NH3,制得肼的稀溶液,该反应的方程式为
II.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
(1)铁在潮湿的空气中容易被腐蚀,写出铁发生电化学腐蚀时,负极的电极反应式
(2)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。图中A、B、C、D四个区域,生成铁锈最多的是

(3)下列各个装置中铁棒被腐蚀由难到易的顺序是

您最近一年使用:0次



