名校
解题方法
1 . 水系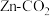 电池在碳循环方面具有广阔的应用前景。该电池的示意图如下,其中双极膜在工作时催化
电池在碳循环方面具有广阔的应用前景。该电池的示意图如下,其中双极膜在工作时催化 解离为
解离为 和
和 ,并在直流电场的作用下分别向两极迁移。下列说法正确的是
,并在直流电场的作用下分别向两极迁移。下列说法正确的是
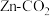 电池在碳循环方面具有广阔的应用前景。该电池的示意图如下,其中双极膜在工作时催化
电池在碳循环方面具有广阔的应用前景。该电池的示意图如下,其中双极膜在工作时催化 解离为
解离为 和
和 ,并在直流电场的作用下分别向两极迁移。下列说法正确的是
,并在直流电场的作用下分别向两极迁移。下列说法正确的是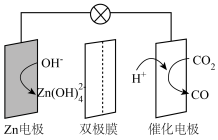
A.放电时, 电极为负极,发生还原反应 电极为负极,发生还原反应 |
B.充电时, 从 从 电极通过双极膜到达催化电极发生反应 电极通过双极膜到达催化电极发生反应 |
C.放电时,催化电极上的反应为 |
D.充电时, 电极上的反应为 电极上的反应为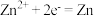 |
您最近一年使用:0次
2024-01-23更新
|
1691次组卷
|
7卷引用:2024年1月“九省联考”江西卷真题完全解读与考后提升
(已下线)2024年1月“九省联考”江西卷真题完全解读与考后提升(已下线)选择题6-102024年1月江西普通高等学校招生考试适应性测试化学试题四川省遂宁市射洪市四川省射洪中学校2023-2024学年高三下学期开学理综试题-高中化学(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届四川省成都外国语学校高三下学期高考模拟(一)考试理综试题-高中化学2024届陕西省咸阳市乾县第一中学高三下学期第一次模拟考试理综试题-高中化学
名校
解题方法
2 . 以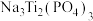 为负极材料的新型可充电钠离子电池的工作原理如图。下列说法错误的是
为负极材料的新型可充电钠离子电池的工作原理如图。下列说法错误的是
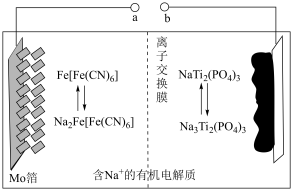
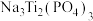 为负极材料的新型可充电钠离子电池的工作原理如图。下列说法错误的是
为负极材料的新型可充电钠离子电池的工作原理如图。下列说法错误的是
A.放电时,正极反应式为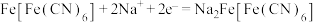 |
B.放电时, 通过离子交换膜从左室移向右室 通过离子交换膜从左室移向右室 |
| C.充电时,a端接电源正极 |
D.充电时,每生成 消耗 消耗 |
您最近一年使用:0次
名校
解题方法
3 . 钴酸锂( )电池是一种应用广泛的新型电源,放电时的电池反应方程式为
)电池是一种应用广泛的新型电源,放电时的电池反应方程式为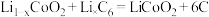 。电池正极材料有
。电池正极材料有 和少量的铝、铁、碳等单质。可利用以下工艺流程回收正极材料中的某些金属资源(还原性:
和少量的铝、铁、碳等单质。可利用以下工艺流程回收正极材料中的某些金属资源(还原性: )。
)。
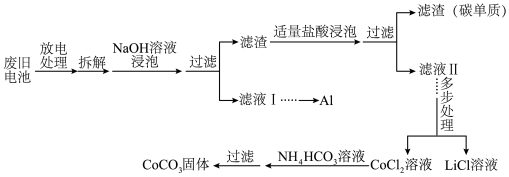
回答下列问题:
(1)基态Co原子的价层电子排布式为___________ 。
(2)“放电处理”时正极的电极反应式为___________ 。
(3)“放电处理”除了考虑“拆解”时的安全因素外,还有利于___________ 。
(4)NaOH溶液浸泡时发生的主要反应的离子方程式为___________ 。
(5)“适量盐酸浸泡”时, 与盐酸反应的化学方程式为
与盐酸反应的化学方程式为___________ 。滤液Ⅱ中的溶质除HCl、LiCl、 外还有
外还有___________ (填化学式)。
(6)加入“ 溶液”发生反应的离子方程式为
溶液”发生反应的离子方程式为___________ 。
 )电池是一种应用广泛的新型电源,放电时的电池反应方程式为
)电池是一种应用广泛的新型电源,放电时的电池反应方程式为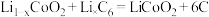 。电池正极材料有
。电池正极材料有 和少量的铝、铁、碳等单质。可利用以下工艺流程回收正极材料中的某些金属资源(还原性:
和少量的铝、铁、碳等单质。可利用以下工艺流程回收正极材料中的某些金属资源(还原性: )。
)。
回答下列问题:
(1)基态Co原子的价层电子排布式为
(2)“放电处理”时正极的电极反应式为
(3)“放电处理”除了考虑“拆解”时的安全因素外,还有利于
(4)NaOH溶液浸泡时发生的主要反应的离子方程式为
(5)“适量盐酸浸泡”时,
 与盐酸反应的化学方程式为
与盐酸反应的化学方程式为 外还有
外还有(6)加入“
 溶液”发生反应的离子方程式为
溶液”发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 2023年星恒电源发布“超钠F1”开启钠电在电动车上产业化元年。该二次电池的电极材料为 (普鲁士白)和
(普鲁士白)和 (嵌钠硬碳)。下列说法中错误的是
(嵌钠硬碳)。下列说法中错误的是
 (普鲁士白)和
(普鲁士白)和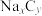 (嵌钠硬碳)。下列说法中错误的是
(嵌钠硬碳)。下列说法中错误的是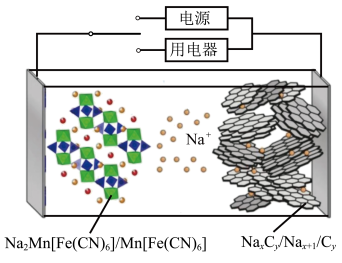
| A.放电时,左边电极电势高 |
B.放电时,负极的电极反应式可表示为: |
C.充电时,电路中每转移 电子,阳极质量增加 电子,阳极质量增加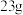 |
| D.比能量:锂离子电池高于钠离子电池 |
您最近一年使用:0次
2024-01-13更新
|
1331次组卷
|
9卷引用:选择题6-10
(已下线)选择题6-10(已下线)T10-电化学基础(已下线)T12-电化学基础辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题2024届辽宁省沈阳市高三教学质量检测(一模)化学试题吉林省通化市梅河口市第五中学2023-2024学年高三上学期1月期末化学试题四川省仁寿第一中学校(北校区)2023-2024学年高三上学期期末考试理综试题-高中化学(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)辽宁省沈阳市2024届高三一模化学试题
名校
解题方法
5 . 电化学“大气固碳”方法是我国科学家研究发现的,相关装置如图所示。下列说法错误的是

| A.放电时电极A为负极,该电池只可选用无水电解液 |
B.充电时,电极B上发生的反应是 |
C.充电时 的移动方向是从电极B移向电极A 的移动方向是从电极B移向电极A |
| D.放电时,电路中每通过1mol电子,正极区质量增加40g |
您最近一年使用:0次
2023-12-24更新
|
2291次组卷
|
15卷引用:选择题6-10
(已下线)选择题6-10(已下线)题型11 新型电化学装置分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)选择题11-15(已下线)T10-电化学基础广东省部分名校2023-2024学年高三上学期联合质量检测化学试题山西省忻州市名校2023-2024学年高三上学期联合质量检测化学试卷福建省厦门外国语学校2023-2024学年高二上学期期末模拟考试化学试题新疆乌鲁木齐市第101中学2023-2024学年高二上学期1月期末化学试题云南省昆明市第三中学2023-2024学年高二上学期1月期末化学试题湖南省常德市第一中学2023-2024学年高二上学期期末考试化学试题(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)广东省深圳市富源学校2023-2024学年高二上学期模拟预测化学试题河北省保定市高碑店市崇德实验中学2023-2024学年高三上学期1月考试化学试题2024届辽宁省实验中学高三下学期考前模拟训练(五模)化学试卷
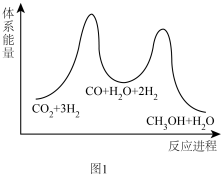
6 . 甲醇既是重要的化工原料,又可作为燃料。利用二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,发生如下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
该反应一般认为通过如”下步骤来实现:
①CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41kJ/mol
CO(g)+H2O(g) △H1=+41kJ/mol
②CO(g)+2H2(g) CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol
(1)总反应的△H=_______ kJ/mol;上述反应能量变化关系如图1所示,则反应_______ (填序号)决定了该反应的快慢。_______ 。
(3)反应②的化学平衡常数K的表达式为_______ ;图2中能正确反映平衡常数K随温度变化关系的曲线为_______ (填曲线标记字母),其判断理由是_______ 。_______ (填序号)
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=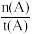 mol/(L·min)
mol/(L·min)
B.该反应在T1时的平衡常数比T2时的小
C.处于A点的反应体系从T1变到T2,达到平衡时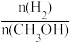 增大
增大
D.v正(H2)=3v逆(CH3OH)说明反应能达到化学平衡状态
②在T1温度时反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为_______ 。
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。该反应一般认为通过如”下步骤来实现:
①CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41kJ/mol
CO(g)+H2O(g) △H1=+41kJ/mol②CO(g)+2H2(g)
 CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol(1)总反应的△H=
(3)反应②的化学平衡常数K的表达式为


A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=
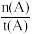 mol/(L·min)
mol/(L·min)B.该反应在T1时的平衡常数比T2时的小
C.处于A点的反应体系从T1变到T2,达到平衡时
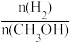 增大
增大D.v正(H2)=3v逆(CH3OH)说明反应能达到化学平衡状态
②在T1温度时反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为
您最近一年使用:0次
2023-12-15更新
|
212次组卷
|
4卷引用:T16-原理综合题
(已下线)T16-原理综合题(已下线)T29-原理综合题云南省腾冲市2022-2023学年高三上学期期中教育教学质量监测理科综合试卷黑龙江省齐齐哈尔市第八中学校2024届高三1月大联考考后强化卷化学试题
名校
7 . 能源的合理开发和利用,低碳减排是人类正在努力解决的大问题。2023年2月21日,中国气候变化特使谢振华获得首届诺贝尔可持续发展特别贡献奖,以表彰他在全球生态保护中作出的巨大贡献。
(1)在298K、101kPa时,已知: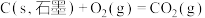
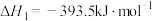
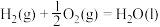
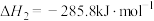

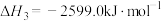
在298K时由C(s,石墨)和 反应生成
反应生成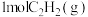 的热化学方程式为
的热化学方程式为___________ 。
(2)为探究用 生产甲醇的反应原理
生产甲醇的反应原理 ,现进行如下实验:在2L恒温恒容密闭容器中,充入
,现进行如下实验:在2L恒温恒容密闭容器中,充入 和
和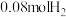 ,测得其压强随时间变化(p-t)如图曲线所示。
,测得其压强随时间变化(p-t)如图曲线所示。
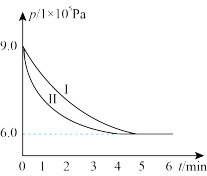
①用 来表示5min内的化学反应速率
来表示5min内的化学反应速率
___________ 。
②其他条件相同时,若只改变某一条件,曲线由Ⅰ变化为Ⅱ,则改变的条件是___________ 。
③该温度下,此反应的平衡常数
___________ 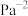 (保留三位有效数字)。(用平衡分压代替平衡浓度计算,分压=总压×
(保留三位有效数字)。(用平衡分压代替平衡浓度计算,分压=总压×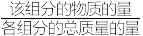 )
)
(3)某科研团队对光催化还原 转化为甲醇进行研究(原理如图所示),取得了一定进展。
转化为甲醇进行研究(原理如图所示),取得了一定进展。
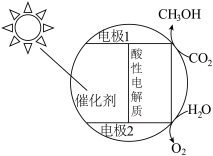
①电极1的电势___________ (填“高于”或“低于”)电极2的电势。
②该光催化过程中,正极的电极反应式为___________ 。
③ 分子中,采用
分子中,采用 杂化的原子数目为
杂化的原子数目为___________ 。
(1)在298K、101kPa时,已知:
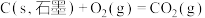
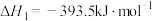
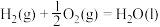
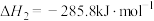

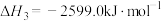
在298K时由C(s,石墨)和
 反应生成
反应生成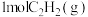 的热化学方程式为
的热化学方程式为(2)为探究用
 生产甲醇的反应原理
生产甲醇的反应原理 ,现进行如下实验:在2L恒温恒容密闭容器中,充入
,现进行如下实验:在2L恒温恒容密闭容器中,充入 和
和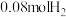 ,测得其压强随时间变化(p-t)如图曲线所示。
,测得其压强随时间变化(p-t)如图曲线所示。
①用
 来表示5min内的化学反应速率
来表示5min内的化学反应速率
②其他条件相同时,若只改变某一条件,曲线由Ⅰ变化为Ⅱ,则改变的条件是
③该温度下,此反应的平衡常数

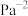 (保留三位有效数字)。(用平衡分压代替平衡浓度计算,分压=总压×
(保留三位有效数字)。(用平衡分压代替平衡浓度计算,分压=总压×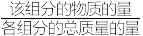 )
)(3)某科研团队对光催化还原
 转化为甲醇进行研究(原理如图所示),取得了一定进展。
转化为甲醇进行研究(原理如图所示),取得了一定进展。
①电极1的电势
②该光催化过程中,正极的电极反应式为
③
 分子中,采用
分子中,采用 杂化的原子数目为
杂化的原子数目为
您最近一年使用:0次
2023-10-22更新
|
158次组卷
|
3卷引用:T16-原理综合题
名校
解题方法
8 . 水是宝贵的自然资源,水的净化与污水处理是化学工作者需要研究的重要课题。
(1)在净水过程中用到混凝剂,其中不可以作为混凝剂使用的是__________ 。
A.硫酸铝 B.氧化铝 C.碱式氯化铝 D.氯化铁
(2)海水淡化是人类获得饮用水的一个重要方法,下列有关海水淡化处理的方法正确的是_____ 。
A.蒸馏法能耗最小,设备最简单;冷冻法要消耗大量能源
B.利用电渗析法淡化海水时,在阴极附近放阴离子交换膜,在阳极附近放阳离子交换膜
C.利用电渗析法淡化海水时,得到淡水的部分在中间区
D.利用反渗透技术可以大量、快速地生产淡水
(3)除了水资源,能源、信息、材料一起构成了现代文明的三大支柱。甲醇是一种重要的化工原料,以甲醇、氧气为基本反应物的新型燃料电池已经问世,其结构如图所示(甲醇解离产生的H+可以通过质子交换膜进入另一极)。请写出通入甲醇的电极上的电极反应式:____________ 。
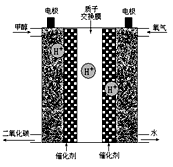
某同学以甲醇燃料电池为电源,以石墨为电极电解500mL 0.2mol·L1 CuSO4溶液,则与电源正极相连的电解池电极上的电极反应式为:_______________________________ ;电解一段时间后,在电解池两极上共产生7.84 L气体(标准状况下),此时甲醇燃料电池中共消耗甲醇_________ g 。
(1)在净水过程中用到混凝剂,其中不可以作为混凝剂使用的是
A.硫酸铝 B.氧化铝 C.碱式氯化铝 D.氯化铁
(2)海水淡化是人类获得饮用水的一个重要方法,下列有关海水淡化处理的方法正确的是
A.蒸馏法能耗最小,设备最简单;冷冻法要消耗大量能源
B.利用电渗析法淡化海水时,在阴极附近放阴离子交换膜,在阳极附近放阳离子交换膜
C.利用电渗析法淡化海水时,得到淡水的部分在中间区
D.利用反渗透技术可以大量、快速地生产淡水
(3)除了水资源,能源、信息、材料一起构成了现代文明的三大支柱。甲醇是一种重要的化工原料,以甲醇、氧气为基本反应物的新型燃料电池已经问世,其结构如图所示(甲醇解离产生的H+可以通过质子交换膜进入另一极)。请写出通入甲醇的电极上的电极反应式:

某同学以甲醇燃料电池为电源,以石墨为电极电解500mL 0.2mol·L1 CuSO4溶液,则与电源正极相连的电解池电极上的电极反应式为:
您最近一年使用:0次
名校
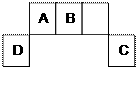
9 . 短周期元素A、B、C、D在周期表中位置如图所示,其中元素D原子最外层有3个电子。请用相应 的化学用语回答:
(1)A与氢元素可以形成很多化合物,在这些化合物中都含有_________ (选填“共价”或“离子”)键;与C相邻且最外层电子比C少1个的离子结构示意图为 _________________ 。B在元素周期表中位于____________________ 。B、C、D形成的离子的半径由大到小 依次为 _________________ 。(填相应的离子符号)
(2)元素A形成的最简单氢化物和氧气在KOH溶液中可构成燃料电池,该电池工作时正极 的电极反应式为 ___________________________________ 。
(3)D的最高价氧化物的水化物与NaOH反应的化学 方程式是:
________________________________________ 。
(4)由A与S形成的液态 化合物AS2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215 kJ。 该反应的热化学方程式为_________________________________ 。
(5)已知298K时,Fe(s) + O2(g) == FeO(s) ; ΔH= -272.0 kJ · mol-1
O2(g) == FeO(s) ; ΔH= -272.0 kJ · mol-1
2D(s) + O2(g) == D2O3(s) ; ΔH= -1675.7 kJ · mol-1
O2(g) == D2O3(s) ; ΔH= -1675.7 kJ · mol-1
写出D单质和FeO反应的热化学方程式是_____________________________________ 。

(1)A与氢元素可以形成很多化合物,在这些化合物中都含有
(2)元素A形成的最简单氢化物和氧气在KOH溶液中可构成燃料电池,该电池工作时
(3)D的最高价氧化物的水化物与NaOH反应的
(4)由A与S形成的
(5)已知298K时,Fe(s) +
 O2(g) == FeO(s) ; ΔH= -272.0 kJ · mol-1
O2(g) == FeO(s) ; ΔH= -272.0 kJ · mol-12D(s) +
 O2(g) == D2O3(s) ; ΔH= -1675.7 kJ · mol-1
O2(g) == D2O3(s) ; ΔH= -1675.7 kJ · mol-1写出D单质和FeO反应的热化学方程式是
您最近一年使用:0次



