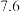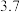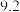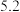钴酸锂( )电池是一种应用广泛的新型电源,放电时的电池反应方程式为
)电池是一种应用广泛的新型电源,放电时的电池反应方程式为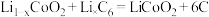 。电池正极材料有
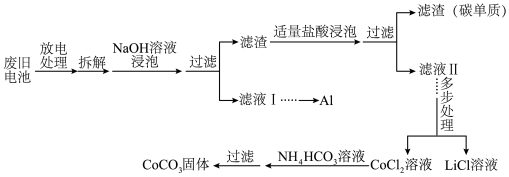
。电池正极材料有 和少量的铝、铁、碳等单质。可利用以下工艺流程回收正极材料中的某些金属资源(还原性:
和少量的铝、铁、碳等单质。可利用以下工艺流程回收正极材料中的某些金属资源(还原性: )。
)。
回答下列问题:
(1)基态Co原子的价层电子排布式为___________ 。
(2)“放电处理”时正极的电极反应式为___________ 。
(3)“放电处理”除了考虑“拆解”时的安全因素外,还有利于___________ 。
(4)NaOH溶液浸泡时发生的主要反应的离子方程式为___________ 。
(5)“适量盐酸浸泡”时, 与盐酸反应的化学方程式为
与盐酸反应的化学方程式为___________ 。滤液Ⅱ中的溶质除HCl、LiCl、 外还有
外还有___________ (填化学式)。
(6)加入“ 溶液”发生反应的离子方程式为
溶液”发生反应的离子方程式为___________ 。
 )电池是一种应用广泛的新型电源,放电时的电池反应方程式为
)电池是一种应用广泛的新型电源,放电时的电池反应方程式为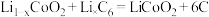 。电池正极材料有
。电池正极材料有 和少量的铝、铁、碳等单质。可利用以下工艺流程回收正极材料中的某些金属资源(还原性:
和少量的铝、铁、碳等单质。可利用以下工艺流程回收正极材料中的某些金属资源(还原性: )。
)。
回答下列问题:
(1)基态Co原子的价层电子排布式为
(2)“放电处理”时正极的电极反应式为
(3)“放电处理”除了考虑“拆解”时的安全因素外,还有利于
(4)NaOH溶液浸泡时发生的主要反应的离子方程式为
(5)“适量盐酸浸泡”时,
 与盐酸反应的化学方程式为
与盐酸反应的化学方程式为 外还有
外还有(6)加入“
 溶液”发生反应的离子方程式为
溶液”发生反应的离子方程式为
23-24高三上·河南濮阳·期中 查看更多[3]
更新时间:2024-01-17 22:30:31
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】无水四氯化锡( )常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点为232℃)与
)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点为232℃)与 反应制备
反应制备 ,装置如图所示。
,装置如图所示。
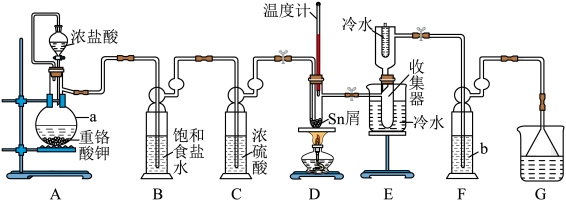
已知:① 在潮湿空气中极易水解生成
在潮湿空气中极易水解生成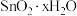
②各物质熔沸点:
(1)仪器a的名称为___________ ,重铬酸钾( )与浓盐酸反应时,还原产物是
)与浓盐酸反应时,还原产物是 ,装置A中发生反应的离子方程式为
,装置A中发生反应的离子方程式为___________ 。
(2)F装置中试剂b为___________ ,其作用是___________ 。
(3)锡屑中含铜杂质导致D中产生 ,但不影响E中产品的纯度,原因是
,但不影响E中产品的纯度,原因是___________ 。
(4)E所得产品 中常溶有少量
中常溶有少量 杂质,可用
杂质,可用___________ 方法提纯。
(5)制得的 产品中常含有
产品中常含有 ,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的
,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的 溶液,发生反应:
溶液,发生反应: ,再用
,再用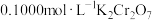 标准溶液滴定生成的
标准溶液滴定生成的 ,此时还原产物为
,此时还原产物为 ,消耗标准溶液20.00mL,则
,消耗标准溶液20.00mL,则 产品的纯度为
产品的纯度为___________ 。
 )常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点为232℃)与
)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点为232℃)与 反应制备
反应制备 ,装置如图所示。
,装置如图所示。
已知:①
 在潮湿空气中极易水解生成
在潮湿空气中极易水解生成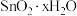
②各物质熔沸点:
| 物质 | 熔点/℃ | 沸点/℃ |
 | 246 | 652 |
 | -33 | 114 |
 | 620 | 993 |
 )与浓盐酸反应时,还原产物是
)与浓盐酸反应时,还原产物是 ,装置A中发生反应的离子方程式为
,装置A中发生反应的离子方程式为(2)F装置中试剂b为
(3)锡屑中含铜杂质导致D中产生
 ,但不影响E中产品的纯度,原因是
,但不影响E中产品的纯度,原因是(4)E所得产品
 中常溶有少量
中常溶有少量 杂质,可用
杂质,可用(5)制得的
 产品中常含有
产品中常含有 ,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的
,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的 溶液,发生反应:
溶液,发生反应: ,再用
,再用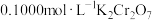 标准溶液滴定生成的
标准溶液滴定生成的 ,此时还原产物为
,此时还原产物为 ,消耗标准溶液20.00mL,则
,消耗标准溶液20.00mL,则 产品的纯度为
产品的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】亚氯酸钠(NaClO2)是一种应用广泛的高效氧化型漂白剂。以下是某小组模拟工业制法利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置:
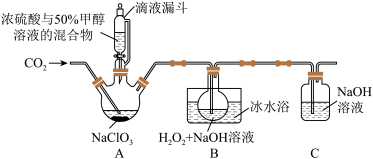
已知:①硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
②ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
回答下列问题:
(1)实验前用浓硫酸与50%甲醇溶液配制混合溶液的操作是:______________________ 。
(2)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是_________ 。
(3)装置A中,若氧化产物为CO2,则氧化剂与还原剂别的物质的量之比为____________ 。
(4)装置B中生成NaClO2的化学方程式是_________________________ 。
(5)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2 =2I-+
=2I-+ ),以淀粉溶液做指示剂,判断达到滴定终点时的现象为:
),以淀粉溶液做指示剂,判断达到滴定终点时的现象为:___________________________ 。重复滴定3次,测得Na2S2O3标准液平均用量为18.00mL,则该样品中NaClO2的质量分数为____________ 。

已知:①硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
②ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
回答下列问题:
(1)实验前用浓硫酸与50%甲醇溶液配制混合溶液的操作是:
(2)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是
(3)装置A中,若氧化产物为CO2,则氧化剂与还原剂别的物质的量之比为
(4)装置B中生成NaClO2的化学方程式是
(5)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2
 =2I-+
=2I-+ ),以淀粉溶液做指示剂,判断达到滴定终点时的现象为:
),以淀粉溶液做指示剂,判断达到滴定终点时的现象为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】地球上的金属资源广泛地存在于地壳和海洋中,除金、银等少数很不活泼的金属主要以单质形式存在外,其余都以化合物的形式存在。高铁酸钾为紫色固体,极易溶于水,微溶于浓KOH溶液,难溶于有机溶剂;在酸性、中性溶液中易分解放出 ,在0∼5°C.强碱性溶液中较稳定。某兴趣小组利用如图所示装置(夹持、加热等装置略)制取
,在0∼5°C.强碱性溶液中较稳定。某兴趣小组利用如图所示装置(夹持、加热等装置略)制取 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:
Ⅰ.制取

(1)仪器a的名称是___________ ,装置D的作用是___________ (用离子方程式表示)。
(2)装置C中反应的化学方程式为___________ 。
(3)装置C中反应为放热反应,控制反应温度在0~5℃的方法是___________ 。
Ⅱ.探究 性质。取装置C中紫色溶液,加入足量稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
性质。取装置C中紫色溶液,加入足量稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。
。
(4) 生成的可能原因:①
生成的可能原因:① 氧化
氧化 ;②
;②___________ (用离子方程式表示)。
为探究 产生的原因,设计以下方案:
产生的原因,设计以下方案:
由方案甲中溶液变红知溶液a中含有___________ (填离子符号),但该离子不一定是 将
将 氧化所得,还可能由
氧化所得,还可能由___________ 产生(用离子方程式表示)。方案乙可证明酸性条件下 氧化
氧化 产生
产生 。
。
(5)某铁的氧化物( )1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL
)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL  ,恰好将
,恰好将 完全氧化,x值为
完全氧化,x值为___________ 。(需在答题纸上写出计算过程)
 ,在0∼5°C.强碱性溶液中较稳定。某兴趣小组利用如图所示装置(夹持、加热等装置略)制取
,在0∼5°C.强碱性溶液中较稳定。某兴趣小组利用如图所示装置(夹持、加热等装置略)制取 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:Ⅰ.制取


(1)仪器a的名称是
(2)装置C中反应的化学方程式为
(3)装置C中反应为放热反应,控制反应温度在0~5℃的方法是
Ⅱ.探究
 性质。取装置C中紫色溶液,加入足量稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
性质。取装置C中紫色溶液,加入足量稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。
。(4)
 生成的可能原因:①
生成的可能原因:① 氧化
氧化 ;②
;②为探究
 产生的原因,设计以下方案:
产生的原因,设计以下方案:| 方案甲 | 取少量溶液a,滴加KSCN溶液至过量,溶液量红色 |
| 方案乙 | 用KOH浓溶液充分洗涤C中所得晶体,再用KOH稀溶液将 溶解,得紫色溶液b.取少量溶液b,滴加盐酸,有 溶解,得紫色溶液b.取少量溶液b,滴加盐酸,有 产生 产生 |
 将
将 氧化所得,还可能由
氧化所得,还可能由 氧化
氧化 产生
产生 。
。(5)某铁的氧化物(
 )1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL
)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL  ,恰好将
,恰好将 完全氧化,x值为
完全氧化,x值为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。 可转化成有机物实现碳循环。在体积为
可转化成有机物实现碳循环。在体积为 的密闭容器中,充入
的密闭容器中,充入 和
和 ,一定条件下反应:
,一定条件下反应: ,此反应为放热反应,测得
,此反应为放热反应,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
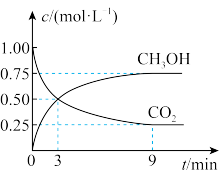
(1)从 到
到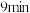 ,
,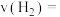
_______  。
。
(2)某同学记录了1~12分钟内 物质的量的变化,实验记录如下(累计值):
物质的量的变化,实验记录如下(累计值):
反应速率变化最大的时间段为_______ ;原因是_______ ;
A.0~1 B.1~3 C.3~6 D.6~9
(3)能说明上述反应达到平衡状态的是_______(填编号);
(4) 与
与 反应可制备
反应可制备 ,
, 可作为燃料使用,用
可作为燃料使用,用 和
和 组成的质子交换膜燃料电池的结构示意图如下:
组成的质子交换膜燃料电池的结构示意图如下:

电池总反应为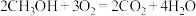 ,则c电极是
,则c电极是_______ (填“正极”或“负极),c电极的反应方程式为_______ 。若线路中转移 电子,则上述
电子,则上述 燃料电池,消耗的
燃料电池,消耗的 在标准状况下的体积为
在标准状况下的体积为_______ L。
 可转化成有机物实现碳循环。在体积为
可转化成有机物实现碳循环。在体积为 的密闭容器中,充入
的密闭容器中,充入 和
和 ,一定条件下反应:
,一定条件下反应: ,此反应为放热反应,测得
,此反应为放热反应,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
(1)从
 到
到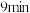 ,
,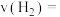
 。
。(2)某同学记录了1~12分钟内
 物质的量的变化,实验记录如下(累计值):
物质的量的变化,实验记录如下(累计值):时间( ) ) | 1 | 3 | 6 | 9 | 12 |
 物质的量( 物质的量( ) ) | 0.10 | 0.50 | 0.70 | 0.75 | 0.75 |
A.0~1 B.1~3 C.3~6 D.6~9
(3)能说明上述反应达到平衡状态的是_______(填编号);
A.反应中 与 与 的物质的量浓度之比为1∶1 的物质的量浓度之比为1∶1 |
| B.混合气体的密度不随时间的变化而变化 |
C.单位时间内消耗 ,同时生成 ,同时生成 |
D. 的体积分数在混合气体中保持不变 的体积分数在混合气体中保持不变 |
(4)
 与
与 反应可制备
反应可制备 ,
, 可作为燃料使用,用
可作为燃料使用,用 和
和 组成的质子交换膜燃料电池的结构示意图如下:
组成的质子交换膜燃料电池的结构示意图如下:
电池总反应为
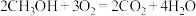 ,则c电极是
,则c电极是 电子,则上述
电子,则上述 燃料电池,消耗的
燃料电池,消耗的 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某小组研究溶液中 与
与 、
、 的反应。
的反应。
资料: 在溶液中呈棕色。
在溶液中呈棕色。
(1)研究现象 中的黄色溶液。
中的黄色溶液。
①用_______ 溶液检出溶液中含有 。
。
②甲认为是 氧化了溶液中的
氧化了溶液中的 。乙认为
。乙认为 不是主要原因,理由是
不是主要原因,理由是_______ 。
③进行实验II,装置如下图所示。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为 。产生
。产生 的电极反应式是
的电极反应式是_______ 。
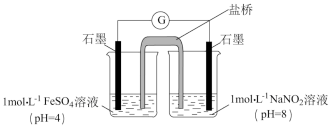
(2)研究现象 中的棕色溶液。
中的棕色溶液。
综合实验I和实验II,提出假设:现象 中溶液变为棕色可能是
中溶液变为棕色可能是 与溶液中的
与溶液中的 或
或 发生了反应。进行实验III,证实溶液呈棕色只是因为
发生了反应。进行实验III,证实溶液呈棕色只是因为 与
与 发生了反应。实验III的操作和现象是
发生了反应。实验III的操作和现象是_____ 。
(3)研究酸性条件下,溶液中 与
与 、
、 的反应。
的反应。
①i中溶液变为棕色的离子方程式是_______ 和_______ 。
②iii中出现棕色的原因是_______ 。
实验结论:本实验条件下,溶液中 、
、 的氧化性与溶液的酸碱性等有关。
的氧化性与溶液的酸碱性等有关。
 与
与 、
、 的反应。
的反应。| 实验I | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 |  溶液 溶液(  ) ) |  溶液 溶液(  ) ) | a。滴入1滴 溶液,溶液变黄色,继续滴加,溶液变为棕色。 溶液,溶液变黄色,继续滴加,溶液变为棕色。 后,无明显变化 后,无明显变化 |
 溶液(加 溶液(加 溶液至 溶液至 ) ) | b。持续滴加 溶液,无明显变化 溶液,无明显变化 | ||
 在溶液中呈棕色。
在溶液中呈棕色。(1)研究现象
 中的黄色溶液。
中的黄色溶液。①用
 。
。②甲认为是
 氧化了溶液中的
氧化了溶液中的 。乙认为
。乙认为 不是主要原因,理由是
不是主要原因,理由是③进行实验II,装置如下图所示。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为
 。产生
。产生 的电极反应式是
的电极反应式是
(2)研究现象
 中的棕色溶液。
中的棕色溶液。综合实验I和实验II,提出假设:现象
 中溶液变为棕色可能是
中溶液变为棕色可能是 与溶液中的
与溶液中的 或
或 发生了反应。进行实验III,证实溶液呈棕色只是因为
发生了反应。进行实验III,证实溶液呈棕色只是因为 与
与 发生了反应。实验III的操作和现象是
发生了反应。实验III的操作和现象是(3)研究酸性条件下,溶液中
 与
与 、
、 的反应。
的反应。| 序号 | 操作 | 现象 |
| i | 取 的 的 溶液,加醋酸至 溶液,加醋酸至 ,加入 ,加入 的 的 溶液 溶液 | 溶液立即变为棕色 |
| ii | 取 的 的 溶液,加醋酸至 溶液,加醋酸至 ,加入 ,加入 的 的 溶液 溶液 | 无明显变化 |
| iii | 分别取 的 的 溶液与 溶液与 的 的 溶液,混合,小心加入 溶液,混合,小心加入 浓硫酸 浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
②iii中出现棕色的原因是
实验结论:本实验条件下,溶液中
 、
、 的氧化性与溶液的酸碱性等有关。
的氧化性与溶液的酸碱性等有关。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】研究氮的固定具有重要意义。
(1)雷雨天气中发生自然固氮后,氮元素转化为________而存在于土壤中。处于研究阶段的化学固定
新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H K ①
已知:N2(g)+3H2(g)=2NH3(g) △H1=-92.4kJ·mol-1 K1 ②
2H2(g) +O2(g) =2H2O(l) △H2=-571.6kJ·mol-1 K2 ③
则△H =________;K=___________(用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3h,实验数据见下表:
下列能说明反应①达到平衡状态的是_____(填字母)。
a.NH3和O2的物质的量之比为4∶3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为___________;第四组反应中以NH3表示的反应速率是__________________,与前三组相比,NH3生成量最小的原因可能是_________________。
(3)美国化学家发明一种新型催化剂可以在常温下合成氨,将其附着在电池的正负极上实现氮的电化学固定,其装置示意图如下:
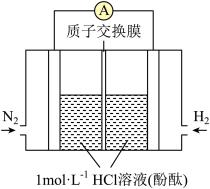
则开始阶段正极反应式为_____________;忽略电解过程中溶液体积变化,当电池中阴极区溶液pH = 7时,溶液中NH3·H2O的浓度为___________( Kb=2×10-5mol·L-1);当电池中阴极区呈红色时,溶液中离子浓度由大到小的顺序为_________________。
(1)雷雨天气中发生自然固氮后,氮元素转化为________而存在于土壤中。处于研究阶段的化学固定
新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H K ①
已知:N2(g)+3H2(g)=2NH3(g) △H1=-92.4kJ·mol-1 K1 ②
2H2(g) +O2(g) =2H2O(l) △H2=-571.6kJ·mol-1 K2 ③
则△H =________;K=___________(用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3h,实验数据见下表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
a.NH3和O2的物质的量之比为4∶3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为___________;第四组反应中以NH3表示的反应速率是__________________,与前三组相比,NH3生成量最小的原因可能是_________________。
(3)美国化学家发明一种新型催化剂可以在常温下合成氨,将其附着在电池的正负极上实现氮的电化学固定,其装置示意图如下:

则开始阶段正极反应式为_____________;忽略电解过程中溶液体积变化,当电池中阴极区溶液pH = 7时,溶液中NH3·H2O的浓度为___________( Kb=2×10-5mol·L-1);当电池中阴极区呈红色时,溶液中离子浓度由大到小的顺序为_________________。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】一种以镉废渣(含CdO及少量ZnO、CuO、MnO、FeO杂质)为原料制备镉的工艺流程如下:
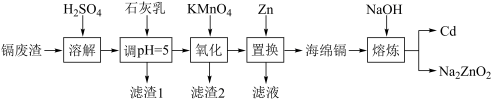
(1)基态Zn2+核外电子排布式为___________ 。
(2)“滤渣2”的主要成分是MnO2、Fe(OH)3。“氧化”过程中KMnO4与Mn2+发生反应的离子方程式为___________ 。
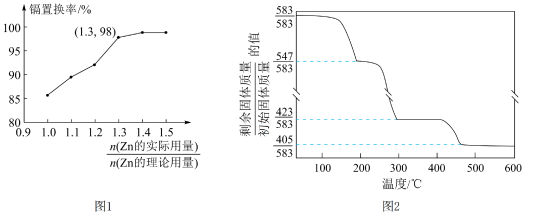
(3)“置换”过程中镉置换率与(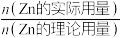 )的关系如图1所示,其中Zn的理论用量以溶液中
)的关系如图1所示,其中Zn的理论用量以溶液中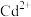 的物质的量为依据。实际生产中
的物质的量为依据。实际生产中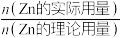 最佳比值为1.3,不宜超过该比值的原因是
最佳比值为1.3,不宜超过该比值的原因是___________ 。
(4)向“置换”所得滤液中加 溶液,经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[化学式为
溶液,经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[化学式为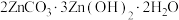 ,摩尔质量为583g/mol]
,摩尔质量为583g/mol]
①碱式碳酸锌高温下完全分解至质量不变的反应方程式为___________ 。
②碱式碳酸锌加热升温过程中固体的质量变化如图2所示。350℃时剩余固体中已不含碳元素,则350℃时剩余固体的成分为___________ 。(填化学式)

(1)基态Zn2+核外电子排布式为
(2)“滤渣2”的主要成分是MnO2、Fe(OH)3。“氧化”过程中KMnO4与Mn2+发生反应的离子方程式为
(3)“置换”过程中镉置换率与(
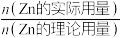 )的关系如图1所示,其中Zn的理论用量以溶液中
)的关系如图1所示,其中Zn的理论用量以溶液中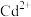 的物质的量为依据。实际生产中
的物质的量为依据。实际生产中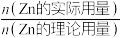 最佳比值为1.3,不宜超过该比值的原因是
最佳比值为1.3,不宜超过该比值的原因是
(4)向“置换”所得滤液中加
 溶液,经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[化学式为
溶液,经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[化学式为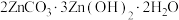 ,摩尔质量为583g/mol]
,摩尔质量为583g/mol]①碱式碳酸锌高温下完全分解至质量不变的反应方程式为
②碱式碳酸锌加热升温过程中固体的质量变化如图2所示。350℃时剩余固体中已不含碳元素,则350℃时剩余固体的成分为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】E、G、M、Q、T是五种原子序数依次增大的前四周期元素。E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2−具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)T元素原子的价电子排布式是___ 。
(2)E、G、M三种元素的第一电离能由大到小的顺序为___ (用元素符号表示),其原因为___ 。
(3)G的最简单氢化物的分子立体构型名称为___ ,M的最简单氢化物的分子中中心原子的杂化类型为___ 。M和Q的最简单氢化物的沸点大小顺序为___ (写化学式)。
(4)TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如图所示,该晶体的密度为pg·cm−3。如果TQ的摩尔质量为Mg·mol−1,阿伏加 德罗常数为NAmol−1,则a、b之间的距离为___ cm。
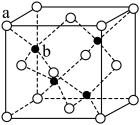
(1)T元素原子的价电子排布式是
(2)E、G、M三种元素的第一电离能由大到小的顺序为
(3)G的最简单氢化物的分子立体构型名称为
(4)TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如图所示,该晶体的密度为pg·cm−3。如果TQ的摩尔质量为Mg·mol−1,阿伏加 德罗常数为NAmol−1,则a、b之间的距离为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题:
(1)碳原子的核外电子排布式为_____ 。与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是_____ 。
(2)A、B均为短周期金属元素。依据表中数据,写出B原子的电子排布式:_____ 。
(3)表中是第三周期部分元素的电离能[单位:eV(电子伏特)]数据。
下列说法正确的是______ (填字母)。
(4)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
锰元素位于第四周期第VIIB族。请写出基态Mn2+的价电子排布式:______ 。
(1)碳原子的核外电子排布式为
(2)A、B均为短周期金属元素。依据表中数据,写出B原子的电子排布式:
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A.甲的金属性比乙强 | B.乙的化合价为+1价 |
| C.丙不可能为非金属元素 | D.丁一定为金属元素 |
| 元素 | Mn | Fe | |
| 电离能/(kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
您最近一年使用:0次
【推荐1】湿法炼锌具有能耗低,生成产品纯度高等特点,其主要原料为锌精矿(主要成分为硫化锌,还含有铁、钴、铜、镉、铅等元素的杂质),获得较纯锌锭的工艺流程如图:
(1)铜原子的价层电子排布图为_____ 。
(2)“酸浸”中滤渣主要成分为_____ 。
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:_____ 。
(4)“β—萘酚净化除钴”先是NaNO2把Co2+氧化成Co3+,并生成NO,Co3+与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出Co2+被氧化的离子方程式:_____ 。
(5)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。_____ (x和y用具体数字表示)。
②若Li2S的晶胞参数为ann,则EF间的距离为_____ nm。
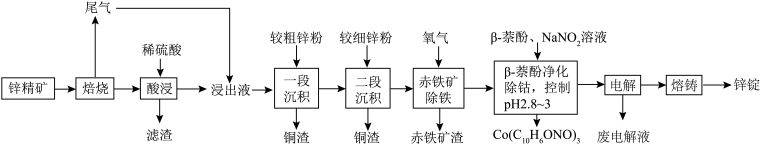
(1)铜原子的价层电子排布图为
(2)“酸浸”中滤渣主要成分为
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:
(4)“β—萘酚净化除钴”先是NaNO2把Co2+氧化成Co3+,并生成NO,Co3+与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出Co2+被氧化的离子方程式:
(5)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
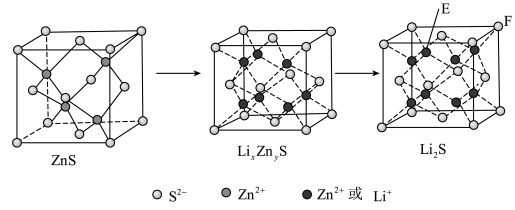
②若Li2S的晶胞参数为ann,则EF间的距离为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】[Co(NH3)6]Cl3(三氯六氨合钴)是一种重要的化工产品,常用于合成其它Co(II)配合物。以下是一种制备三氯六氨合钴的实验方法,回答下列问题:
氯化钴的制备
已知氯化钴(CoCl2)易潮解,可用高熔点金属钴与氯气反应制取氯化钴。实验室提供下列装置进行组合(连接用橡胶管省略):
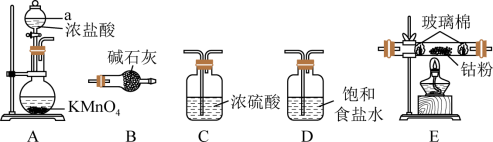
(1)仪器a的名称是______ ,用图中的装置组合制备氯化钴,连接顺序为______ (以上每个装置只能用一次)。
A→______→______→______→______
(2)正确连接好装置,______ ,装药品,先______ ,待后______ ,再点燃E处酒精灯进行实验。
(3)装置E中发生的化学方程式为______ ,装置A中发生的离子方程式为______ 。
(4)用正确的连接装置进行实验,B的作用是______ ;C的作用是______ ;D的作用是______ 。
(5)用正确的连接装置进行实验,此装置的缺点是______ 。
氯化钴的制备
已知氯化钴(CoCl2)易潮解,可用高熔点金属钴与氯气反应制取氯化钴。实验室提供下列装置进行组合(连接用橡胶管省略):

(1)仪器a的名称是
A→______→______→______→______
(2)正确连接好装置,
(3)装置E中发生的化学方程式为
(4)用正确的连接装置进行实验,B的作用是
(5)用正确的连接装置进行实验,此装置的缺点是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
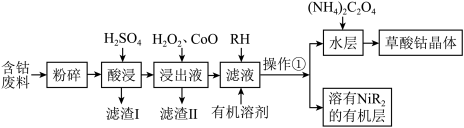
【推荐3】草酸钴可用于指示剂和催化剂的制备。用含钴废料(主要成分为 ,含有一定量的
,含有一定量的 、
、 、
、 、
、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的流程如下:
)的流程如下:
已知:①草酸钴晶体难溶于水。
②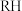 为有机物(难电离)、
为有机物(难电离)、 代表金属离子,
代表金属离子, 。
。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的 见下表:
见下表:
④滤液中 元素以
元素以 形式存在。
形式存在。
回答下列问题:
(1) 是常用的氧化剂,
是常用的氧化剂, 的电子式为
的电子式为______ 。
(2)“浸出液”中加入 后发生反应的离子方程式为
后发生反应的离子方程式为______ 。
(3)加入氧化钴调节溶液的 ,调节的
,调节的 范围是
范围是______ ,滤渣Ⅱ的主要成分是______ 。
(4)操作①在实验室所用的仪器为____________ 。
(5)可向操作①后溶有 的有机层中加入
的有机层中加入______ (反萃取剂)使 从有机相返回水相,实现金属回收利用。
从有机相返回水相,实现金属回收利用。
(6)若先将 转化为
转化为 ,再利用反应
,再利用反应 ,却不能实现
,却不能实现 转化为
转化为 ,请说明理由:
,请说明理由:____________ 。[ ,
, ]
]
 ,含有一定量的
,含有一定量的 、
、 、
、 、
、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的流程如下:
)的流程如下:
已知:①草酸钴晶体难溶于水。
②
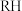 为有机物(难电离)、
为有机物(难电离)、 代表金属离子,
代表金属离子, 。
。③流程中部分阳离子以氢氧化物形式沉淀时溶液的
 见下表:
见下表:沉淀物 |
|
|
|
|
|
开始沉淀 |
|
|
|
|
|
完全沉淀 |
|
|
|
|
|
 元素以
元素以 形式存在。
形式存在。回答下列问题:
(1)
 是常用的氧化剂,
是常用的氧化剂, 的电子式为
的电子式为(2)“浸出液”中加入
 后发生反应的离子方程式为
后发生反应的离子方程式为(3)加入氧化钴调节溶液的
 ,调节的
,调节的 范围是
范围是(4)操作①在实验室所用的仪器为
(5)可向操作①后溶有
 的有机层中加入
的有机层中加入 从有机相返回水相,实现金属回收利用。
从有机相返回水相,实现金属回收利用。(6)若先将
 转化为
转化为 ,再利用反应
,再利用反应 ,却不能实现
,却不能实现 转化为
转化为 ,请说明理由:
,请说明理由: ,
, ]
]
您最近一年使用:0次