名校
解题方法
1 . 现有M、N、P、E四种金属,已知:①氧化性强弱顺序为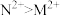 ;②E、P用导线连接放入稀硫酸中,P表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为
;②E、P用导线连接放入稀硫酸中,P表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为 ,
, 。则这四种金属的还原性由强到弱的顺序是
。则这四种金属的还原性由强到弱的顺序是
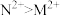 ;②E、P用导线连接放入稀硫酸中,P表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为
;②E、P用导线连接放入稀硫酸中,P表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为 ,
, 。则这四种金属的还原性由强到弱的顺序是
。则这四种金属的还原性由强到弱的顺序是A.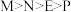 | B. |
C. | D.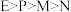 |
您最近一年使用:0次
2022-09-11更新
|
173次组卷
|
2卷引用:甘肃省白银市会宁县2021-2022学年高二上学期期末质量检测化学试题
2 . 电解工作原理的实际应用非常广泛。
(1)电解精炼银时,粗银作___________ ,阴极反应为___________ 。
(2)工业上为了处理含有Cr2O 的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。
的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。
(3)某同学设计了如图装置进行以下电化学实验。
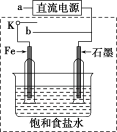
①当开关K与a连接时,两极均有气泡产生,则阴极为___________ 电极。
②一段时间后,使开关K与a断开,与b连接时,虚线框内的装置可称为___________ 。请写出此时Fe电极上的电极反应___________ 。
(4)1 L某溶液中含有的离子如下表:
用惰性电极电解该溶液,当电路中有3 mol e-通过时(忽略电解时溶液体积变化及电极产物可能存在的溶解现象),下列说法正确的是___________(填字母)。
(1)电解精炼银时,粗银作
(2)工业上为了处理含有Cr2O
 的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。
的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。| A.阳极反应:Fe-2e-=Fe2+ | B.阴极反应:2H++2e-=H2↑ |
| C.在电解过程中工业废水由酸性变为碱性 | D.可以将铁电极改为石墨电极 |

①当开关K与a连接时,两极均有气泡产生,则阴极为
②一段时间后,使开关K与a断开,与b连接时,虚线框内的装置可称为
(4)1 L某溶液中含有的离子如下表:
| 离子 | Cu2+ | Al3+ | NO | Cl- |
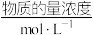 | 1 | 1 | a | 1 |
| A.电解后溶液呈酸性 | B.a=3 |
| C.阳极生成1.5 mol Cl2 | D.阴极析出的金属是铜与铝 |
您最近一年使用:0次
3 . 如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____ (填“正极”或“负极”),通氢气一极的电极反应式为_________________ ;
(2)铁电极为_______ (填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________ 。
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为______ g;
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:
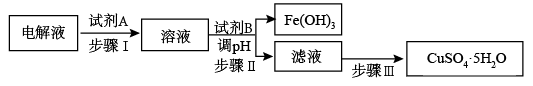
已知:几种金属阳离子开始沉淀和沉淀完全的pH:
①步骤I中加入试剂A的目的是_____________________________ ,试剂A应选择______ (填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因_____________________________________________________ ;
②步骤II中试剂B为_________ ,调节pH的范围是___________ ;
③步骤III的操作是加热浓缩、_______ 、___________ 。

(1)通入氧气的电极为
(2)铁电极为
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:

已知:几种金属阳离子开始沉淀和沉淀完全的pH:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因
②步骤II中试剂B为
③步骤III的操作是加热浓缩、
您最近一年使用:0次
2018-01-27更新
|
689次组卷
|
4卷引用:河北省张家口市2017-2018学年高二上学期期末考试化学试题
4 . “乌铜走银”是云南特有的中国传统铜制工艺品。它以铜为胎,在胎上雕刻各种花纹图案,然后将熔化的银(或金)水填入花纹图案中,完成制作后需经常用汗湿的手摩擦器物,使铜胎变为乌黑,透出银(或金)纹图案。下列有关该工艺的说法正确的是
| A.用铜和少量的贵金属熔炼成的铜胎仍具有金属性能 |
| B.熔化银(或金)时没有破坏金属键 |
| C.铜胎变乌黑是汗液中存在氧化性物质使铜变成了氧化铜 |
| D.“乌铜走银”工艺品最终呈现出黑白(或黑黄)分明的装饰效果 |
您最近一年使用:0次
名校
5 . i.写出下列物质在水溶液中的电离方程式:
(1) :
:___________ 。
(2)磷酸的分步电离:___________ 。
ii.向 氨水中滴加
氨水中滴加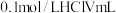 ,回答下列问题(填“>”“<”或“>”)。
,回答下列问题(填“>”“<”或“>”)。
(3)当 时,
时,
___________ 20。
(4)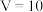 时,溶质是
时,溶质是 和
和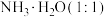 ,溶液显碱性,
,溶液显碱性,
_______ 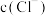 。
。
iii.利用反应 可得到清洁能源
可得到清洁能源 。
。
(5)该反应化学平衡常数表达式
___________ 。
(6)该反应的平衡常数随温度的变化如下表:
从上表可以推断:此反应是___________ (填“吸热”或“放热”)反应。
ⅳ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。
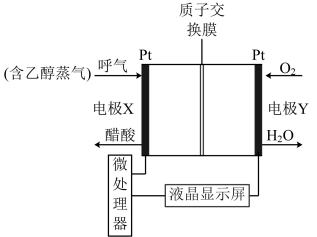
(7)电极 是该电池的
是该电池的___________ (填“正”或“负”)极。
(8)负极的电极反应式为___________ ,正极的电极反应式为___________ 。
(9)电池工作时, 通过交换膜
通过交换膜___________ (填“从左向右”或“从右向左”)迁移。
(1)
 :
:(2)磷酸的分步电离:
ii.向
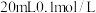 氨水中滴加
氨水中滴加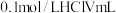 ,回答下列问题(填“>”“<”或“>”)。
,回答下列问题(填“>”“<”或“>”)。(3)当
 时,
时,
(4)
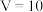 时,溶质是
时,溶质是 和
和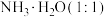 ,溶液显碱性,
,溶液显碱性,
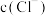 。
。iii.利用反应
 可得到清洁能源
可得到清洁能源 。
。(5)该反应化学平衡常数表达式

(6)该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数 | 10 | 9 | 1 | 0.6 |
ⅳ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

(7)电极
 是该电池的
是该电池的(8)负极的电极反应式为
(9)电池工作时,
 通过交换膜
通过交换膜
您最近一年使用:0次
6 . 广泛使用的消毒剂
Ⅰ.消毒剂可用于餐饮、衣物、环境消毒等,是生产生活中常用物品。常见的“84”消毒液、O3等都有较强的杀菌效果,可杀灭很多常见病毒。
(1)“84”消毒液的主要成分为NaClO,该消毒液___________。(双选)
(2)化学电池应用广泛,某电池企业通过回收废旧电池生产消毒液。
①如图Cu-Zn原电池中,导线中电子流向___________ 片(填 “Zn”或“Cu”)。Cu片上发生___________ 反应(填 “氧化”或“还原”)。
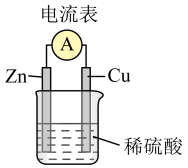
②若将铜片换成铁片,电流方向___________ 改变(填 “会”或“不会”)。
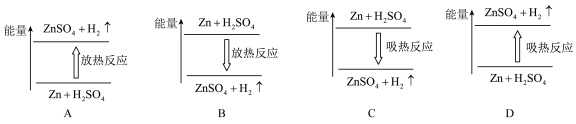
(3)若断开电路,则该反应中能量变化示意图正确的是___________ 。
Ⅱ.O3是一种清洁消毒剂,常温常压下在水溶液中发生的反应如下:2O3 3O2放热反应,下表为一定条件下,O3起始浓度为0.0216 mol•L-1时,O3浓度减少一半所需的时间。
3O2放热反应,下表为一定条件下,O3起始浓度为0.0216 mol•L-1时,O3浓度减少一半所需的时间。
(4)30°C、pH=5.0时,O3的平均反应速率为___________ 。
(5)若反应达平衡后降温,则平衡向___________ 移动,正反应速率___________ (填“增大”“减小”或“不变”)。
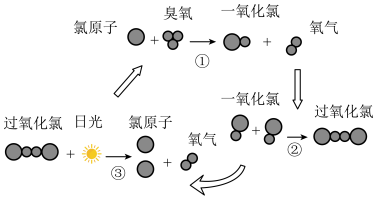
(6)大气中臭氧层能吸收和阻挡大部分紫外线进入地球。但氯原子能破坏臭氧层,其破坏过程如图所示,下列说法错误的是___________
(7)一些含硫物质也能做消毒剂。硫位于元素周期表中第___________ 周期,第___________ 族。用一个化学事实比较Cl和S的非金属性强弱___________ 。
Ⅰ.消毒剂可用于餐饮、衣物、环境消毒等,是生产生活中常用物品。常见的“84”消毒液、O3等都有较强的杀菌效果,可杀灭很多常见病毒。
(1)“84”消毒液的主要成分为NaClO,该消毒液___________。(双选)
| A.电离方程式:NaClO=Na+ + Cl- + O2- |
| B.和稀盐酸反应的产物无漂白性 |
| C.属于强电解质 |
| D.具有强氧化性 |
①如图Cu-Zn原电池中,导线中电子流向

②若将铜片换成铁片,电流方向
(3)若断开电路,则该反应中能量变化示意图正确的是

Ⅱ.O3是一种清洁消毒剂,常温常压下在水溶液中发生的反应如下:2O3
 3O2放热反应,下表为一定条件下,O3起始浓度为0.0216 mol•L-1时,O3浓度减少一半所需的时间。
3O2放热反应,下表为一定条件下,O3起始浓度为0.0216 mol•L-1时,O3浓度减少一半所需的时间。| pH t/min T/℃ | 3.0 | 4.0 | 5.0 |
| 20 | 301 | 231 | 169 |
| 30 | 158 | 108 | 54 |
| 50 | 35 | 26 | 15 |
(5)若反应达平衡后降温,则平衡向
(6)大气中臭氧层能吸收和阻挡大部分紫外线进入地球。但氯原子能破坏臭氧层,其破坏过程如图所示,下列说法错误的是___________

| A.反应中Cl作催化剂 |
| B.过氧化氯的分子式为:Cl2O2 |
| C.过氧化氯的结构式为:O-Cl-Cl-O |
| D.该过程中能量转化形式只有一种 |
您最近一年使用:0次
解题方法
7 . 肼( )是一种还原性较强的液体,在生物膜电极表面容易发生氧化反应,从而达到无污染净化高浓度酸性NO
)是一种还原性较强的液体,在生物膜电极表面容易发生氧化反应,从而达到无污染净化高浓度酸性NO 废水的目的,其装置如图所示。其中M为阴离子交换膜,N为阳离子交换膜。下列说法错误的是
废水的目的,其装置如图所示。其中M为阴离子交换膜,N为阳离子交换膜。下列说法错误的是

 )是一种还原性较强的液体,在生物膜电极表面容易发生氧化反应,从而达到无污染净化高浓度酸性NO
)是一种还原性较强的液体,在生物膜电极表面容易发生氧化反应,从而达到无污染净化高浓度酸性NO 废水的目的,其装置如图所示。其中M为阴离子交换膜,N为阳离子交换膜。下列说法错误的是
废水的目的,其装置如图所示。其中M为阴离子交换膜,N为阳离子交换膜。下列说法错误的是
| A.X为低浓度KOH溶液 |
B. 通过N自左向右做定向移动 通过N自左向右做定向移动 |
C.负极上的电极反应式为 |
D.电池放电时,正、负极产生的 的物质的量之比为1∶1 的物质的量之比为1∶1 |
您最近一年使用:0次
2021-12-21更新
|
868次组卷
|
8卷引用:安徽省亳州市2021-2022学年高二上学期期末考试化学试题
安徽省亳州市2021-2022学年高二上学期期末考试化学试题河北省保定市2021-2022学年高三上学期期末考试化学试题陕西省安康市2021-2022学年高三上学期期末检测化学试题青海省西宁市三县2021-2022学年高三上学期期末联考化学试题湖北省重点校联考2021-2022学年高三上学期12月月考化学试题(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)第34练 原电池-2023年高考化学一轮复习小题多维练(全国通用)陕西省安康市2022届高三第一次教学质量联考化学试题
8 . 已知 的氧化性大于
的氧化性大于 。根据如图所示装置可构成原电池(盐桥中装有含琼脂的饱和
。根据如图所示装置可构成原电池(盐桥中装有含琼脂的饱和 溶液),下列叙述错误的是
溶液),下列叙述错误的是
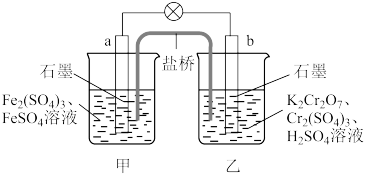
 的氧化性大于
的氧化性大于 。根据如图所示装置可构成原电池(盐桥中装有含琼脂的饱和
。根据如图所示装置可构成原电池(盐桥中装有含琼脂的饱和 溶液),下列叙述错误的是
溶液),下列叙述错误的是
| A.a为原电池的负极,b为原电池的正极 |
B.电池工作时,盐桥中的 移向甲烧杯 移向甲烧杯 |
C.a极的电极反应式为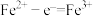 |
D.工作一段时间后,乙烧杯中溶液的 减小(忽略溶液体积变化) 减小(忽略溶液体积变化) |
您最近一年使用:0次
2022-10-27更新
|
358次组卷
|
2卷引用:上海市七宝中学2022-2023学年高二下学期期末考试化学试题
名校
9 . 甲醇燃料电池在碱性条件下的电池反应为2CH3OH+3O2+4OH-=2CO +6H2O。则下列有关说法不正确的是
+6H2O。则下列有关说法不正确的是
 +6H2O。则下列有关说法不正确的是
+6H2O。则下列有关说法不正确的是| A.O2在正极参与反应 | B.每转移0.6 mol电子,则消耗氧气的体积为3.36L |
C.负极反应为:CH3OH-6e-+8OH-=CO +6H2O +6H2O | D.该电池使用一段时间后溶液pH变小 |
您最近一年使用:0次
2022-03-20更新
|
254次组卷
|
2卷引用:宁夏青铜峡市高级中学2021-2022学年高二上学期期末考试化学试题
21-22高二上·福建福州·期中
解题方法
10 . 甲醇燃料电池在碱性条件下的电池反应为2CH3OH+3O2+4OH-=2CO +6H2O。则下列有关说法不正确的是
+6H2O。则下列有关说法不正确的是
 +6H2O。则下列有关说法不正确的是
+6H2O。则下列有关说法不正确的是| A.O2在正极参与反应 |
| B.该电池使用一段时间后溶液pH变小 |
C.负极反应为:CH3OH-6e-+8OH-=CO +6H2O +6H2O |
| D.每转移0.6 mol电子,则消耗氧气的体积为3.36L |
您最近一年使用:0次
2021-11-13更新
|
596次组卷
|
7卷引用:期末综合测试卷02-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)
(已下线)期末综合测试卷02-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)江西省宜春市丰城市2022-2023学年高二上学期1月期末化学试题福建省福州市八县(市)协作校2021-2022学年高二上学期期中联考化学试题(已下线)第25讲 化学电源(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)江西省南昌市知行中学2021-2022学年高二上学期12月月考化学试题江苏省宿迁市北大附属宿迁实验学校2022-2023学年高二上学期开学考试化学试题内蒙古自治区第二地质中学2023-2024学年高二上学期12月期中考试化学试题



