名校
解题方法
1 . 电化学原理在污染治理方面有着重要的作用。回答下列问题:
Ⅰ.煤在直接燃烧前要进行脱硫处理。采用电解法脱硫的基本原理如图所示:
已知:两电极为完全相同的惰性电极。______ 极。
(2)电解池工作时,观察到R电极上有无色气体产生,写出电极反应式______ 。
(3)电解过程中,混合溶液中的pH将______ (填“变大”、“变小”或“不变”),理由是______ 。
Ⅱ.电解还原法处理酸性含铬废水:以铁板做阴、阳极,电解含铬废水,示意如图:______ 。
(5)酸性废水中的 在该电池中发生的离子反应方程式为
在该电池中发生的离子反应方程式为______ 。
Ⅰ.煤在直接燃烧前要进行脱硫处理。采用电解法脱硫的基本原理如图所示:
已知:两电极为完全相同的惰性电极。

(2)电解池工作时,观察到R电极上有无色气体产生,写出电极反应式
(3)电解过程中,混合溶液中的pH将
Ⅱ.电解还原法处理酸性含铬废水:以铁板做阴、阳极,电解含铬废水,示意如图:

(5)酸性废水中的
 在该电池中发生的离子反应方程式为
在该电池中发生的离子反应方程式为
您最近一年使用:0次
解题方法
2 . 空气中 含量的控制和
含量的控制和 资源利用具有重要意义。
资源利用具有重要意义。
(1)燃煤烟气中 的捕集可通过如下所示的物质转化实现。
的捕集可通过如下所示的物质转化实现。 溶液与石灰乳反应的化学方程式为
溶液与石灰乳反应的化学方程式为______ .;
②载人航天器内,常用 固体而很少用
固体而很少用 固体吸收空气中的
固体吸收空气中的 ,其原因是
,其原因是______ ;
(2)电化学法还原二氧化碳,不仅能缓解温室效应还能得到乙烯。
①已知: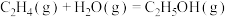
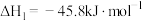

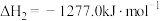
则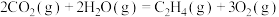

______ 
②电化学法还原二氧化碳为乙烯原理如图所示。______ 极(填“正”或“负”),阴极电极反应式为______ 。电路中转移0.2mol电子,理论上产生氧气______ L(标准状况)。
③铜作阴极能提高还原产物乙烯的选择性,水溶液中二氧化碳在铜表面还原为乙烯的机理如图所示(参与反应的水分子及其它生成微粒未画出)。下列有关说法不正确的是______ (填字母)。
B.二氧化碳还原产物有甲烷和乙烯
C.两个反应历程都是先加氢再除氧
D.两个反应历程都出现碳氧键的断裂与碳碳键的形成
 含量的控制和
含量的控制和 资源利用具有重要意义。
资源利用具有重要意义。(1)燃煤烟气中
 的捕集可通过如下所示的物质转化实现。
的捕集可通过如下所示的物质转化实现。
 溶液与石灰乳反应的化学方程式为
溶液与石灰乳反应的化学方程式为②载人航天器内,常用
 固体而很少用
固体而很少用 固体吸收空气中的
固体吸收空气中的 ,其原因是
,其原因是(2)电化学法还原二氧化碳,不仅能缓解温室效应还能得到乙烯。
①已知:
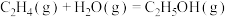
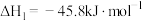

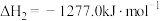
则
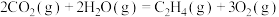


②电化学法还原二氧化碳为乙烯原理如图所示。

③铜作阴极能提高还原产物乙烯的选择性,水溶液中二氧化碳在铜表面还原为乙烯的机理如图所示(参与反应的水分子及其它生成微粒未画出)。下列有关说法不正确的是

B.二氧化碳还原产物有甲烷和乙烯
C.两个反应历程都是先加氢再除氧
D.两个反应历程都出现碳氧键的断裂与碳碳键的形成
您最近一年使用:0次
名校
解题方法
3 . 某小组从电极反应的角度研究物质氧化性和还原性的变化规律.
(1)实验室以 和浓盐酸为原料制取氯气的化学方程式为:
和浓盐酸为原料制取氯气的化学方程式为: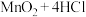 (浓)
(浓)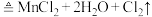 ,该反应的氧化产物是
,该反应的氧化产物是__________ ,将该反应设计成原电池,氧化反应为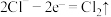 ,还原反应为
,还原反应为___________ 。
(2)当氯气不再逸出时,固液混合物A中仍存在 和盐酸.小组同学分析认为随着反应的进行、
和盐酸.小组同学分析认为随着反应的进行、 的氧化性和
的氧化性和 -的还原性均减弱,为此进行探究.
-的还原性均减弱,为此进行探究.
实验任务探究离子浓度对 氧化性的影响
氧化性的影响
提出猜想
猜想a:随 减小,
减小, 的氧化性减弱.
的氧化性减弱.
猜想b:随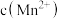 增大,
增大, 的氧化性减弱.
的氧化性减弱.
查阅资料电极电势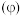 是表征氧化剂的氧化性(或还原剂的还原性)强弱的物理量.电极电势越大,氧化剂的氧化性越强;电极电势越小,还原剂的还原性越强.
是表征氧化剂的氧化性(或还原剂的还原性)强弱的物理量.电极电势越大,氧化剂的氧化性越强;电极电势越小,还原剂的还原性越强.
验证猜想用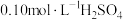 溶液、
溶液、 溶液和蒸馏水配制混合液(溶液总体积相同),将
溶液和蒸馏水配制混合液(溶液总体积相同),将 电极置于混合液中测定其电极电势
电极置于混合液中测定其电极电势 ,进行表中实验
,进行表中实验 ,数据记录。
,数据记录。
①根据实验1和2的结果,猜想a成立.补充数据:
___________ ,
__________ .
②根据实验1和3的结果,猜想b成立.判断依据是___________ (用电极电势关系表示).
探究结果固液混合物A中仍存在 和盐酸的原因是随着反应进行,溶液中
和盐酸的原因是随着反应进行,溶液中 减小、
减小、 增大,
增大, 氧化性减弱.
氧化性减弱.
③根据上述探究结果,小组同学作出如下推断:随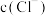 增大,
增大, 还原性增强.
还原性增强.
实验验证:在固液混合物A中加入____________ (填化学式)固体,加热.证明推断正确的实验现象是_____________ .
(3)根据电化学的相关知识,小组同学利用如图电解池装置,成功实现了铜与稀硫酸制氢气._____________ .
(1)实验室以
 和浓盐酸为原料制取氯气的化学方程式为:
和浓盐酸为原料制取氯气的化学方程式为: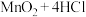 (浓)
(浓)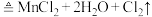 ,该反应的氧化产物是
,该反应的氧化产物是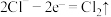 ,还原反应为
,还原反应为(2)当氯气不再逸出时,固液混合物A中仍存在
 和盐酸.小组同学分析认为随着反应的进行、
和盐酸.小组同学分析认为随着反应的进行、 的氧化性和
的氧化性和 -的还原性均减弱,为此进行探究.
-的还原性均减弱,为此进行探究.实验任务探究离子浓度对
 氧化性的影响
氧化性的影响提出猜想
猜想a:随
 减小,
减小, 的氧化性减弱.
的氧化性减弱.猜想b:随
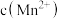 增大,
增大, 的氧化性减弱.
的氧化性减弱.查阅资料电极电势
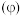 是表征氧化剂的氧化性(或还原剂的还原性)强弱的物理量.电极电势越大,氧化剂的氧化性越强;电极电势越小,还原剂的还原性越强.
是表征氧化剂的氧化性(或还原剂的还原性)强弱的物理量.电极电势越大,氧化剂的氧化性越强;电极电势越小,还原剂的还原性越强.验证猜想用
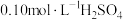 溶液、
溶液、 溶液和蒸馏水配制混合液(溶液总体积相同),将
溶液和蒸馏水配制混合液(溶液总体积相同),将 电极置于混合液中测定其电极电势
电极置于混合液中测定其电极电势 ,进行表中实验
,进行表中实验 ,数据记录。
,数据记录。| 实验序号 | 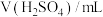 |  | 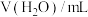 | 电极电势/V |
| 1 | 20 | 20 | 0 | 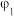 |
| 2 | m | n | 10 | 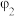 |
| 3 | 20 | 10 | 10 | 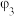 |


②根据实验1和3的结果,猜想b成立.判断依据是
探究结果固液混合物A中仍存在
 和盐酸的原因是随着反应进行,溶液中
和盐酸的原因是随着反应进行,溶液中 减小、
减小、 增大,
增大, 氧化性减弱.
氧化性减弱.③根据上述探究结果,小组同学作出如下推断:随
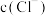 增大,
增大, 还原性增强.
还原性增强.实验验证:在固液混合物A中加入
(3)根据电化学的相关知识,小组同学利用如图电解池装置,成功实现了铜与稀硫酸制氢气.
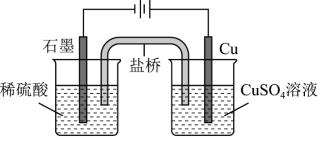
您最近一年使用:0次
4 . 甲醇是一种重要的化工原料,在生产中有着重要应用。工业上用甲烷氧化法合成甲醇,反应流程中涉及如下反应(下列焓变数据均在 测得):
测得):

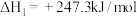 ①
①

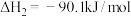 ②
②
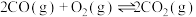
 ③
③
(1) 时,用
时,用 和
和 直接制备甲醇蒸气的热化学方程式为
直接制备甲醇蒸气的热化学方程式为___________ ;
(2)某温度下,向容积为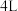 的恒容密闭容器中通入
的恒容密闭容器中通入 ,和
,和 ,发生反应①,
,发生反应①, 后反应在该温度下达到平衡,这时测得反应体系中各组分的物质的量相等,则该反应在
后反应在该温度下达到平衡,这时测得反应体系中各组分的物质的量相等,则该反应在 内的平均反应速率
内的平均反应速率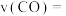
___________  ;在相同温度下,将上述反应改在某恒压容器内进行,该反应的平衡常数
;在相同温度下,将上述反应改在某恒压容器内进行,该反应的平衡常数___________ (填“增大”“不变”或“减小”);
(3)工业上可通过甲醇基化法制取甲酸甲酯, 时,其反应的热化学方程式为:
时,其反应的热化学方程式为:
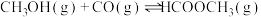
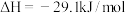
科研人员对该反应进行了研究,部分研究结果如下图所示:___________ (填下列序号字母)
a.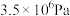 b.
b.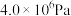 c.
c.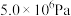
②用上述方法制取甲酸甲酯的实际工业生产中,采用的温度是 ,其理由是
,其理由是___________ ;
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:___________ (填“正”或“负”)极;
② 时,用此电池以石墨作电极电解饱和食盐水,检验阳极产物的方法是
时,用此电池以石墨作电极电解饱和食盐水,检验阳极产物的方法是___________ 。(必须有所用试剂或药品、现象和对应的结论)。
 测得):
测得):
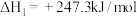 ①
①
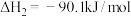 ②
②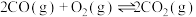
 ③
③(1)
 时,用
时,用 和
和 直接制备甲醇蒸气的热化学方程式为
直接制备甲醇蒸气的热化学方程式为(2)某温度下,向容积为
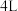 的恒容密闭容器中通入
的恒容密闭容器中通入 ,和
,和 ,发生反应①,
,发生反应①, 后反应在该温度下达到平衡,这时测得反应体系中各组分的物质的量相等,则该反应在
后反应在该温度下达到平衡,这时测得反应体系中各组分的物质的量相等,则该反应在 内的平均反应速率
内的平均反应速率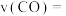
 ;在相同温度下,将上述反应改在某恒压容器内进行,该反应的平衡常数
;在相同温度下,将上述反应改在某恒压容器内进行,该反应的平衡常数(3)工业上可通过甲醇基化法制取甲酸甲酯,
 时,其反应的热化学方程式为:
时,其反应的热化学方程式为: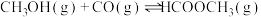
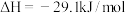
科研人员对该反应进行了研究,部分研究结果如下图所示:

a.
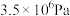 b.
b.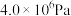 c.
c.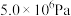
②用上述方法制取甲酸甲酯的实际工业生产中,采用的温度是
 ,其理由是
,其理由是(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:

②
 时,用此电池以石墨作电极电解饱和食盐水,检验阳极产物的方法是
时,用此电池以石墨作电极电解饱和食盐水,检验阳极产物的方法是
您最近一年使用:0次
名校
解题方法
5 . 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示,下列说法正确的是

A.电池工作时,外电路中电子的流动方向:M 镀镍铁棒 镀镍铁棒 电解质溶液 电解质溶液 碳棒 碳棒 N N |
B.电池工作时,镀镍铁棒上的电极反应式为 |
| C.电池工作一段时间后,中间工作室的NaCl浓度小于1%,原因是在中间工作室生成了更多的水 |
D.常温下,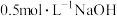 溶液中: 溶液中: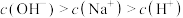 |
您最近一年使用:0次
2024-06-02更新
|
46次组卷
|
2卷引用:广东省部分学校2023-2024学年高二下学期期中联考化学试题
名校
解题方法
6 . 为实现碳中和目标, 的捕集和转化并实现资源再利用意义重大。
的捕集和转化并实现资源再利用意义重大。
Ⅰ. 的捕集
的捕集
用乙醇胺(简写为 )溶液能有效吸收
)溶液能有效吸收 ,相关反应有:
,相关反应有:
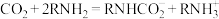

请回答:
(1)可以用测定溶液pH变化测定 吸收速率,其原理(忽略电离速率,结合相关反应解释)是
吸收速率,其原理(忽略电离速率,结合相关反应解释)是___________ 。
(2)常温下用 乙醇胺溶液吸收标准状况下
乙醇胺溶液吸收标准状况下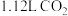 后,测得溶液中
后,测得溶液中 ,则
,则
___________ 。
Ⅱ. 的转化
的转化
二氧化碳可通过催化加氢制甲醇,
反应可表示为: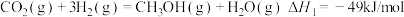 ①
①
同时发生反应: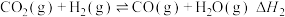 ②
②
(3)已知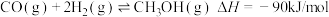 ;则
;则
___________ kJ/mol
(4)恒压密闭容器中,加入2mol 和4mol
和4mol ,发生反应①和②,下列说法正确的是___________。
,发生反应①和②,下列说法正确的是___________。
(5)恒压下, 和
和 以物质的量比
以物质的量比 投料合成甲醇(假设只发生反应①),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出
投料合成甲醇(假设只发生反应①),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出 。请在图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线
。请在图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线___________ 。 通过电化学转化可用于生产其他有机物。
通过电化学转化可用于生产其他有机物。 能在酸性水溶液中通过电催化发生电解,生成
能在酸性水溶液中通过电催化发生电解,生成 。其阴极反应式为
。其阴极反应式为___________ 。
 的捕集和转化并实现资源再利用意义重大。
的捕集和转化并实现资源再利用意义重大。Ⅰ.
 的捕集
的捕集用乙醇胺(简写为
 )溶液能有效吸收
)溶液能有效吸收 ,相关反应有:
,相关反应有: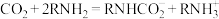

请回答:
(1)可以用测定溶液pH变化测定
 吸收速率,其原理(忽略电离速率,结合相关反应解释)是
吸收速率,其原理(忽略电离速率,结合相关反应解释)是(2)常温下用
 乙醇胺溶液吸收标准状况下
乙醇胺溶液吸收标准状况下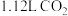 后,测得溶液中
后,测得溶液中 ,则
,则
Ⅱ.
 的转化
的转化二氧化碳可通过催化加氢制甲醇,
反应可表示为:
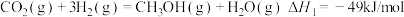 ①
①同时发生反应:
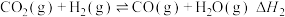 ②
②(3)已知
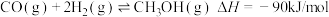 ;则
;则
(4)恒压密闭容器中,加入2mol
 和4mol
和4mol ,发生反应①和②,下列说法正确的是___________。
,发生反应①和②,下列说法正确的是___________。| A.容器内气体的平均摩尔质量不再变化,说明体系内反应达到平衡 |
B.温度升高, 的平衡转化率不一定下降 的平衡转化率不一定下降 |
C.及时将 与反应混合物分离,可提高反应①的速率和甲醇的产率 与反应混合物分离,可提高反应①的速率和甲醇的产率 |
D.平衡后将容器的容积压缩至一半,新平衡的 变小 变小 |
(5)恒压下,
 和
和 以物质的量比
以物质的量比 投料合成甲醇(假设只发生反应①),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出
投料合成甲醇(假设只发生反应①),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出 。请在图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线
。请在图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线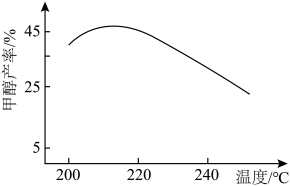
 通过电化学转化可用于生产其他有机物。
通过电化学转化可用于生产其他有机物。 能在酸性水溶液中通过电催化发生电解,生成
能在酸性水溶液中通过电催化发生电解,生成 。其阴极反应式为
。其阴极反应式为
您最近一年使用:0次
名校
解题方法
7 . 下列反应的离子方程式错误的是
A.用惰性电极电解氯化镁溶液: |
B.硫酸铵溶液显酸性: |
C.二元弱酸亚磷酸( )溶液与足量的NaOH溶液: )溶液与足量的NaOH溶液: |
D.Al与NaOH溶液: |
您最近一年使用:0次
名校
解题方法
8 . 利用膜技术和电化学原理制备少量硫酸和绿色硝化剂 ,装置如图,下列说法
,装置如图,下列说法不正确 的是
 ,装置如图,下列说法
,装置如图,下列说法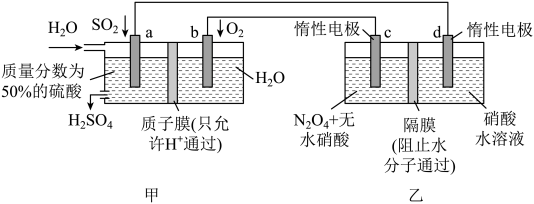
| A.甲装置将化学能转化为电能 |
B.每转移 电子,生成 电子,生成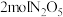 和 和 |
| C.乙中电极d上发生还原反应 |
D.c电极反应式为: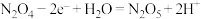 |
您最近一年使用:0次
名校
解题方法
9 . 下列离子方程式正确的是
A.氢氧燃料电池的负极反应式: |
B.稀硫酸与硫代硫酸钠溶液混合: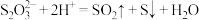 |
C.惰性电极电解 水溶液: 水溶液: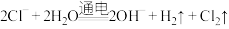 |
D.用碳酸钠溶液处理水垢中的硫酸钙: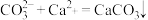 |
您最近一年使用:0次
名校
解题方法
10 . 硫和氮是生物必需的营养元素,含硫和氮的化合物在自然界中广泛存在。
(1)火山喷发产生 在大气中发生如下反应:
在大气中发生如下反应:
①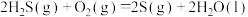 ;
;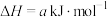
② ;
;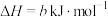
写出 燃烧的热化学方程式:
燃烧的热化学方程式:______ 。
(2)工业上可用NaClO碱性溶液吸收 。为了提高吸收效率,常用
。为了提高吸收效率,常用 作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力可加快对
作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力可加快对 的吸收。该催化过程的示意图如图所示。
的吸收。该催化过程的示意图如图所示。 也可用于脱硫,原因是
也可用于脱硫,原因是______ 。 和NO。已知:
和NO。已知: 是一种弱酸。
是一种弱酸。______ 。
②若无能量损失,相同条件下, 和NO的体积比为
和NO的体积比为______ 时,两种气体都能被完全处理。
(4)在起始温度为T℃、容积均为10L的密闭容器A(恒温)、B(绝热)中均加入1mol 和4mol
和4mol  ,发生反应
,发生反应
 。已知:
。已知: 、
、 分别是正、逆反应速率常数,
分别是正、逆反应速率常数,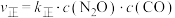 ,
,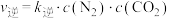 ,A、B容器中
,A、B容器中 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。______ 。
②T℃时
______ 。
(5)太阳能光电催化-化学耦合分解 的装置如图所示.该太阳能光电催化—化学耦合分解
的装置如图所示.该太阳能光电催化—化学耦合分解 的过程可描述为
的过程可描述为______ 。
(1)火山喷发产生
 在大气中发生如下反应:
在大气中发生如下反应:①
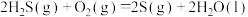 ;
;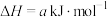
②
 ;
;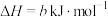
写出
 燃烧的热化学方程式:
燃烧的热化学方程式:(2)工业上可用NaClO碱性溶液吸收
 。为了提高吸收效率,常用
。为了提高吸收效率,常用 作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力可加快对
作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力可加快对 的吸收。该催化过程的示意图如图所示。
的吸收。该催化过程的示意图如图所示。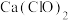 也可用于脱硫,原因是
也可用于脱硫,原因是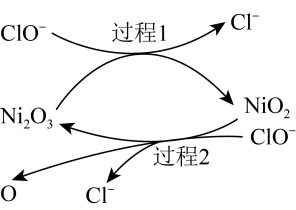
 和NO。已知:
和NO。已知: 是一种弱酸。
是一种弱酸。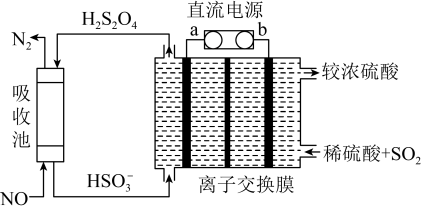
②若无能量损失,相同条件下,
 和NO的体积比为
和NO的体积比为(4)在起始温度为T℃、容积均为10L的密闭容器A(恒温)、B(绝热)中均加入1mol
 和4mol
和4mol  ,发生反应
,发生反应
 。已知:
。已知: 、
、 分别是正、逆反应速率常数,
分别是正、逆反应速率常数,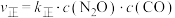 ,
,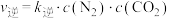 ,A、B容器中
,A、B容器中 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。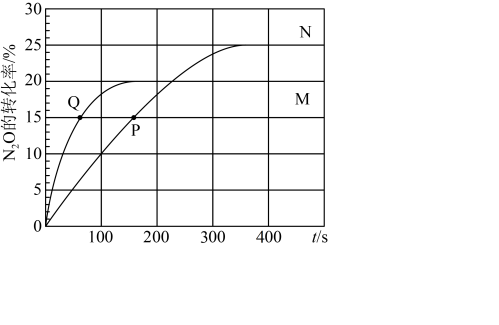
②T℃时

(5)太阳能光电催化-化学耦合分解
 的装置如图所示.该太阳能光电催化—化学耦合分解
的装置如图所示.该太阳能光电催化—化学耦合分解 的过程可描述为
的过程可描述为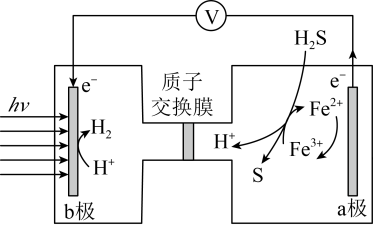
您最近一年使用:0次



