名校
解题方法
1 . 隔膜电解法制备 K2FeO4的工作原理如下图所示。下列说法正确的是


| A.隔膜为阴离子交换膜 |
| B.该方法中KOH可以循环使用,但需另外补充 |
C.Fe电极上的反应为:Fe - 6e- 4H2O = FeO 8H+ 8H+ |
| D.电路中每转移0.2mol e-,Pt 电极上理论上产生 2.24L气体 |
您最近一年使用:0次
2023-11-11更新
|
354次组卷
|
2卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
名校
解题方法
2 . 电化学原理在工农业生产中有重要应用。已知N2H4是一种重要的清洁高能燃料,产物无污染。根据如图所示装置回答下列问题(C1~C6均为石墨电极,假设各装置在工作过程中溶液体积不变)

(1)甲装置C2电极为___________ 极,C1电极上的电极反应为 ___________
(2)装置中Ag电极上的电极反应为___________ ,若乙装置中溶液体积为400mL,开始时溶液pH为6,当电极上通过0.04mol电子时溶液pH约为___________ 。
(3)丙装置用于处理含高浓度硫酸钠的废水,同时获得硫酸、烧碱及氢气,膜X为___________ (填“阳离子”“阴离子”或“质子”)交换膜,当电极上通过0.04mol电子时,中间硫酸钠废水的质量改变___________ g(假定水分子不能通过膜X和膜Y)。
(4)电解一段时间后,丁装置中能观察到的现象是___________ ,丁装置中电解反应的总化学方程式为___________ 。

(1)甲装置C2电极为
(2)装置中Ag电极上的电极反应为
(3)丙装置用于处理含高浓度硫酸钠的废水,同时获得硫酸、烧碱及氢气,膜X为
(4)电解一段时间后,丁装置中能观察到的现象是
您最近一年使用:0次
2023-11-07更新
|
598次组卷
|
4卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
名校
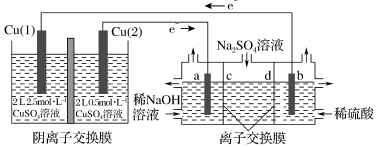
3 . 利用浓差电池电解 溶液(a、b电极均为石墨电极),可制得
溶液(a、b电极均为石墨电极),可制得 、
、 、
、 和NaOH,反应原理如图所示。下列说法正确的是
和NaOH,反应原理如图所示。下列说法正确的是
 溶液(a、b电极均为石墨电极),可制得
溶液(a、b电极均为石墨电极),可制得 、
、 、
、 和NaOH,反应原理如图所示。下列说法正确的是
和NaOH,反应原理如图所示。下列说法正确的是
A.b电极的电极反应为 |
| B.c、d分别为阴离子交换膜和阳离子交换膜 |
C.浓差电池放电过程中,Cu(2)电极上的电极反应为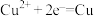 |
| D.浓差电池从开始工作到放电结束,电解池理论上可制得160gNaOH |
您最近一年使用:0次
2022-08-08更新
|
383次组卷
|
4卷引用:河北省普通高中2023届高二学业水平选择性考试(一)化学试题
解题方法
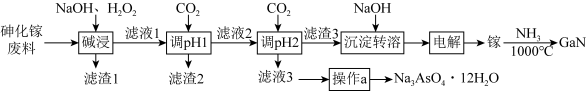
4 . 氮化镓(GaN)在5G基站及工业互联网系统建设等方面用途广泛。从砷化镓废料(主要成分为GaAs,含Fe2O3、 SiO2和CaCO3等杂质)中回收砷,制备GaN的工艺流程如图:
已知:①Ga与Al同主族,化学性质相似;
②离子完全沉淀的pH值: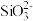 为8,
为8, 为5.5。
为5.5。
回答下列问题:
(1)为了提高“碱浸”效率应采用的措施是_______ (写 出一种措施)。
(2)“滤液1”中含有NaGaO2等溶质, “碱浸”时反应的离子方程式为_______ 。“滤渣1”的成分为_______ (填化学式)。
(3)通CO2两次调pH的原因是_______ 。
(4)“操作a”为_______ 、过滤、洗涤、干燥。
(5)“电解”时阴极的电极反应为_______ 。
(6)制备GaN时,参与反应的氧化剂与还原剂的物质的量之比为_______ 。
(7)取m克GaN样品溶于足量的热NaOH溶液(GaN+OH- +H2O = +NH3↑)中,用H3BO3溶液将产生的NH3完全吸收,用c mol·L-1的盐酸滴定,消耗盐酸V mL,则样品的纯度是
+NH3↑)中,用H3BO3溶液将产生的NH3完全吸收,用c mol·L-1的盐酸滴定,消耗盐酸V mL,则样品的纯度是_______ 。(已知: NH3+H3BO3 =NH3·H3BO3;NH3·H3BO3 +HCl=NH4Cl+H3BO3 )

已知:①Ga与Al同主族,化学性质相似;
②离子完全沉淀的pH值:
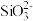 为8,
为8, 为5.5。
为5.5。回答下列问题:
(1)为了提高“碱浸”效率应采用的措施是
(2)“滤液1”中含有NaGaO2等溶质, “碱浸”时反应的离子方程式为
(3)通CO2两次调pH的原因是
(4)“操作a”为
(5)“电解”时阴极的电极反应为
(6)制备GaN时,参与反应的氧化剂与还原剂的物质的量之比为
(7)取m克GaN样品溶于足量的热NaOH溶液(GaN+OH- +H2O =
 +NH3↑)中,用H3BO3溶液将产生的NH3完全吸收,用c mol·L-1的盐酸滴定,消耗盐酸V mL,则样品的纯度是
+NH3↑)中,用H3BO3溶液将产生的NH3完全吸收,用c mol·L-1的盐酸滴定,消耗盐酸V mL,则样品的纯度是
您最近一年使用:0次
解题方法
5 . 人类向大气中排放的NOx对环境会产生危害,脱除NOx是科学家研究的重要课题。
(1)尿素还原法可将NOx还原为N2进行脱除。
已知:CO(NH2)2(s)+H2O(g) 2NH3(g)+CO2(g) ∆H1=+133.6kJ/mol
2NH3(g)+CO2(g) ∆H1=+133.6kJ/mol
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ∆H2=-2070 kJ/mol
写出尿素还原NO反应的热化学方程式:___________ 。
(2)HClO能有效脱除NO,研究不同pH、不同温度下漂粉精溶液对NO脱除率的影响,结果如图1、图2。
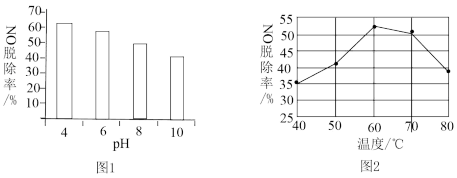
①图1中,pH减小NO脱除率增大的原因是___________ 。
②图2中,60~80℃ NO脱除率下降的原因是___________ 。
(3)NO2和H2是能效比非常 高的火箭推进剂,工业上用CH4与水蒸气在一定条件下制取 ,原理为
,原理为
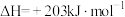 。
。
①该反应逆反应速率表达式为 ,k为速率常数,在某温度下测得实验数据如表:
,k为速率常数,在某温度下测得实验数据如表:
由上述数据可得该温度下,该反应的逆反应速率常数k为___________ 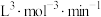 。
。
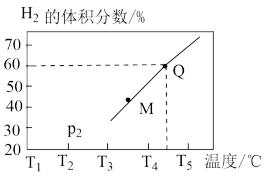
②在体积为3L的恒容密闭容器中通入物质的量均为3mol 和水蒸气,在一定条件下发生上述反应,测得平衡时
和水蒸气,在一定条件下发生上述反应,测得平衡时 的体积分数与温度的关系如图所示。M点
的体积分数与温度的关系如图所示。M点
___________ (填“大于”或“小于”)Q点 ;Q点对应温度下该反应的平衡常数K=
;Q点对应温度下该反应的平衡常数K=___________ 。
(4)通过电化学循环法可将 转化为
转化为 和
和 (如图所示)。其中氧化过程发生如下两步反应:
(如图所示)。其中氧化过程发生如下两步反应: 、
、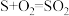 。
。
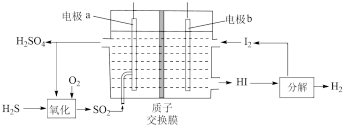
①电极a上发生反应的电极反应式为___________ 。
②理论上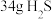 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为___________ 。
(1)尿素还原法可将NOx还原为N2进行脱除。
已知:CO(NH2)2(s)+H2O(g)
 2NH3(g)+CO2(g) ∆H1=+133.6kJ/mol
2NH3(g)+CO2(g) ∆H1=+133.6kJ/mol 4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ∆H2=-2070 kJ/mol
写出尿素还原NO反应的热化学方程式:
(2)HClO能有效脱除NO,研究不同pH、不同温度下漂粉精溶液对NO脱除率的影响,结果如图1、图2。

①图1中,pH减小NO脱除率增大的原因是
②图2中,60~80℃ NO脱除率下降的原因是
(3)NO2和H2是能效比非常 高的火箭推进剂,工业上用CH4与水蒸气在一定条件下制取
 ,原理为
,原理为
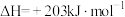 。
。①该反应逆反应速率表达式为
 ,k为速率常数,在某温度下测得实验数据如表:
,k为速率常数,在某温度下测得实验数据如表:CO浓度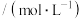 |  浓度 浓度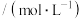 | 逆反应速率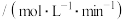 |
| 0.05 |  | 4.8 |
 |  | 19.2 |
 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为
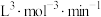 。
。②在体积为3L的恒容密闭容器中通入物质的量均为3mol
 和水蒸气,在一定条件下发生上述反应,测得平衡时
和水蒸气,在一定条件下发生上述反应,测得平衡时 的体积分数与温度的关系如图所示。M点
的体积分数与温度的关系如图所示。M点
 ;Q点对应温度下该反应的平衡常数K=
;Q点对应温度下该反应的平衡常数K=
(4)通过电化学循环法可将
 转化为
转化为 和
和 (如图所示)。其中氧化过程发生如下两步反应:
(如图所示)。其中氧化过程发生如下两步反应: 、
、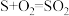 。
。
①电极a上发生反应的电极反应式为
②理论上
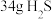 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为
您最近一年使用:0次
名校
6 . 利用光能分解水的装置如图所示,在直流电场作用下,双极性膜将水解离为 和
和 ,并实现其定向通过。下列说法正确的是
,并实现其定向通过。下列说法正确的是
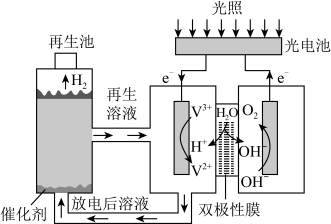
 和
和 ,并实现其定向通过。下列说法正确的是
,并实现其定向通过。下列说法正确的是
| A.光电池能将电能转化为光能 |
| B.双极性膜能控制两侧溶液的酸碱性相同 |
C.阳极区发生的电极反应为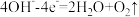 |
D.再生池中发生的反应为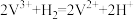 |
您最近一年使用:0次
2022-03-03更新
|
510次组卷
|
5卷引用:河北省2022届普通高中学业水平选择性考试仿真模拟卷(一)化学试题
河北省2022届普通高中学业水平选择性考试仿真模拟卷(一)化学试题福建省漳州市七校(厦大附中、龙海一中、南靖一中、平和一中、诏安一中、长泰一中、龙海二中)2021-2022学年高三下学期毕业班4月诊断性联考化学试题(已下线)专项11 电化学基础-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)吉林市第一中学2021-2022学年高三下学期4月教学质量检测理科综合化学试题广东省汕头市金山中学2022-2023学年高三上学期开学考试化学试题
名校
7 . 某小组为研究电化学原理,设计如图装置。下列叙述不 正确的是
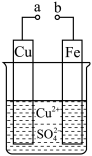
| A.a 和 b 不连接时,铁片上会有金属铜析出 |
| B.无论 a 和 b 是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
| C.a 和 b 分别连接直流电源正、负极,铜片上发生的反应为:Cu-2e-=Cu2+ |
| D.a 和 b 分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
您最近一年使用:0次
2019-04-19更新
|
238次组卷
|
2卷引用:【全国百强校】贵州省南白中学、遵义县一中2018-2019学年高二下学期第一次联考化学试题
解题方法
8 . 氮及其化合物在工农业生产和生命活动中起着重要的作用,铵盐、硝酸盐均是植物生长的“食物”,将氮气转化为氮气是植物获得“食物”的第一步,在常温常压下使N2高效地转化成为NH3是众多科学家们一直在探究的问题:

(1)已知:①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=﹣1025kJ•mol﹣1
②N2(g)+O2(g)⇌2NO(g)△H=+180.5kJ•mol﹣1水的汽化热△H=+44kJ•mol﹣1据报道,科学家已找到一种催化剂,使氨气与液态水在常温条件下转化为NH3及氧气,写出反应的热化学方程式____________________________________________________________ ;
(2)工业时合成氨的原理为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1 。图1表示H2的转化率与温度、压强之间的关系,图2表示H2的转化率与起始投料比[n(N2)/n(H2)]、压强的变化关系,则T1、T2、T3的大小关系为___ , 曲线与曲线对应的压强P1___ P2(填“>”“<”“=”).测得B(X,60)点时N2的转化率为40%,则X=______________________ 。
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,测得平衡时容器的总压为aMPa,NH3的物质的量总数为20%,列式计算出此时的平衡常数Kp=___ (用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
下列各项中能说明反应已达到平衡状态的是_____________________ 。
a.混合气体的平均相对分子质量不变
b.N2的消耗速率等于NH3的生成速率
c.混合气体的密度不变
d.N2和H2的物质的量之比保持不变
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3, 其总反应是8NO+7H2═3NH4NO3+2HNO3, 试写出以惰性材料作电极的阴极反应式:___ . 电解过程中为使电解产物全部转化为NH4NO3, 需要补充NH3的原因是___ 。

(1)已知:①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=﹣1025kJ•mol﹣1
②N2(g)+O2(g)⇌2NO(g)△H=+180.5kJ•mol﹣1水的汽化热△H=+44kJ•mol﹣1据报道,科学家已找到一种催化剂,使氨气与液态水在常温条件下转化为NH3及氧气,写出反应的热化学方程式
(2)工业时合成氨的原理为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1 。图1表示H2的转化率与温度、压强之间的关系,图2表示H2的转化率与起始投料比[n(N2)/n(H2)]、压强的变化关系,则T1、T2、T3的大小关系为
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,测得平衡时容器的总压为aMPa,NH3的物质的量总数为20%,列式计算出此时的平衡常数Kp=
下列各项中能说明反应已达到平衡状态的是
a.混合气体的平均相对分子质量不变
b.N2的消耗速率等于NH3的生成速率
c.混合气体的密度不变
d.N2和H2的物质的量之比保持不变
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3, 其总反应是8NO+7H2═3NH4NO3+2HNO3, 试写出以惰性材料作电极的阴极反应式:
您最近一年使用:0次
解题方法
9 . 如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)通入氧气的电极为_____________ (填“正极”或“负极”),负极的电极反应式为________________________________________ 。
(2)石墨电极为__________ (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,__________ 区(填“铁极”或“石墨极”)的溶液先变红。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________________ ,填“增大”“减 小”或“不变”)。精铜电极上的电极反应式为_______________________ 。
(4)若在标准状况下,有224m L氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为_________ L;丙装置中阴极析出铜的质量为 ____________ g 。

根据要求回答相关问题:
(1)通入氧气的电极为
(2)石墨电极为
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(4)若在标准状况下,有224m L氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为
您最近一年使用:0次
2019-01-15更新
|
765次组卷
|
3卷引用:【校级联考】广东省百师联盟2018-2019学年高二上学期理科综合化学试题
10 . 某化学兴趣小组同学设计如图装置:


回答下列问题:
(1)乙中铜片为________ 极 (填“正”或“负”),其电极反应式为________ 。
(2)一段时间后,将甲和乙两池溶液混合,加入H2O2和一定量稀硫酸后,有Fe(OH)3沉淀出现,但没有Cu(OH)2沉淀出现,此时溶液中c(Fe3+)=2.6×10-18 mol·L-1,求溶液中Cu2+的最大物质的量浓度________ 。(已知2Fe2++H2O2+2H+=2Fe3++2H2O,Ksp【Fe(OH)3】=2.6×10-39,Ksp【Cu(OH)2】=2.2×10-20)。
(3)丙中电源的A极为________ 极(填“正”或“负”)。
(4)若丙池盛放足量的CuSO4溶液:
①在丙池铁棒这极的现象是________ 。
②在丙池中阳极的电极反应是________ 。
(5)若丙池中盛放滴加少量酚酞的足量的饱和NaCl溶液1L(假设溶液体积电解前后无变化)。
①丙池通电一段时间后,________ 极附近溶液呈红色(填Fe或C),总反应的离子方程式:________ 。
②25℃时,当丙池中有0.1mol电子发生转移时切断电源,则理论上标准状况下共有________ L气体生成。此时溶液的pH为________ 。


回答下列问题:
(1)乙中铜片为
(2)一段时间后,将甲和乙两池溶液混合,加入H2O2和一定量稀硫酸后,有Fe(OH)3沉淀出现,但没有Cu(OH)2沉淀出现,此时溶液中c(Fe3+)=2.6×10-18 mol·L-1,求溶液中Cu2+的最大物质的量浓度
(3)丙中电源的A极为
(4)若丙池盛放足量的CuSO4溶液:
①在丙池铁棒这极的现象是
②在丙池中阳极的电极反应是
(5)若丙池中盛放滴加少量酚酞的足量的饱和NaCl溶液1L(假设溶液体积电解前后无变化)。
①丙池通电一段时间后,
②25℃时,当丙池中有0.1mol电子发生转移时切断电源,则理论上标准状况下共有
您最近一年使用:0次
2019-01-04更新
|
328次组卷
|
4卷引用:【校级联考】江西省吉安市几所重点中学2018-2019学年高二上学期联考化学试题



