1 . 采用选择性催化还原技术(SCR)可以有效脱除烟气中的氮氧化物( )。
)。
(1)钒基催化剂(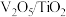 催化剂)可用于
催化剂)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示: 的总反应化学方程式为
的总反应化学方程式为___________ ,该反应的中间体有___________ 种。
②若烟气中含有硫的氧化物,则会降低 的速率,可能的原因是
的速率,可能的原因是___________ 。
(2)研究发现:当烟气中 和
和 的物质的量相同时,会发生快速SCR反应过程:
的物质的量相同时,会发生快速SCR反应过程: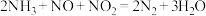 。臭氧对
。臭氧对 具有一定的辅助作用。臭氧先氧化
具有一定的辅助作用。臭氧先氧化 ,发生反应:
,发生反应: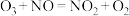 。在不同温度下,经过相同时间后测得
。在不同温度下,经过相同时间后测得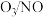 的物质的量之比与
的物质的量之比与 的脱除率关系如图乙所示。
的脱除率关系如图乙所示。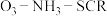 中
中 脱除率均有不同程度的降低,其原因是
脱除率均有不同程度的降低,其原因是___________ (写两条)。
②温度低于250℃,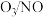 物质的量之比为0.5时,
物质的量之比为0.5时, 脱除率较高的原因是
脱除率较高的原因是___________ 。
③实验发现,向烟气中先通入 ,
, 脱除率低于先通入
脱除率低于先通入 ,可能的原因是
,可能的原因是___________
(3)以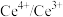 为媒介的间接电化学氧化法可以同时除去烟气中的
为媒介的间接电化学氧化法可以同时除去烟气中的 和
和 ,装置如图丙所示:
,装置如图丙所示:___________ , 参与反应的离子方程式为
参与反应的离子方程式为___________ 。
 )。
)。(1)钒基催化剂(
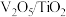 催化剂)可用于
催化剂)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示: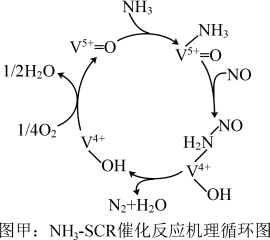
 的总反应化学方程式为
的总反应化学方程式为②若烟气中含有硫的氧化物,则会降低
 的速率,可能的原因是
的速率,可能的原因是(2)研究发现:当烟气中
 和
和 的物质的量相同时,会发生快速SCR反应过程:
的物质的量相同时,会发生快速SCR反应过程: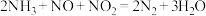 。臭氧对
。臭氧对 具有一定的辅助作用。臭氧先氧化
具有一定的辅助作用。臭氧先氧化 ,发生反应:
,发生反应: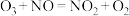 。在不同温度下,经过相同时间后测得
。在不同温度下,经过相同时间后测得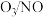 的物质的量之比与
的物质的量之比与 的脱除率关系如图乙所示。
的脱除率关系如图乙所示。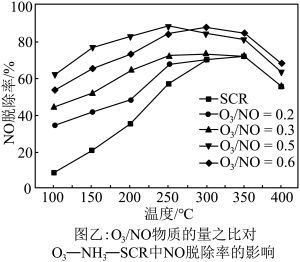
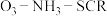 中
中 脱除率均有不同程度的降低,其原因是
脱除率均有不同程度的降低,其原因是②温度低于250℃,
 物质的量之比为0.5时,
物质的量之比为0.5时, 脱除率较高的原因是
脱除率较高的原因是③实验发现,向烟气中先通入
 ,
, 脱除率低于先通入
脱除率低于先通入 ,可能的原因是
,可能的原因是(3)以
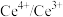 为媒介的间接电化学氧化法可以同时除去烟气中的
为媒介的间接电化学氧化法可以同时除去烟气中的 和
和 ,装置如图丙所示:
,装置如图丙所示: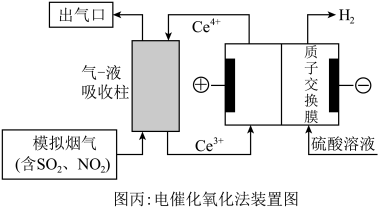
 参与反应的离子方程式为
参与反应的离子方程式为
您最近一年使用:0次
2 . 一种将苯酚(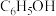 )氧化为
)氧化为 的原电池—电解池组合装置如图所示(
的原电池—电解池组合装置如图所示( 是自然界中氧化性仅次于氟的氧化剂),该装置能实现发电、环保二位一体。下列说法正确的是
是自然界中氧化性仅次于氟的氧化剂),该装置能实现发电、环保二位一体。下列说法正确的是
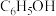 )氧化为
)氧化为 的原电池—电解池组合装置如图所示(
的原电池—电解池组合装置如图所示( 是自然界中氧化性仅次于氟的氧化剂),该装置能实现发电、环保二位一体。下列说法正确的是
是自然界中氧化性仅次于氟的氧化剂),该装置能实现发电、环保二位一体。下列说法正确的是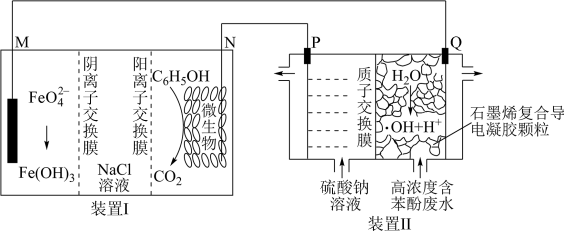
| A.装置Ⅰ为电解池,Ⅱ为原电池,M电极为阴极 |
B.一段时间后,装置Ⅰ中“ 溶液”浓度降低 溶液”浓度降低 |
C.装置Ⅱ,废水中每除掉 苯酚,消耗 苯酚,消耗 的质量为47.6g 的质量为47.6g |
| D.相同条件下,N电极和P电极产生的气体体积之比为4:7 |
您最近一年使用:0次
解题方法
3 . 某工厂以粗硅藻土 主要成分是
主要成分是 和有机质,并含有少量的
和有机质,并含有少量的 、
、 等杂质
等杂质 ,生产精制硅藻土并获得
,生产精制硅藻土并获得 及高铁酸钾
及高铁酸钾 的工艺流程如下:
的工艺流程如下:
(1)粗硅藻土在煅烧过程中,为了加快反应速率可以采取的措施有___________  写两条
写两条 。
。
(2)查阅资料得知:常温下 、
、 在浓度为
在浓度为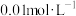 时,氢氧化物沉淀的
时,氢氧化物沉淀的 如下表:
如下表:
要使 与
与 分离,应调节溶液的
分离,应调节溶液的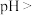
___________ ;根据表中数据,该温度下
___________ 。
(3)滤液 中通入过量
中通入过量 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)滤渣 与
与 溶液、
溶液、 反应的化学方程式为
反应的化学方程式为___________ ;在该反应中每生成 ,转移的电子数为
,转移的电子数为___________ 。
(5)工业可利用电解法制取高铁酸钾 ,装置示意图如下:
,装置示意图如下: 在电解时,镍电极接电源的
在电解时,镍电极接电源的___________ 极 填“正”或“负”
填“正”或“负” 。
。
 在电解过程中,阳极的电极反应式为
在电解过程中,阳极的电极反应式为___________ ;阴极区溶液的
___________ (填“增大”“减少”或“不变” 。
。
 主要成分是
主要成分是 和有机质,并含有少量的
和有机质,并含有少量的 、
、 等杂质
等杂质 ,生产精制硅藻土并获得
,生产精制硅藻土并获得 及高铁酸钾
及高铁酸钾 的工艺流程如下:
的工艺流程如下: 
(1)粗硅藻土在煅烧过程中,为了加快反应速率可以采取的措施有
 写两条
写两条 。
。(2)查阅资料得知:常温下
 、
、 在浓度为
在浓度为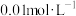 时,氢氧化物沉淀的
时,氢氧化物沉淀的 如下表:
如下表:| 氢氧化物 |  |  |  在 在 时开始溶解, 时开始溶解, 完全溶解 完全溶解 |
开始沉淀的 |  | 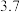 | |
完全沉淀的 |  | 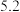 |
 与
与 分离,应调节溶液的
分离,应调节溶液的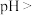

(3)滤液
 中通入过量
中通入过量 发生反应的离子方程式为
发生反应的离子方程式为(4)滤渣
 与
与 溶液、
溶液、 反应的化学方程式为
反应的化学方程式为 ,转移的电子数为
,转移的电子数为(5)工业可利用电解法制取高铁酸钾
 ,装置示意图如下:
,装置示意图如下:
 在电解时,镍电极接电源的
在电解时,镍电极接电源的 填“正”或“负”
填“正”或“负” 。
。 在电解过程中,阳极的电极反应式为
在电解过程中,阳极的电极反应式为
 。
。
您最近一年使用:0次
4 . 利用二氧化碳合成有机燃料是目前二氧化碳利用的研究方向。试回答以下问题:
(1)如图为光催化转化二氧化碳的示意图,写出二氧化碳转化为甲醇的化学方程式___________ 。 :CO2(g)+3H2(g)
:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 

反应 :CO2(g)+H2(g)
:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g) 

试写出一氧化碳和氢气合成甲醇的热化学方程式___________ 。
(3)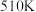 下,在压强为
下,在压强为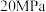 的恒压容器中通入
的恒压容器中通入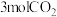 和
和 ,让其发生反应
,让其发生反应 后达到平衡,此时
后达到平衡,此时 的转化率为
的转化率为 ,则达到平衡时甲醇的物质的量分数为
,则达到平衡时甲醇的物质的量分数为___________ ,平衡常数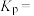
___________  (保留
(保留 位有效数字
位有效数字 。
。
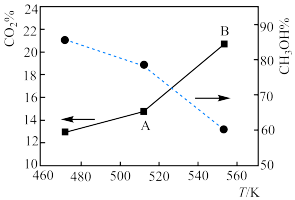
(4)下图为在一定压强下二氧化碳与氢气合成甲醇时,二氧化碳的转化率和甲醇的选择性随温度的变化示意图: 随着温度的升高,二氧化碳的转化率升高而甲醇的选择性下降的原因是
随着温度的升高,二氧化碳的转化率升高而甲醇的选择性下降的原因是___________ 。
 对于反应
对于反应 来说,
来说, 点平衡常数
点平衡常数___________  填“
填“ ”“
”“ ”或者“
”或者“ ”
”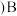 点平衡常数。
点平衡常数。
(5)下图为在 溶液中,通过电解的方法将二氧化碳转化为甲酸的机理图,试写出阴极的电极方程式
溶液中,通过电解的方法将二氧化碳转化为甲酸的机理图,试写出阴极的电极方程式___________ 。
(1)如图为光催化转化二氧化碳的示意图,写出二氧化碳转化为甲醇的化学方程式
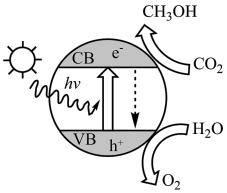
 :CO2(g)+3H2(g)
:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 

反应
 :CO2(g)+H2(g)
:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g) 

试写出一氧化碳和氢气合成甲醇的热化学方程式
(3)
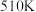 下,在压强为
下,在压强为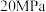 的恒压容器中通入
的恒压容器中通入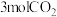 和
和 ,让其发生反应
,让其发生反应 后达到平衡,此时
后达到平衡,此时 的转化率为
的转化率为 ,则达到平衡时甲醇的物质的量分数为
,则达到平衡时甲醇的物质的量分数为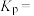
 (保留
(保留 位有效数字
位有效数字 。
。(4)下图为在一定压强下二氧化碳与氢气合成甲醇时,二氧化碳的转化率和甲醇的选择性随温度的变化示意图:
 随着温度的升高,二氧化碳的转化率升高而甲醇的选择性下降的原因是
随着温度的升高,二氧化碳的转化率升高而甲醇的选择性下降的原因是 对于反应
对于反应 来说,
来说, 点平衡常数
点平衡常数 填“
填“ ”“
”“ ”或者“
”或者“ ”
” 点平衡常数。
点平衡常数。(5)下图为在
 溶液中,通过电解的方法将二氧化碳转化为甲酸的机理图,试写出阴极的电极方程式
溶液中,通过电解的方法将二氧化碳转化为甲酸的机理图,试写出阴极的电极方程式
您最近一年使用:0次
名校
解题方法
5 . 利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法不正确的是
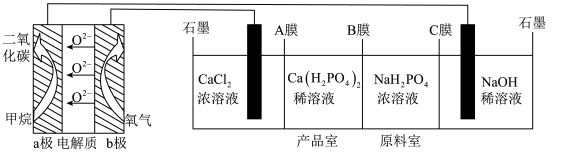
| A.a极反应:CH4-8e﹣+4O2﹣=CO2+2H2O |
| B.A、C膜均为阳离子交换膜,B膜为阴离子交换膜 |
| C.a极上通入标况下2.24L甲烷,阳极室Ca2+减少0.2mol |
| D.阳极室有氯气产生,阴极室中有氢气产生且NaOH浓度增大 |
您最近一年使用:0次
6 . I.用系统命名法写出下列物质名称或按名称写结构简式。
(1)CH3—CH(CH3)—CH2—C(CH3)3:______ 。
(2) :
:______ 。
(3)顺—1,2—二溴丙烯:______ 。
(4) :
:______ 。
(5)下列各对物质中属于同系物的是_______ ,属于同分异构体的是_______ 属于同位素的是_______ ,属于同素异形体的是_______ (本小题均填写英文字母代号)。
(6)甲烷燃料碱性(KOH)电池负极反应:______________ 。
(7)电解NaCl溶液,以石墨为电极电解总反应化学方程式________________ 。
(1)CH3—CH(CH3)—CH2—C(CH3)3:
(2)
 :
:(3)顺—1,2—二溴丙烯:
(4)
 :
:(5)下列各对物质中属于同系物的是
A. 与
与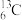 B.O2与O3 C.
B.O2与O3 C. 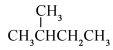 和
和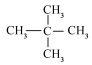 D.
D. 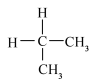 和
和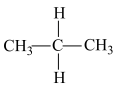 E.
E.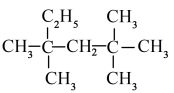 与
与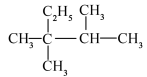
(6)甲烷燃料碱性(KOH)电池负极反应:
(7)电解NaCl溶液,以石墨为电极电解总反应化学方程式
您最近一年使用:0次
解题方法
7 . 铁及其化合物在生产和生活中有着广泛的应用。
I.校本课程小组利用下图装置,模拟铁的电化学防护。___________ (填“A”“B”或“C”)处。若X为锌电极,开关K置于A处,该电化学保护法称为___________ 。
Ⅱ.校本课程小组探究不同条件对电解FeCl2溶液微粒放电能力的影响。设计如下实验,电解装置如图所示,并进行实验记录:
(2)分析实验①中阴极现象,在pH=5.52时,放电的微粒是___________ 。
(3)实验②中向阳极附近溶液滴加KSCN溶液变红,变红的原因是___________ (用离子方程式表示);实验②中阴极有气泡产生,说明pH=0.5时,阴极发生了电极反应:___________ 。
(4)溶液中有Fe2+、H+,对比①、②阴极现象,可以得出的结论是___________ 。
(5)分析阳极实验现象,甲同学得出结论:实验①、②条件下,Fe2+放电而Cl-没有放电。乙同学认为仅由实验①、②不能得出此结论,乙同学设计了实验①对照实验:在1.5V的电压、pH=5.52的情况下,电解0.2mol/L的NaCl溶液,观察阳极处是否有气泡产生,湿润的淀粉碘化钾是否变蓝。电解0.2mol/LNaCl溶液的化学方程式为___________ 。
I.校本课程小组利用下图装置,模拟铁的电化学防护。
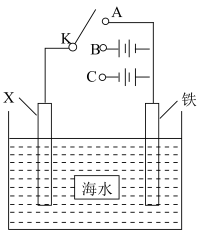
Ⅱ.校本课程小组探究不同条件对电解FeCl2溶液微粒放电能力的影响。设计如下实验,电解装置如图所示,并进行实验记录:
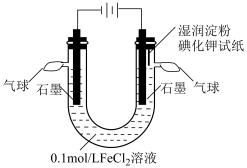
| 序号 | 电压 | pH | 阳极现象 | 阴极现象 |
| ① | 1.5V | 5.52 | 无气泡产生,湿润淀粉碘化钾试纸不变蓝;电极表面逐渐析出红褐色沉淀 | 无气泡产生;电极表面有银灰色金属析出 |
| ② | 1.5V | 0.5 | 无气泡产生,湿润淀粉碘化钾试纸不变蓝;取阳极附近溶液,滴加KSCN溶液变红 | 有气泡产生;电极表面有极少量银灰色金属析出 |
(2)分析实验①中阴极现象,在pH=5.52时,放电的微粒是
(3)实验②中向阳极附近溶液滴加KSCN溶液变红,变红的原因是
(4)溶液中有Fe2+、H+,对比①、②阴极现象,可以得出的结论是
(5)分析阳极实验现象,甲同学得出结论:实验①、②条件下,Fe2+放电而Cl-没有放电。乙同学认为仅由实验①、②不能得出此结论,乙同学设计了实验①对照实验:在1.5V的电压、pH=5.52的情况下,电解0.2mol/L的NaCl溶液,观察阳极处是否有气泡产生,湿润的淀粉碘化钾是否变蓝。电解0.2mol/LNaCl溶液的化学方程式为
您最近一年使用:0次
解题方法
8 . 如下所示装置,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断正确的是
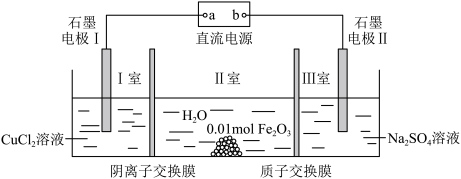
| A.b是电源的负极 |
| B.当通过质子交换膜的H+为0.12mol时,Ⅱ室内溶液质量增加超过3.32g |
| C.电解一段时间后,I室溶液的pH降低 |
| D.电解一段时间后,欲使CuCl2溶液恢复到原来浓度,需补充一定量的金属铜和氯气 |
您最近一年使用:0次
9 . 碳中和作为一种新型环保形式,已经被越来越多的大型活动和会议采用。回答下列有关问题:
(1)利用 合成二甲醚有两种工艺。
合成二甲醚有两种工艺。
工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:
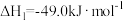
Ⅱ.逆水汽变换:

Ⅲ.甲醇脱水: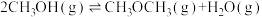
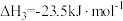
工艺2:利用 直接加氢合成
直接加氢合成 (反应Ⅳ)
(反应Ⅳ)
据上述信息可知反应Ⅳ的热化学方程式为________________ ,反应Ⅰ_____________ 低温自发进行(填“能”、“不能”)。
(2)工艺1需先合成甲醇。在不同压强下,按照 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如图甲、乙所示。
的平衡产率随温度的变化关系如图甲、乙所示。___________________ 。
A.图甲纵坐标表示 的平衡产率
的平衡产率
B.
C.为了同时提高 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压条件
的平衡产率,应选择低温、高压条件
D.一定温度压强下,提高 的平衡转化率的主要方向是寻找活性更高的催化剂
的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是_______________ 。
(3)对于合成甲醇的反应:
 ,一定条件下,单位时间内不同温度下测定的
,一定条件下,单位时间内不同温度下测定的 转化率如图丙所示。温度高于
转化率如图丙所示。温度高于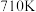 时,随温度的升高
时,随温度的升高 转化率降低的原因可能是:
转化率降低的原因可能是:________________ 。 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。____________ ;
②电极R上发生的电极反应为___________ 。
(1)利用
 合成二甲醚有两种工艺。
合成二甲醚有两种工艺。工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:

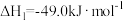
Ⅱ.逆水汽变换:


Ⅲ.甲醇脱水:
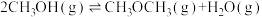
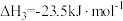
工艺2:利用
 直接加氢合成
直接加氢合成 (反应Ⅳ)
(反应Ⅳ)据上述信息可知反应Ⅳ的热化学方程式为
(2)工艺1需先合成甲醇。在不同压强下,按照
 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如图甲、乙所示。
的平衡产率随温度的变化关系如图甲、乙所示。
A.图甲纵坐标表示
 的平衡产率
的平衡产率B.

C.为了同时提高
 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压条件
的平衡产率,应选择低温、高压条件D.一定温度压强下,提高
 的平衡转化率的主要方向是寻找活性更高的催化剂
的平衡转化率的主要方向是寻找活性更高的催化剂②图乙中,某温度时,三条曲线几乎交于一点的原因是
(3)对于合成甲醇的反应:

 ,一定条件下,单位时间内不同温度下测定的
,一定条件下,单位时间内不同温度下测定的 转化率如图丙所示。温度高于
转化率如图丙所示。温度高于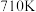 时,随温度的升高
时,随温度的升高 转化率降低的原因可能是:
转化率降低的原因可能是:
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。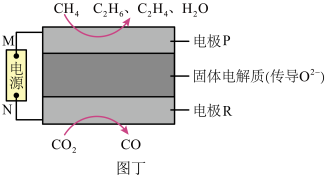
②电极R上发生的电极反应为
您最近一年使用:0次
解题方法
10 . 我国向国际社会承诺,2023年买现“碳达峰”,2060年实现“碳中和”。已知500℃时,在2L恒容密闭容器中充入2mol  和6mol
和6mol  ,发生反应:
,发生反应: ,∆H=-49kJ/mol平衡时体系压强为
,∆H=-49kJ/mol平衡时体系压强为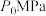 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
_______ mol/(L∙min)。 H2和CO2转化率关系_______ (相等、不相等),15分钟后平衡,平衡时H2的转化率为_______ 。
(2)下列能说明该反应已达到平衡状态的是_________ 。
A.气体的密度不再变化
B.容器内气体的压强不再变化
C.
D. 、
、 、
、 和
和 浓度之比为1:3:1:1
浓度之比为1:3:1:1
该温度下平衡常数
________ (用各气体分压代入K的公式,用含 的代数式表示,
的代数式表示, 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
一定比例的 和
和 在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。________ (填是或不是)处于平衡状态,如果P不是平衡的,继续反应则平衡转化率________ 。490K之后,甲醇产率下降的原因是________________ 。
电解法转化 可实现
可实现 的资源化利用,电解
的资源化利用,电解 制
制 的原理示意图如图所示:
的原理示意图如图所示:______ 极相连,反应时阴极电极反应式为_____________ 。
 和6mol
和6mol  ,发生反应:
,发生反应: ,∆H=-49kJ/mol平衡时体系压强为
,∆H=-49kJ/mol平衡时体系压强为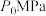 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。

(2)下列能说明该反应已达到平衡状态的是
A.气体的密度不再变化
B.容器内气体的压强不再变化
C.

D.
 、
、 、
、 和
和 浓度之比为1:3:1:1
浓度之比为1:3:1:1该温度下平衡常数

 的代数式表示,
的代数式表示, 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。一定比例的
 和
和 在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。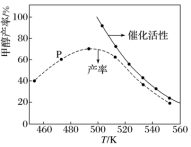
电解法转化
 可实现
可实现 的资源化利用,电解
的资源化利用,电解 制
制 的原理示意图如图所示:
的原理示意图如图所示: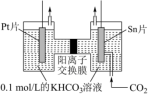
您最近一年使用:0次



