名校
解题方法
1 . 利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法不正确的是
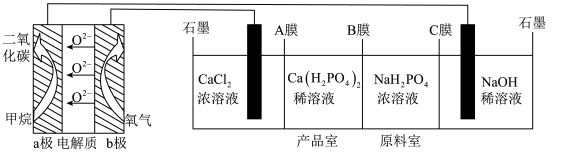
| A.a极反应:CH4-8e﹣+4O2﹣=CO2+2H2O |
| B.A、C膜均为阳离子交换膜,B膜为阴离子交换膜 |
| C.a极上通入标况下2.24L甲烷,阳极室Ca2+减少0.2mol |
| D.阳极室有氯气产生,阴极室中有氢气产生且NaOH浓度增大 |
您最近一年使用:0次
23-24高二上·广东深圳·期末
名校
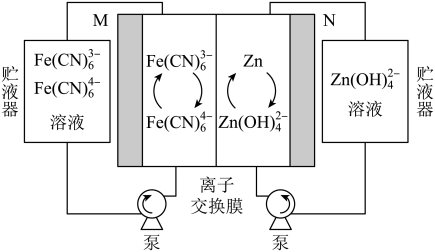
2 . 碱性锌-铁液流电池(如图)具有电压高、成本低的优点。该电池的总反应为:Zn+2Fe(CN) +4OH-
+4OH- 2Fe(CN)
2Fe(CN) +Zn(OH)
+Zn(OH) 。下列叙述正确的是
。下列叙述正确的是
 +4OH-
+4OH- 2Fe(CN)
2Fe(CN) +Zn(OH)
+Zn(OH) 。下列叙述正确的是
。下列叙述正确的是
| A.放电时,右侧贮液器中溶液浓度减小 |
| B.充电时,M电极与电源负极相连 |
C.充电时,M极电极反应式为Fe(CN) -e-=Fe(CN) -e-=Fe(CN) |
| D.放电时,电路中转移2mol电子时,负极区电解质溶液增加65g |
您最近一年使用:0次
解题方法
3 .  作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(主要含
作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(主要含 ,含有少量
,含有少量 等元素)制备
等元素)制备 的流程如下:
的流程如下:

已知: ,
, ,
, ,
, 。
。
回答下列问题:
(1)基态 的价电子排布式为
的价电子排布式为________ , 的中心原子杂化方式为
的中心原子杂化方式为________________ 。
(2)为提高硫酸溶解菱锰矿速率,可采取的措施有________ (举1例),溶解的化学方程式为________________ 。
(3)加入少量 的作用是将
的作用是将 氧化为
氧化为 ,实际生产中不宜用
,实际生产中不宜用 替代
替代 ,可能原因是
,可能原因是________________ 。
(4)溶矿反应完成后恢复常温,观察到反应器中溶液呈红褐色浑浊状且测得其 ,此时
,此时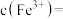
________  ,用石灰乳调节至
,用石灰乳调节至 ,除去的金属离子是
,除去的金属离子是________________ 。
(5)为了除去 ,加入少量
,加入少量 溶液,生成的沉淀有
溶液,生成的沉淀有________________ 。
(6)电解槽中阳极的电极反应式为________________ 。
(7)煅烧窑中生成 反应的化学方程式为
反应的化学方程式为________________ 。
 作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(主要含
作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(主要含 ,含有少量
,含有少量 等元素)制备
等元素)制备 的流程如下:
的流程如下:
已知:
 ,
, ,
, ,
, 。
。回答下列问题:
(1)基态
 的价电子排布式为
的价电子排布式为 的中心原子杂化方式为
的中心原子杂化方式为(2)为提高硫酸溶解菱锰矿速率,可采取的措施有
(3)加入少量
 的作用是将
的作用是将 氧化为
氧化为 ,实际生产中不宜用
,实际生产中不宜用 替代
替代 ,可能原因是
,可能原因是(4)溶矿反应完成后恢复常温,观察到反应器中溶液呈红褐色浑浊状且测得其
 ,此时
,此时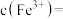
 ,用石灰乳调节至
,用石灰乳调节至 ,除去的金属离子是
,除去的金属离子是(5)为了除去
 ,加入少量
,加入少量 溶液,生成的沉淀有
溶液,生成的沉淀有(6)电解槽中阳极的电极反应式为
(7)煅烧窑中生成
 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
4 . 已知下列两个反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅰ的化学平衡常数 与温度的关系如下表所示:
与温度的关系如下表所示:
请回答下列问题:
(1)若反应Ⅱ的化学平衡常数为 ,则
,则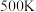 时,
时,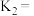
___________ 。
(2)反应Ⅰ的
___________ (填“>”、“<”或“=”)0,依据是:___________ 。
(3)温度为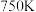 时,向某恒容密闭容器中通入一定量的
时,向某恒容密闭容器中通入一定量的 和
和 进行反应Ⅱ,下列能判断反应Ⅱ已达到平衡的依据是___________(填标号)。
进行反应Ⅱ,下列能判断反应Ⅱ已达到平衡的依据是___________(填标号)。
(4)工业上利用电解饱和食盐水制取 和
和 ,其化学方程式为:
,其化学方程式为:___________ ,电解结束后溶液
___________ (填“减小”、“不变”或“增大”)。
反应Ⅰ:

反应Ⅱ:

反应Ⅰ的化学平衡常数
 与温度的关系如下表所示:
与温度的关系如下表所示: | 500 | 750 | 1000 | 1300 |
 | 0.5 | 0.64 | 1 | 1.5 |
(1)若反应Ⅱ的化学平衡常数为
 ,则
,则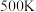 时,
时,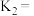
(2)反应Ⅰ的

(3)温度为
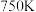 时,向某恒容密闭容器中通入一定量的
时,向某恒容密闭容器中通入一定量的 和
和 进行反应Ⅱ,下列能判断反应Ⅱ已达到平衡的依据是___________(填标号)。
进行反应Ⅱ,下列能判断反应Ⅱ已达到平衡的依据是___________(填标号)。| A.容器中的压强不再改变 |
| B.混合气体的密度不再改变 |
C.每断裂 键,同时断裂 键,同时断裂 键 键 |
D. |
 和
和 ,其化学方程式为:
,其化学方程式为:
您最近一年使用:0次
5 . “碳中和”是国家战略,其目的是实现 的排放量和利用量达到相等,将
的排放量和利用量达到相等,将 资源化是实现“碳中和”目标的重要手段.回答下列问题:
资源化是实现“碳中和”目标的重要手段.回答下列问题:
(1)下列措施有利于“碳中和”的是_______________(填标号)。
(2) 和
和 在催化剂作用下发生反应可合成清洁能源甲醇:
在催化剂作用下发生反应可合成清洁能源甲醇:

①已知该反应的正反应率 (
( 为正反应的速率常数),某温度时测得数据如表中所示.则此温度下表中
为正反应的速率常数),某温度时测得数据如表中所示.则此温度下表中
_______________ 。
②在一定条件下,体系中 的平衡转化率
的平衡转化率 与
与 和
和 的关系如图所示,
的关系如图所示, 和
和 分别表示温度或压强.
分别表示温度或压强. 表示的物理量是
表示的物理量是_______________ (填“温度”或“压强”),
_______________  (填“>”或“<”)。
(填“>”或“<”)。

③为探究该反应原理,进行如下实验:在一恒温,体积为 恒容密闭容器中,充入
恒容密闭容器中,充入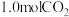 和
和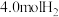 ,进行该反应(不考虑其它副反应),平衡时测得
,进行该反应(不考虑其它副反应),平衡时测得 的物质的量为
的物质的量为 .则该温度下平衡常数
.则该温度下平衡常数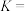
_______________ (保留2位有效数字)。
(3)若 和
和 按一定比例反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示.当温度为
按一定比例反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示.当温度为 时,图中
时,图中 点
点_______________ (填“是”或“不是”)处于平衡状态.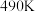 之后,甲醇产率下降,请分析其变化产生可能的原因:
之后,甲醇产率下降,请分析其变化产生可能的原因:_______________ 。(写出其中一种)。

(4) 是一种廉价的碳资源,其综合利用具有重要意义.
是一种廉价的碳资源,其综合利用具有重要意义. 可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在
可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在_______________ 极,该电极反应式是:_______________ 。
 的排放量和利用量达到相等,将
的排放量和利用量达到相等,将 资源化是实现“碳中和”目标的重要手段.回答下列问题:
资源化是实现“碳中和”目标的重要手段.回答下列问题:(1)下列措施有利于“碳中和”的是_______________(填标号)。
| A.植树造林,发展绿色经济 | B.通过裂化将重油转化为汽油 |
C.在燃煤中添加 或 或 | D.大力开采和使用可燃冰 |
(2)
 和
和 在催化剂作用下发生反应可合成清洁能源甲醇:
在催化剂作用下发生反应可合成清洁能源甲醇:
①已知该反应的正反应率
 (
( 为正反应的速率常数),某温度时测得数据如表中所示.则此温度下表中
为正反应的速率常数),某温度时测得数据如表中所示.则此温度下表中
 |  |  | |
| 1 | 0.02 | 0.01 |  |
| 2 | 0.04 | 0.01 |  |
 的平衡转化率
的平衡转化率 与
与 和
和 的关系如图所示,
的关系如图所示, 和
和 分别表示温度或压强.
分别表示温度或压强. 表示的物理量是
表示的物理量是
 (填“>”或“<”)。
(填“>”或“<”)。
③为探究该反应原理,进行如下实验:在一恒温,体积为
 恒容密闭容器中,充入
恒容密闭容器中,充入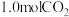 和
和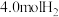 ,进行该反应(不考虑其它副反应),平衡时测得
,进行该反应(不考虑其它副反应),平衡时测得 的物质的量为
的物质的量为 .则该温度下平衡常数
.则该温度下平衡常数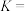
(3)若
 和
和 按一定比例反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示.当温度为
按一定比例反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示.当温度为 时,图中
时,图中 点
点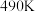 之后,甲醇产率下降,请分析其变化产生可能的原因:
之后,甲醇产率下降,请分析其变化产生可能的原因:
(4)
 是一种廉价的碳资源,其综合利用具有重要意义.
是一种廉价的碳资源,其综合利用具有重要意义. 可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在
可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在
您最近一年使用:0次
解题方法
6 . 中国正在逐步建立自己的载人空间站“天宫”,神舟十三号载人飞船在北京时间10月16日0时23分点火发射,又一次正式踏上飞向浩渺星辰的征途。
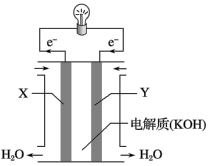
(1)氢氧燃料电池(构造示意图如图)单位质量输出电能较高,反应生成的水可作为航天员的饮用水,氧气可以作为备用氧源供给航天员呼吸。由此判断X极为电池的___________ 极, 向
向___________ (填“正”或“负”)极作定向移动,Y极的电极反应式为___________ 。
(2)在宇宙飞船或潜艇中,还可利用氢氧燃料电池所产生的水作为饮用水,今欲制得常温下180g水,则电池内电子转移的物质的量约为___________ mol
(3)“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
①飞船在光照区运行时,太阳能电池帆板将___________ 转化为___________ ,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为: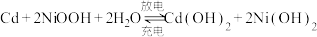 ,充电时,阳极的电极反应式为
,充电时,阳极的电极反应式为___________ ;
②当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性___________ (填“增大”“减小”或“不变”)。
(1)氢氧燃料电池(构造示意图如图)单位质量输出电能较高,反应生成的水可作为航天员的饮用水,氧气可以作为备用氧源供给航天员呼吸。由此判断X极为电池的
 向
向
(2)在宇宙飞船或潜艇中,还可利用氢氧燃料电池所产生的水作为饮用水,今欲制得常温下180g水,则电池内电子转移的物质的量约为
(3)“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
①飞船在光照区运行时,太阳能电池帆板将
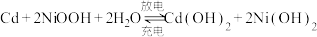 ,充电时,阳极的电极反应式为
,充电时,阳极的电极反应式为②当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性
您最近一年使用:0次
名校
解题方法
7 . 下列实验操作对应的离子方程式错误是
A.电解饱和MgCl2溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
B.向Al2(SO4)3溶液中滴入NaHCO3溶液:Al3++3 =Al(OH)3↓+3CO2↑ =Al(OH)3↓+3CO2↑ |
C.向Na2S2O3溶液中滴入稀H2SO4溶液:2H++ =S↓+SO2↑+H2O =S↓+SO2↑+H2O |
D.用Na2CO3溶液处理水垢中的CaSO4: (aq)+CaSO4(s)⇌CaCO3(s)+ (aq)+CaSO4(s)⇌CaCO3(s)+ (aq) (aq) |
您最近一年使用:0次
2024-01-27更新
|
643次组卷
|
5卷引用:广东省深圳市高级中学2023-2024学年高二上学期期末考试化学试题
广东省深圳市高级中学2023-2024学年高二上学期期末考试化学试题福建省厦门外国语学校2023-2024学年高二上学期期末模拟考试化学试题湖北省重点高中智学联盟2023-2024学年高二上学期12月联考化学试题 (已下线)化学(九省联考考后提升卷,贵州卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)热点03 离子方程式的正误判断、离子共存
解题方法
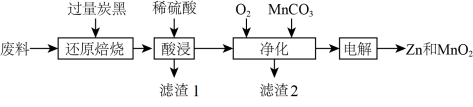
8 . 废旧锌锰电池回收处理可实现资源的再利用,初步处理后的废料中含有MnO2、MnOOH、Zn(OH)2、及Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:
资料a:Mn的金属活动性强于Fe;
Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b:生成氢氧化物沉淀的pH
回答下列问题:
(1)“还原焙烧”是为了把Mn元素转化为MnO,请写出MnOOH发生反应的化学方程式_______ 。
(2)为了提高“酸浸”的速率,可以采取的措施有_______ ;滤渣1的主要成分为_______ 。
(3)“净化”时通入O2的目的是_______ ,加入MnCO3时必须控制pH范围为_______ ;检验净化后的溶液中是否含有Fe元素的试剂是_______ 。
(4)“电解”时MnO2在_______ (填“阳”或“阴”)极生成,其电极反应式为_______ 。

资料a:Mn的金属活动性强于Fe;
Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b:生成氢氧化物沉淀的pH
| Mn(OH)2 | Zn(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 8.1 | 6.2 | 1.9 |
| 完全沉淀时 | 10.1 | 8.2 | 3.2 |
(1)“还原焙烧”是为了把Mn元素转化为MnO,请写出MnOOH发生反应的化学方程式
(2)为了提高“酸浸”的速率,可以采取的措施有
(3)“净化”时通入O2的目的是
(4)“电解”时MnO2在
您最近一年使用:0次
9 . 原电池和电解池在生产生活中具有广泛的应用。
Ⅰ.电解 溶液
溶液
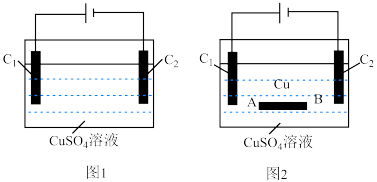
(1)实验室中电解 溶液的实验装置如图1所示。
溶液的实验装置如图1所示。
①某同学用如图1装置模拟工业电解精炼铜实验,则 为
为___________ (填“精铜”,或“粗铜”)。
②某同学用图2电解 溶液,
溶液, 、
、 均为碳棒,写出
均为碳棒,写出 的电极反应式:
的电极反应式:___________
③某同学一不小心将一段铜棒掉入 溶液中,仍用图2完成电解
溶液中,仍用图2完成电解 溶液实验,发现铜棒
溶液实验,发现铜棒___________ (选填“A”或“B”)端变粗。
Ⅱ.燃料电池在工业上的应用
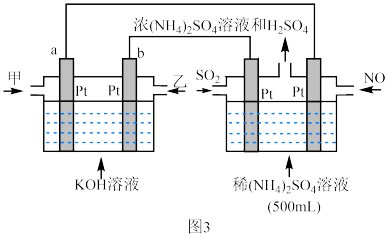
(2)利用 燃料电池电解,可将雾霾中的NO、
燃料电池电解,可将雾霾中的NO、 分别转化为
分别转化为 和
和 ,如图3装置所示。充入
,如图3装置所示。充入 的一端是
的一端是___________ (选填“甲”或“乙”)。通入 一端的电极反应式为:
一端的电极反应式为:___________ ,当电路中转移2.5mol电子时, 的浓度为
的浓度为___________  (电解过程中忽略溶液体积变化)。
(电解过程中忽略溶液体积变化)。
Ⅲ.“火星”电池
(3)火星大气由96%的二氧化碳气体组成,火星探测器采用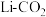 电池供电,其反应机理如下图4:
电池供电,其反应机理如下图4:
电池中的“交换膜”应为___________ 交换膜(填“阳离子”或“阴离子”)。写出CO2电极反应式:___________ 。
Ⅰ.电解
 溶液
溶液(1)实验室中电解
 溶液的实验装置如图1所示。
溶液的实验装置如图1所示。
①某同学用如图1装置模拟工业电解精炼铜实验,则
 为
为②某同学用图2电解
 溶液,
溶液, 、
、 均为碳棒,写出
均为碳棒,写出 的电极反应式:
的电极反应式:③某同学一不小心将一段铜棒掉入
 溶液中,仍用图2完成电解
溶液中,仍用图2完成电解 溶液实验,发现铜棒
溶液实验,发现铜棒Ⅱ.燃料电池在工业上的应用
(2)利用
 燃料电池电解,可将雾霾中的NO、
燃料电池电解,可将雾霾中的NO、 分别转化为
分别转化为 和
和 ,如图3装置所示。充入
,如图3装置所示。充入 的一端是
的一端是 一端的电极反应式为:
一端的电极反应式为: 的浓度为
的浓度为 (电解过程中忽略溶液体积变化)。
(电解过程中忽略溶液体积变化)。
Ⅲ.“火星”电池
(3)火星大气由96%的二氧化碳气体组成,火星探测器采用
 电池供电,其反应机理如下图4:
电池供电,其反应机理如下图4:
电池中的“交换膜”应为
您最近一年使用:0次
名校
解题方法
10 . 一种微生物电解生产甲烷的装置如图所示。下列有关说法正确的是
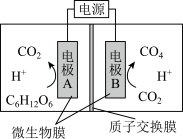

A.电极 应与电源的负极相连 应与电源的负极相连 |
B.电极 上的反应式为: 上的反应式为: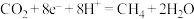 |
| C.提高温度一定能提高电解反应的速率 |
D.电解时 通过质子交换膜移向电极 通过质子交换膜移向电极 |
您最近一年使用:0次
2023-12-14更新
|
280次组卷
|
3卷引用:广东省江门市新会第一中学2023-2024学年高二上学期期末考试化学试题



