1 . 为了实现“碳达峰”和“碳中和”的目标,将CO2转化成可利用的化学能源的“负碳”技术是世界各国关注的焦点。
方法Ⅰ:CO2催化加氢制甲醇。
以CO2、H2为原料合成CH3OH涉及的反应如下:
反应i:CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1=-49.0 kJ·mol-1
CH3OH(g) + H2O(g) ΔH1=-49.0 kJ·mol-1
反应ii:CO2(g) + H2(g) CO(g) + H2O(g) ΔH2= +41.0 kJ·mol-1
CO(g) + H2O(g) ΔH2= +41.0 kJ·mol-1
反应iii:CO(g) + 2H2(g) CH3OH(g) ΔH3=
CH3OH(g) ΔH3=
(1)计算反应iii的ΔH3=___________ 。
(2)一定温度和催化剂条件下,0.73mol H2、0.24mol CO2和0.03mol N2(已知N2不参与反应)在总压强为3.0MPa的密闭容器中进行上述反应,平衡时CO2的转化率、CH3OH和CO的选择性随温度的变化曲线如图所示。
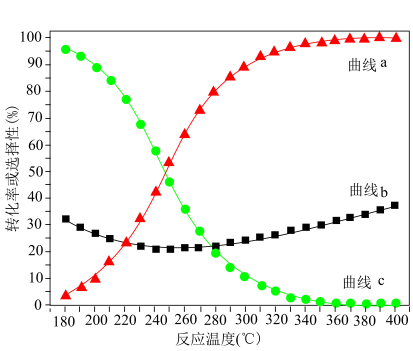
①图中曲线c表示物质___________ 的变化(填“CO2”“CH3OH”或“CO”)。
②上述反应体系在一定条件下建立平衡后,下列说法不正确 的有___________ (填字母)。
A.降低温度,反应i~iii的正、逆反应速率都减小
B.向容器中再通入少量N2,CO2的平衡转化率下降
C.移去部分H2O(g),反应iii向正反应方向衡移动
D.选择合适的催化剂能提高CO2的平衡转化率
③某温度下,t1 min反应到达平衡,测得容器中CH3OH的体积分数为12.5%。此时用CH3OH的分压表示0-t1时间内的反应速率v(CH3OH)=___________ MPa·min-1。设此时n(CO) = a mol,计算该温度下反应ii的平衡常数Kx=___________ (用含有a的代数式表示)。[已知:分压=总压 × 该组分物质的量分数;对于反应mA(g) + nB(g) pC(g) + qD(g),
pC(g) + qD(g),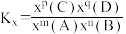 ,x为物质的量分数。]
,x为物质的量分数。]
方法Ⅱ:CO2电解法制甲醇
利用电解原理,可将CO2转化为CH3OH,其装置如图所示:
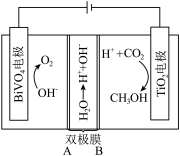
(3)双极膜B侧为___________ (填“阴离子”或“阳离子”)交换膜。
(4)TiO2电极上电极反应方程式:___________ 。
方法Ⅲ:CO2催化加氢制低碳烯烃(2~4个C的烯烃)
某研究小组使用Zn-Ga-O/SAPO-34双功能催化剂实现了CO2直接合成低碳烯烃,并给出了其可能的反应历程(如图所示)。H2首先在Zn-Ga-O表面解离成2个H*,随后参与到CO2的还原过程;SAPO-34则催化生成的甲醇转化为低碳烯烃。
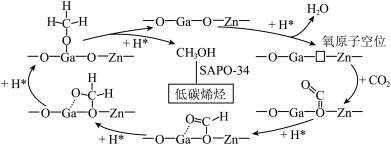
注:☐表示氧原子空位,*表示吸附在催化剂上的微粒。
(5)理论上,反应历程中消耗的H*与生成的甲醇的物质的量之比为___________ 。
方法Ⅰ:CO2催化加氢制甲醇。
以CO2、H2为原料合成CH3OH涉及的反应如下:
反应i:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH1=-49.0 kJ·mol-1
CH3OH(g) + H2O(g) ΔH1=-49.0 kJ·mol-1反应ii:CO2(g) + H2(g)
 CO(g) + H2O(g) ΔH2= +41.0 kJ·mol-1
CO(g) + H2O(g) ΔH2= +41.0 kJ·mol-1反应iii:CO(g) + 2H2(g)
 CH3OH(g) ΔH3=
CH3OH(g) ΔH3=(1)计算反应iii的ΔH3=
(2)一定温度和催化剂条件下,0.73mol H2、0.24mol CO2和0.03mol N2(已知N2不参与反应)在总压强为3.0MPa的密闭容器中进行上述反应,平衡时CO2的转化率、CH3OH和CO的选择性随温度的变化曲线如图所示。

①图中曲线c表示物质
②上述反应体系在一定条件下建立平衡后,下列说法
A.降低温度,反应i~iii的正、逆反应速率都减小
B.向容器中再通入少量N2,CO2的平衡转化率下降
C.移去部分H2O(g),反应iii向正反应方向衡移动
D.选择合适的催化剂能提高CO2的平衡转化率
③某温度下,t1 min反应到达平衡,测得容器中CH3OH的体积分数为12.5%。此时用CH3OH的分压表示0-t1时间内的反应速率v(CH3OH)=
 pC(g) + qD(g),
pC(g) + qD(g),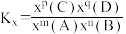 ,x为物质的量分数。]
,x为物质的量分数。] 方法Ⅱ:CO2电解法制甲醇
利用电解原理,可将CO2转化为CH3OH,其装置如图所示:

(3)双极膜B侧为
(4)TiO2电极上电极反应方程式:
方法Ⅲ:CO2催化加氢制低碳烯烃(2~4个C的烯烃)
某研究小组使用Zn-Ga-O/SAPO-34双功能催化剂实现了CO2直接合成低碳烯烃,并给出了其可能的反应历程(如图所示)。H2首先在Zn-Ga-O表面解离成2个H*,随后参与到CO2的还原过程;SAPO-34则催化生成的甲醇转化为低碳烯烃。

注:☐表示氧原子空位,*表示吸附在催化剂上的微粒。
(5)理论上,反应历程中消耗的H*与生成的甲醇的物质的量之比为
您最近一年使用:0次
解题方法
2 . 锰是冶金工业中不可缺少的添加剂,它的作用是增加合金金属材料的硬度、韧性、耐磨性和耐腐性,应用最广泛的有不锈钢、高锰钢、锰铝合金等。位于遵义市红花岗区坪桥工业园区的遵义天磁锰业集团有限公司就是一家电解锰公司;以碳酸锰为主要原料,其中含有少量铁、铝、钙、硅的氧化物或硫化物等杂质,以下是电解锰的简化工艺流程图:

(1)粉碎的目的___________ 。
(2)写出浸出时主要的离子反应___________ ,同时会产生的有毒气体是___________ 。
(3)加双氧水的作用方程式表示出来___________ 。
(4)加入氨水的作用是___________ ,除铁的离子反应___________ 。
(5)电解制锰的电极反应___________ ,当外电路转移2mol电子时,生成的气体是___________ ,在标准状况下的体积为___________ L,阳极液中产生的___________ 可循环使用。

(1)粉碎的目的
(2)写出浸出时主要的离子反应
(3)加双氧水的作用方程式表示出来
(4)加入氨水的作用是
(5)电解制锰的电极反应
您最近一年使用:0次
3 . 过二硫酸钾( )是工业上一种重要的消毒剂和织物漂白剂,可通过电解
)是工业上一种重要的消毒剂和织物漂白剂,可通过电解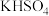 溶液制备。它在100℃下能发生分解反应:
溶液制备。它在100℃下能发生分解反应: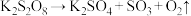 (未配平),设
(未配平),设 是阿伏加德罗常数的值,下列说法正确的是
是阿伏加德罗常数的值,下列说法正确的是
 )是工业上一种重要的消毒剂和织物漂白剂,可通过电解
)是工业上一种重要的消毒剂和织物漂白剂,可通过电解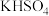 溶液制备。它在100℃下能发生分解反应:
溶液制备。它在100℃下能发生分解反应: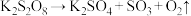 (未配平),设
(未配平),设 是阿伏加德罗常数的值,下列说法正确的是
是阿伏加德罗常数的值,下列说法正确的是A. 中S为+7价 中S为+7价 | B.1 mol  中存在 中存在 个非极性共价键 个非极性共价键 |
C.分解时每生成1 mol  ,转移4 ,转移4 个电子 个电子 | D.制备时, 在阳极上生成 在阳极上生成 |
您最近一年使用:0次
4 . 钴(Co)的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是
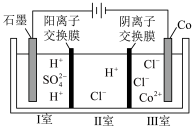
| A.工作时,Ⅰ室和Ⅱ室溶液的pH均增大 |
| B.生成2 mol Co,Ⅰ室溶液质量理论上减少32 g |
| C.移除两交换膜后,石墨电极上发生的反应不变 |
D.电解总反应: |
您最近一年使用:0次
解题方法
5 . 甲醛是重要的化工原料之一,可作为制备酚醛树脂、维纶、染料、农药和消毒剂等的原料。
(1)工业制取甲醛的方法之一为甲醇氧化法。
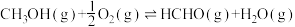

①已知: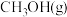 、
、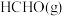 的燃烧热
的燃烧热 分别为
分别为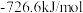 、
、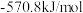 ;
;
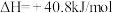 ;计算制备甲醛反应的反应热
;计算制备甲醛反应的反应热 =
=_______ 。
②在容积固定为 的密闭容器中通入
的密闭容器中通入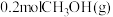
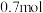 空气(设空气中氧气的体积分数为
空气(设空气中氧气的体积分数为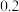 ),并加入
),并加入 催化剂,在
催化剂,在 、起始压强为
、起始压强为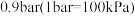 下进行反应。计算反应达到平衡时容器内
下进行反应。计算反应达到平衡时容器内 的分压
的分压_______ 。(所有气体均视作理想气体, 时反应的平衡常数
时反应的平衡常数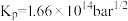 )
)
③与工业制备甲醛的方法类似,工业制备乙醛也可采用空气氧化法,还可采用乙醇脱氢法。已知: 时
时
反应Ⅰ:
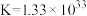
反应Ⅱ:
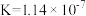
比较两种方法的优缺点______________ 。
(2)一种将电氧化法和电还原法联合处理含甲醛的废水的装置如图所示。
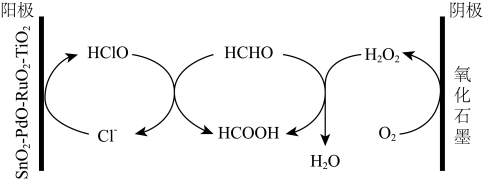
①写出阴极反应的电极反应式______________ ,阳极反应的电极反应式______________ 。
②若外电路通过 电子的电量,计算理论上能处理甲醛的质量
电子的电量,计算理论上能处理甲醛的质量______________ 。
(1)工业制取甲醛的方法之一为甲醇氧化法。
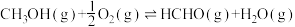

①已知:
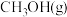 、
、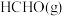 的燃烧热
的燃烧热 分别为
分别为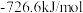 、
、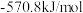 ;
;
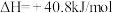 ;计算制备甲醛反应的反应热
;计算制备甲醛反应的反应热 =
=②在容积固定为
 的密闭容器中通入
的密闭容器中通入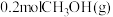
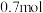 空气(设空气中氧气的体积分数为
空气(设空气中氧气的体积分数为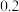 ),并加入
),并加入 催化剂,在
催化剂,在 、起始压强为
、起始压强为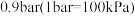 下进行反应。计算反应达到平衡时容器内
下进行反应。计算反应达到平衡时容器内 的分压
的分压 时反应的平衡常数
时反应的平衡常数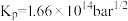 )
)③与工业制备甲醛的方法类似,工业制备乙醛也可采用空气氧化法,还可采用乙醇脱氢法。已知:
 时
时反应Ⅰ:

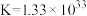
反应Ⅱ:

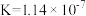
比较两种方法的优缺点
(2)一种将电氧化法和电还原法联合处理含甲醛的废水的装置如图所示。

①写出阴极反应的电极反应式
②若外电路通过
 电子的电量,计算理论上能处理甲醛的质量
电子的电量,计算理论上能处理甲醛的质量
您最近一年使用:0次
解题方法
6 . 用如图所示装置回收金属钴。回收过程保持细菌所在环境pH相对稳定,借助其将乙酸盐转化为二氧化碳。使用废旧锂电池的正极材料LiCoO2转化为Co2+,工作时保持厌氧环境,并定时将乙室溶液转移到甲室。电极材料均为石墨材质,右侧为原电池。下列说法正确的是
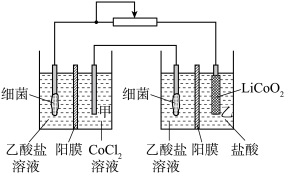

| A.细菌所处环境应为偏酸性环境 |
B.乙室电极反应式是: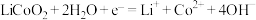 |
| C.若甲室Co2+减少1 mol,乙室Co2+增加2 mol,则此时已经进行过溶液转移 |
| D.将乙酸盐换为乙醇盐,可回收更多的Co |
您最近一年使用:0次
解题方法
7 . 甲烷是一种清洁、高效的能源。煤经过气化、变换、净化得到合成气(含有H2和CO等)的甲烷化技术是当前研究的热点。涉及的反应如下:
反应I:CO(g)+ 3H2(g)⇌CH4(g) + H2O ΔH1 = - 206 kJ/mol
反应II: CO(g) + H2O(g)⇌CO2(g) + H2(g) ΔH2= -41 kJ/mol
反应III: CO2(g)+ 4H2(g)⇌CH4(g) + 2H2O(g) ΔH3
(1)△H3=_______ kJ/mol。反应I在什么温度下能自发进行_______ 。 (填 “高温”或“低温”)
(2)在某密闭容器中通入一定量的CO和H2,加入金属镍做催化剂,在一定温度下发生上述反应。
①为提高CO和H2的平衡转化率,除改变温度外,还可以采取哪些措施_______ 。
②恒温恒容条件下,起始时CO和H2的浓度分别为a mol·L-1和b mol·L-1,达平衡时CH4和CO2的浓度分别为c mol/L和d mol/L。
i.达平衡时,H2O的浓度是_______ mol·L-1。
ii.反应I的平衡常数K是_______ 。 (用a、 b、c、d表示)
(3)Schested认为,以单一负载型 Ni催化反应I时,在催化剂表面存在两种活性中心,分别以“●”和“#”表示,在活性位“●”上发生CO吸附,在活性位“#”上被吸附的CO发生分解反应生成表面碳,表面碳再与H2结合生成CH4,其催化反应机理的反应式如下:
(i)CO+●⇌CO● 快速平衡
(ii)CO●+#⇌O● +C# 慢反应
(iii)C#+ 2H2⇌CH4+# 快反应
(iV)_______ 快反应
写出反应(iV)的反应式_______ ;反应I的决速步骤是哪一步_______ 。
(4)一种利用电化学方法生产甲烷的装置如图所示:
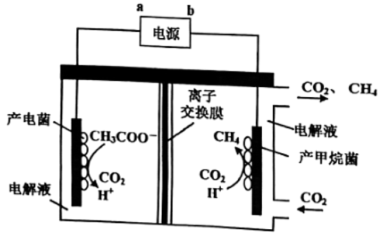
①写出阳极的电极反应式_______ 。
②理论上每生成0.1 mol CH4,阳极室生成CO2的体积是_______ 升。 (标准状况下)
反应I:CO(g)+ 3H2(g)⇌CH4(g) + H2O ΔH1 = - 206 kJ/mol
反应II: CO(g) + H2O(g)⇌CO2(g) + H2(g) ΔH2= -41 kJ/mol
反应III: CO2(g)+ 4H2(g)⇌CH4(g) + 2H2O(g) ΔH3
(1)△H3=
(2)在某密闭容器中通入一定量的CO和H2,加入金属镍做催化剂,在一定温度下发生上述反应。
①为提高CO和H2的平衡转化率,除改变温度外,还可以采取哪些措施
②恒温恒容条件下,起始时CO和H2的浓度分别为a mol·L-1和b mol·L-1,达平衡时CH4和CO2的浓度分别为c mol/L和d mol/L。
i.达平衡时,H2O的浓度是
ii.反应I的平衡常数K是
(3)Schested认为,以单一负载型 Ni催化反应I时,在催化剂表面存在两种活性中心,分别以“●”和“#”表示,在活性位“●”上发生CO吸附,在活性位“#”上被吸附的CO发生分解反应生成表面碳,表面碳再与H2结合生成CH4,其催化反应机理的反应式如下:
(i)CO+●⇌CO● 快速平衡
(ii)CO●+#⇌O● +C# 慢反应
(iii)C#+ 2H2⇌CH4+# 快反应
(iV)_______ 快反应
写出反应(iV)的反应式
(4)一种利用电化学方法生产甲烷的装置如图所示:

①写出阳极的电极反应式
②理论上每生成0.1 mol CH4,阳极室生成CO2的体积是
您最近一年使用:0次
解题方法
8 . 由于Fe(OH)2极易被氧化,所以实验室里很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如下图所示的电解实验装置制备白色纯净的Fe(OH)2沉淀,两极的材料分别为石墨和铁。下列说法正确的是
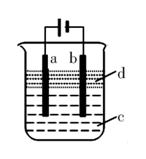

| A.a电极上发生的电极反应:4OH- -4e-= O2↑ +2H2O |
| B.a电极上发生的电极反应:Fe -2e- =Fe2+ |
| C.c可以是氯化钠溶液,d可以是苯 |
| D.为了在较短时间内看到白色沉淀,可以剧烈地搅拌溶液 |
您最近一年使用:0次
名校
解题方法
9 . 空间实验室的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是
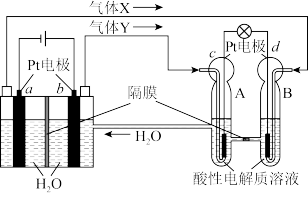

| A.当有0.1mol电子转移时,a电极产生1.12LH2(标准状况下) |
| B.b电极上发生的电极反应是:4H2O+4e-=2H2↑+4OH- |
| C.c电极上进行氧化反应,B池中的H+可以通过隔膜进入A池 |
| D.d电极上发生的电极反应是:O2+4H++4e-=2H2O |
您最近一年使用:0次
2021-08-21更新
|
148次组卷
|
3卷引用:2013全国高中化学素质和实验能力竞赛(河南赛区)试题
解题方法
10 . 有一种模拟电化学方法处理废水的微型实验,其基本原理是在电解过程中使低价金属离子Mn+(例如Co2+)氧化为高价态的金属离子,然后以此高价态的金属离子作氧化剂把废水中的有机物氧化分解成CO2而净化。该电化学净化法又称间接电化学氧化。其阳极反应式为:Mn+-e‑→M(n+1)+。若现按下图所示进行实验,试回答下列问题:

(1)井穴板穴孔内应盛放_______ 溶液以便检验电解时产生的CO2气体,现象是:____ 。
(2)写出电解过程中的电极反应式:阳极:_______ ;阴极:_______ 。
(3)写出M(n+1)+氧化有机物(以甲醇为代表)的离子方程式:_______

(1)井穴板穴孔内应盛放
(2)写出电解过程中的电极反应式:阳极:
(3)写出M(n+1)+氧化有机物(以甲醇为代表)的离子方程式:
您最近一年使用:0次



