解题方法
1 .  电化学循环氧化法可用于废水中苯酚降解成
电化学循环氧化法可用于废水中苯酚降解成 ,工作原理如图所示,下列说法正确的是
,工作原理如图所示,下列说法正确的是
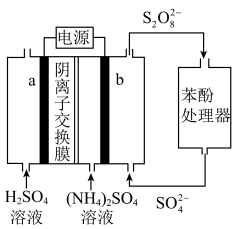
 电化学循环氧化法可用于废水中苯酚降解成
电化学循环氧化法可用于废水中苯酚降解成 ,工作原理如图所示,下列说法正确的是
,工作原理如图所示,下列说法正确的是
A.电极 是阴极,发生还原反应 是阴极,发生还原反应 |
B.a电极的电极反应式为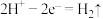 |
C.电解时, 通过阴离子交换膜从右向左迁移 通过阴离子交换膜从右向左迁移 |
D.电路中通过 电子时,理论上可处理 电子时,理论上可处理 苯酚 苯酚 |
您最近一年使用:0次
名校
解题方法
2 . 丙烯腈是塑料、合成橡胶、合成纤维三大合成材料的重要原料,未来我国丙烯腈的出口量将进一步增加。合成丙烯腈的反应:
 。
。
(1)该反应中涉及的C、N、O三种元素原子的第一电离能由小到大的顺序是_______ 。
(2)一定条件下,在2L恒容密闭容器中;通入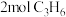 、
、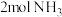 、15mol空气(
、15mol空气( 的体积分数为
的体积分数为 ),丙烯腈的产率与温度的关系如图所示。
),丙烯腈的产率与温度的关系如图所示。

①图中460℃前的产率_______ (填“是”或“否”)为平衡产率;理由是_______ 。
②若该反应达到A点所需的时间为t min,则理论上 的平均反应速率为
的平均反应速率为_______ 。
(3)工业上在催化剂作用下,合成丙烯腈时还有副反应:
 。
。
①其它条件不变时,压缩容器体积,副反应的平衡移动方向为_______ 。
②某温度下,向密闭容器中通入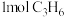 、
、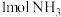 、7.5mol空气(
、7.5mol空气( 与
与 的体积比为1∶4),保持压强恒为99kPa,平衡时测得
的体积比为1∶4),保持压强恒为99kPa,平衡时测得 的转化率为90%,生成丙烯腈的选择性为
的转化率为90%,生成丙烯腈的选择性为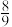 (选择性:生成丙烯腈的
(选择性:生成丙烯腈的 与共转化的
与共转化的 之比)。则生成丙烯腈的分压为
之比)。则生成丙烯腈的分压为_______ kPa,该温度下副反应的
_______ 。
(4)己二腈 是制造尼龙
是制造尼龙 的原料。电解丙烯腈可制得己二腈,其装置如下图所示:
的原料。电解丙烯腈可制得己二腈,其装置如下图所示:
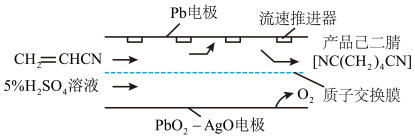
①阴极的电极反应式为_______ 。
②电解一段时间后,该装置产生的 在标准状态下的体积为33.6L,生成了291.6g已二腈,则该装置的电流效率
在标准状态下的体积为33.6L,生成了291.6g已二腈,则该装置的电流效率
_______ %。(假设装置中阳极上没有电子损失,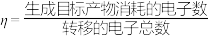 ×100%)
×100%)

 。
。(1)该反应中涉及的C、N、O三种元素原子的第一电离能由小到大的顺序是
(2)一定条件下,在2L恒容密闭容器中;通入
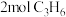 、
、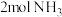 、15mol空气(
、15mol空气( 的体积分数为
的体积分数为 ),丙烯腈的产率与温度的关系如图所示。
),丙烯腈的产率与温度的关系如图所示。
①图中460℃前的产率
②若该反应达到A点所需的时间为t min,则理论上
 的平均反应速率为
的平均反应速率为(3)工业上在催化剂作用下,合成丙烯腈时还有副反应:

 。
。①其它条件不变时,压缩容器体积,副反应的平衡移动方向为
②某温度下,向密闭容器中通入
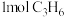 、
、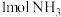 、7.5mol空气(
、7.5mol空气( 与
与 的体积比为1∶4),保持压强恒为99kPa,平衡时测得
的体积比为1∶4),保持压强恒为99kPa,平衡时测得 的转化率为90%,生成丙烯腈的选择性为
的转化率为90%,生成丙烯腈的选择性为 (选择性:生成丙烯腈的
(选择性:生成丙烯腈的 与共转化的
与共转化的 之比)。则生成丙烯腈的分压为
之比)。则生成丙烯腈的分压为
(4)己二腈
 是制造尼龙
是制造尼龙 的原料。电解丙烯腈可制得己二腈,其装置如下图所示:
的原料。电解丙烯腈可制得己二腈,其装置如下图所示:
①阴极的电极反应式为
②电解一段时间后,该装置产生的
 在标准状态下的体积为33.6L,生成了291.6g已二腈,则该装置的电流效率
在标准状态下的体积为33.6L,生成了291.6g已二腈,则该装置的电流效率
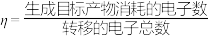 ×100%)
×100%)
您最近一年使用:0次
2023-02-03更新
|
558次组卷
|
4卷引用:广东省茂名市第一中学2022-2023学年高三上学期期末化学诊断检测题
广东省茂名市第一中学2022-2023学年高三上学期期末化学诊断检测题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(原理综合题)重庆市2023届高三第一次联合诊断检测(一模)(康德卷)化学试题山东省潍坊市昌乐第一中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
3 . 水系有机液流电池作为大规模储能技术,在实现可再生能源高效利用方面展现出良好的应用潜力。一种新型有机液流电池的工作原理如图。下列说法不正确的是:
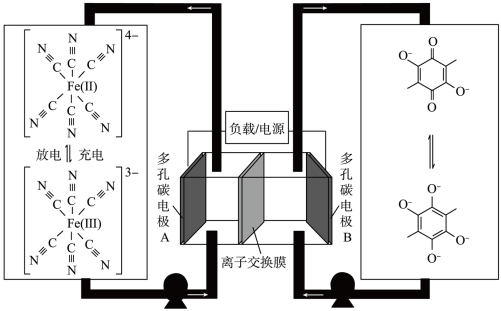

A.放电时,正极反应式为: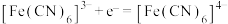 |
| B.离子交换膜为阴离子交换膜 |
C.充电时,阴极的电极反应式为: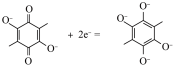 |
| D.通过增大泵的功率提高液体的流速,可以增大电池的电流量 |
您最近一年使用:0次
2023-02-03更新
|
908次组卷
|
4卷引用:广东省茂名市第一中学2022-2023学年高三上学期期末化学诊断检测题
4 . 钾离子电池是一种新兴的电池,一种钾离子电池的工作原理如图所示,其总反应为 ,下列说法正确的是
,下列说法正确的是
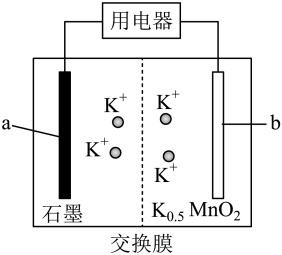
 ,下列说法正确的是
,下列说法正确的是
A.放电时, 向a极移动 向a极移动 |
B.放电时,a极发生的反应为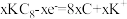 |
| C.充电时,b极发生还原反应 |
D.充电时,理论上电路通过8mol ,b极质量减小39g ,b极质量减小39g |
您最近一年使用:0次
2022-07-12更新
|
519次组卷
|
2卷引用:广东省茂名市2021-2022学年高二下学期期末教学质量监测化学试题
5 . 2019年12月4日“全球碳计划”发布报告说,全球 排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。
排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。 的综合利用是解决温室问题的有效途径。
的综合利用是解决温室问题的有效途径。
(1)以 与
与 为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应Ⅰ: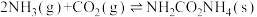
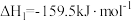 ;
;
反应Ⅱ: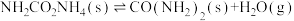
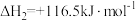 ;
;
反应Ⅲ:
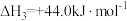 。
。
则反应Ⅳ: 与
与 合成尿素同时生成液态水的热化学方程式为
合成尿素同时生成液态水的热化学方程式为___________ 。
(2)利用工业废气中的 可以制取甲醇和水蒸气,其反应原理:
可以制取甲醇和水蒸气,其反应原理:
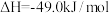 。在体积为1L的恒容密闭容器中,充入
。在体积为1L的恒容密闭容器中,充入 和
和 ,一定条件下发生反应测得
,一定条件下发生反应测得 和
和 的浓度随时间变化如图所示,反应10min达到平衡。
的浓度随时间变化如图所示,反应10min达到平衡。
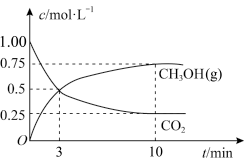
①从反应开始到平衡,氢气的平均反应速率
___________ 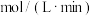 ;该反应的平衡常数为
;该反应的平衡常数为___________ (保留两位有效数字)。
②反应进行到3min时,v(正)___________ v(逆)(填“>”“<”或“=”)。
③下列措施可提高 转化率的是
转化率的是___________ 。
A.升高温度 B.将 从体系中分离出去
从体系中分离出去
C.恒容条件下充入He D.再充入适量的
(3)中国科学家首次用 高效合成乙酸,其反应路径如图所示:
高效合成乙酸,其反应路径如图所示:
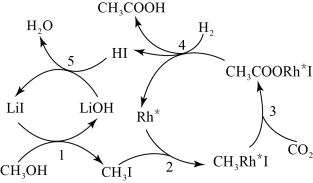
①原料中的 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:___________ 。
②根据图示,写出总反应的化学方程式:___________ 。
 排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。
排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。 的综合利用是解决温室问题的有效途径。
的综合利用是解决温室问题的有效途径。(1)以
 与
与 为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:反应Ⅰ:
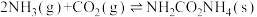
 ;
;反应Ⅱ:
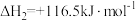 ;
;反应Ⅲ:

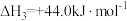 。
。则反应Ⅳ:
 与
与 合成尿素同时生成液态水的热化学方程式为
合成尿素同时生成液态水的热化学方程式为(2)利用工业废气中的
 可以制取甲醇和水蒸气,其反应原理:
可以制取甲醇和水蒸气,其反应原理:
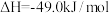 。在体积为1L的恒容密闭容器中,充入
。在体积为1L的恒容密闭容器中,充入 和
和 ,一定条件下发生反应测得
,一定条件下发生反应测得 和
和 的浓度随时间变化如图所示,反应10min达到平衡。
的浓度随时间变化如图所示,反应10min达到平衡。
①从反应开始到平衡,氢气的平均反应速率

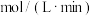 ;该反应的平衡常数为
;该反应的平衡常数为②反应进行到3min时,v(正)
③下列措施可提高
 转化率的是
转化率的是A.升高温度 B.将
 从体系中分离出去
从体系中分离出去C.恒容条件下充入He D.再充入适量的

(3)中国科学家首次用
 高效合成乙酸,其反应路径如图所示:
高效合成乙酸,其反应路径如图所示: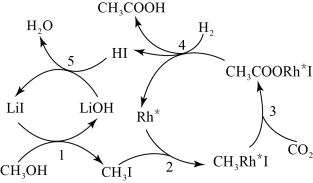
①原料中的
 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:②根据图示,写出总反应的化学方程式:
您最近一年使用:0次
6 . 甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下可合成甲醇,发生的主要反应如下:
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1)
_______ 。
(2)将 和
和 通入容积为
通入容积为 的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得H2的平衡转化率与温度的关系如图所示。
的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得H2的平衡转化率与温度的关系如图所示。

① 时反应达到平衡所需的时间为
时反应达到平衡所需的时间为 ,则反应从起始至
,则反应从起始至 内,用H2表示该反应的平均反应速率为
内,用H2表示该反应的平均反应速率为_______ 。
② 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
_______ 。
③下列可用来判断该反应已达到平衡状态的有_______ (填标号)。
A.CO的含量保持不变 B.容器中
C.容器中混合气体的密度保持不变 D.
(3)甲醇会对水质造成一定的污染,有一种电化学法可消除这种污染,其原理如下:通电后,将 氧化成
氧化成 ,然后以
,然后以 作氧化剂,将水中的甲醇氧化成
作氧化剂,将水中的甲醇氧化成 而净化。实验室用如图装置模拟上述过程。
而净化。实验室用如图装置模拟上述过程。

①A极为_______ (填“阴极”或“阳极”)。
②写出阳极的电极反应式:_______ 。
③写出除去甲醇的离子方程式:_______ 。
Ⅰ.

Ⅱ.

Ⅲ.

回答下列问题:
(1)

(2)将
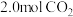 和
和 通入容积为
通入容积为 的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得H2的平衡转化率与温度的关系如图所示。
的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得H2的平衡转化率与温度的关系如图所示。
①
 时反应达到平衡所需的时间为
时反应达到平衡所需的时间为 ,则反应从起始至
,则反应从起始至 内,用H2表示该反应的平均反应速率为
内,用H2表示该反应的平均反应速率为②
 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
③下列可用来判断该反应已达到平衡状态的有
A.CO的含量保持不变 B.容器中
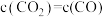
C.容器中混合气体的密度保持不变 D.
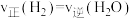
(3)甲醇会对水质造成一定的污染,有一种电化学法可消除这种污染,其原理如下:通电后,将
 氧化成
氧化成 ,然后以
,然后以 作氧化剂,将水中的甲醇氧化成
作氧化剂,将水中的甲醇氧化成 而净化。实验室用如图装置模拟上述过程。
而净化。实验室用如图装置模拟上述过程。
①A极为
②写出阳极的电极反应式:
③写出除去甲醇的离子方程式:
您最近一年使用:0次
2022-01-01更新
|
219次组卷
|
2卷引用:广东省高州市第一中学2021-2022学年高二上学期期末考试化学试题
7 . 锰及其化合物在工业上应用十分广泛。利用如图装置,可从MnSO4溶液中电沉积金属锰,并联产MnO2,同时回收硫酸。下列叙述错误的是


| A.a连接电源负极 |
| B.膜n为阴离子交换膜 |
| C.阳极上的反应式为:Mn2++2H2O-2e-=MnO2+4H+ |
| D.阴极析出11gMn,理论上外电路中迁移了0.4mol电子 |
您最近一年使用:0次
2021-11-25更新
|
887次组卷
|
3卷引用:广东省茂名市“五校联盟” 2021-2022学年高二上学期期末联考(创新班)化学试题
广东省茂名市“五校联盟” 2021-2022学年高二上学期期末联考(创新班)化学试题四川省宜宾市2021-2022学年高三上学期第一次诊断检测理综化学试题(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)
名校
解题方法
8 . 电渗析法是海水淡化的方法之一,具有选择性离子交换膜交错排列构成的多层式电渗析槽,其工作原理如图所示(a、b为不同离子交换膜)。下列有关说法错误的是


| A.a为阳离子交换膜,b为阴离子交换膜 |
B.阴极区电极反应式为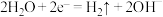 |
| C.X为淡盐水,Y为浓盐水 |
| D.该方法可得到副产品NaOH |
您最近一年使用:0次
2021-07-04更新
|
296次组卷
|
4卷引用:广东省茂名市2020-2021学年度下学期高二期末考试化学试题
广东省茂名市2020-2021学年度下学期高二期末考试化学试题(已下线)专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)广东省广州大学附属中学2023-2024学年高二下学期开学测化学试题



