解题方法
1 . 水系钠离子电池有成本低、寿命长、环保等诸多优势,未来有望代替锂离子电池和铅酸电池。一种水系钠离子电池放电和充电的工作原理示意图如图所示。下列说法错误的是


| A.放电时,光可以促进电子转移 |
| B.放电时,工作一段时间,M电极区Na+浓度减小 |
| C.充电时,M极发生还原反应 |
D.充电时,阳极的电极反应式为3I--2e-= |
您最近一年使用:0次
2 . 利用下列装置(夹持装置略)进行实验,能达到实验目的的是
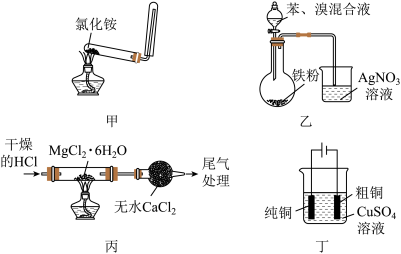

A.用甲装置制备并收集 |
| B.用乙装置制备溴苯并验证有HBr产生 |
C.用丙装置制备无水 |
| D.用丁装置进行铜的电解精炼 |
您最近一年使用:0次
3 . 乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:
(1)乙烯可用于制备乙醇:C2H4(g)+H2O(g) C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:

①该反应为___________ 热反应(填“吸”或“放”),理由为___________ 。
②A点时容器中气体的总物质的量为___________ 。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为b MPa,则A点对应温度下的KP=___________ MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g) C2H5OH(g)的反应速率表达式为v正=k正 c(C2H4)·c(H2O),v逆=k逆 c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是
C2H5OH(g)的反应速率表达式为v正=k正 c(C2H4)·c(H2O),v逆=k逆 c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___________ (填选项字母)。
A. k正增大,k逆减小 B. k正减小,k逆增大
C. k正增大的倍数大于k逆 D. k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率___________ 10%(填“>”“<”或“=”)。
(2)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为___________ 极(填“阴”或“阳”),对应的电极反应式为___________ 。
(1)乙烯可用于制备乙醇:C2H4(g)+H2O(g)
 C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
①该反应为
②A点时容器中气体的总物质的量为
③已知:C2H4(g)+H2O(g)
 C2H5OH(g)的反应速率表达式为v正=k正 c(C2H4)·c(H2O),v逆=k逆 c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是
C2H5OH(g)的反应速率表达式为v正=k正 c(C2H4)·c(H2O),v逆=k逆 c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是A. k正增大,k逆减小 B. k正减小,k逆增大
C. k正增大的倍数大于k逆 D. k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率
(2)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为
您最近一年使用:0次
名校
解题方法
4 . 甲烷是良好的制氢材料。我国科学家发明了一种500℃时,在含氧离子( )的熔融碳酸盐中电解甲烷的方法,实现了无水、零排放的方式生产H2和C。反应原理如图所示。下列说法正确的是
)的熔融碳酸盐中电解甲烷的方法,实现了无水、零排放的方式生产H2和C。反应原理如图所示。下列说法正确的是
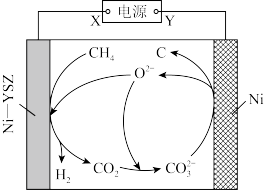
 )的熔融碳酸盐中电解甲烷的方法,实现了无水、零排放的方式生产H2和C。反应原理如图所示。下列说法正确的是
)的熔融碳酸盐中电解甲烷的方法,实现了无水、零排放的方式生产H2和C。反应原理如图所示。下列说法正确的是
| A.X为电源的负极 |
B.Ni电极上发生的电极反应方程式为 |
C.电解一段时间后熔融盐中 的物质的量变多 的物质的量变多 |
| D.该条件下,每产生22.4L H2,电路中转移2mol电子 |
您最近一年使用:0次
2021-03-26更新
|
1980次组卷
|
16卷引用:广东省潮州市2021-2022学年高三上学期期末考试化学试题
广东省潮州市2021-2022学年高三上学期期末考试化学试题江苏省七市(南通、泰州、扬州、徐州、淮安、连云港、宿迁)2021届高三第二次调研检测考试化学试卷江苏省七市(南通、泰州、扬州、徐州、淮安、连云港、宿迁)2021届高三第二次调研考试化学试题(已下线)小题17 新型电解池装置 ——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)押山东卷第12题 电解池选择题-备战2021年高考化学临考题号押题(山东卷)江苏省镇江市镇江中学2020-2021学年高二下学期期中考试化学试题江苏省南京市大厂高级中学2020-2021学年高二下学期期中联考化学试题广东实验中学2021-2022学年高三上学期11月月考化学试题(已下线)专题06 电化学原理应用—2022年高考化学二轮复习讲练测(全国版)-测试天津市宁河区芦台第一中学2022届高三下学期线上模拟(一)化学试题河北省沧州市第一中学2021-2022学年上学期高三年级11月月考化学试题(已下线)易错点19 电化学基础-备战2023年高考化学考试易错题(已下线)专题十七选择题的解题策略巩固训练9江苏省华罗庚中学2023-2024学年高三夏令营学习能力测试化学试题江苏省镇江市丹阳市吕叔湘中学2023-2024学年高三上学期10月月考化学试题
解题方法
5 . 甲烷催化裂解是工业上制备乙炔的方法之一。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
C2H2(g)+ O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH3=-572 kJ·mol-1
则2CH4(g) C2H2(g)+3H2(g) ΔH=
C2H2(g)+3H2(g) ΔH=________ kJ·mol-1。
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用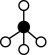 、
、 、
、 和
和 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________ (填字母)。

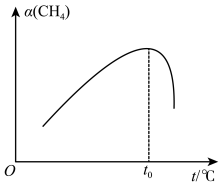
②在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(t)的关系如图所示,t0℃后CH4的转化率突减的原因可能是_______ 。
(3)甲烷分解体系中几种气体的平衡分压(p,单位为Pa)与温度(t,单位为℃)的关系如图所示:
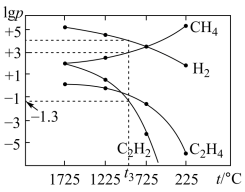
①t1℃时,向V L恒容密闭容器中充入0.12 mol CH4,只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为
C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为________ 。(保留3位有效数字)若改变温度至t2℃,CH4以0.01mol/(L· s)的平均速率增多,则t1________ t2(填“>”“=”或“<”)。
②在图中,t3℃时,化学反应2CH4(g) C2H2(g)+3H2(g)的压强平衡常数Kp=
C2H2(g)+3H2(g)的压强平衡常数Kp=____ 。
(4)工业上,以石墨为电极,电解亚铁氰化钾K4[Fe(CN)6]溶液可以制备铁氰化钾{K3[Fe(CN)6],可用于检验Fe2+},阳极的电极反应式为____________ 。
(5)设计如图实验探究牺牲阳极的阴极保护法原理:
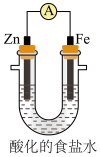
得出结论:①锌______ 保护铁;(填“能”或“不能”)
②产生蓝色沉淀可以得出铁被铁氰化钾氧化生成______ 。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
C2H2(g)+
 O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-12H2(g)+O2(g)=2H2O(l) ΔH3=-572 kJ·mol-1
则2CH4(g)
 C2H2(g)+3H2(g) ΔH=
C2H2(g)+3H2(g) ΔH=(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用
 、
、 、
、 和
和 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是
②在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(t)的关系如图所示,t0℃后CH4的转化率突减的原因可能是

(3)甲烷分解体系中几种气体的平衡分压(p,单位为Pa)与温度(t,单位为℃)的关系如图所示:

①t1℃时,向V L恒容密闭容器中充入0.12 mol CH4,只发生反应2CH4(g)
 C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为
C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为②在图中,t3℃时,化学反应2CH4(g)
 C2H2(g)+3H2(g)的压强平衡常数Kp=
C2H2(g)+3H2(g)的压强平衡常数Kp=(4)工业上,以石墨为电极,电解亚铁氰化钾K4[Fe(CN)6]溶液可以制备铁氰化钾{K3[Fe(CN)6],可用于检验Fe2+},阳极的电极反应式为
(5)设计如图实验探究牺牲阳极的阴极保护法原理:

| 操作 | 现象 |
| (i)取铁极附近的溶液于试管中,滴加铁氰化钾溶液 | 无明显现象 |
| (ii)在U形管铁极附近滴加铁氰化钾溶液 | 产生蓝色沉淀 |
②产生蓝色沉淀可以得出铁被铁氰化钾氧化生成
您最近一年使用:0次



