1 . 已知下列两个反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅰ的化学平衡常数 与温度的关系如下表所示:
与温度的关系如下表所示:
请回答下列问题:
(1)若反应Ⅱ的化学平衡常数为 ,则
,则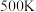 时,
时,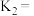
___________ 。
(2)反应Ⅰ的
___________ (填“>”、“<”或“=”)0,依据是:___________ 。
(3)温度为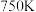 时,向某恒容密闭容器中通入一定量的
时,向某恒容密闭容器中通入一定量的 和
和 进行反应Ⅱ,下列能判断反应Ⅱ已达到平衡的依据是___________(填标号)。
进行反应Ⅱ,下列能判断反应Ⅱ已达到平衡的依据是___________(填标号)。
(4)工业上利用电解饱和食盐水制取 和
和 ,其化学方程式为:
,其化学方程式为:___________ ,电解结束后溶液
___________ (填“减小”、“不变”或“增大”)。
反应Ⅰ:

反应Ⅱ:

反应Ⅰ的化学平衡常数
 与温度的关系如下表所示:
与温度的关系如下表所示: | 500 | 750 | 1000 | 1300 |
 | 0.5 | 0.64 | 1 | 1.5 |
(1)若反应Ⅱ的化学平衡常数为
 ,则
,则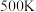 时,
时,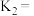
(2)反应Ⅰ的

(3)温度为
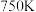 时,向某恒容密闭容器中通入一定量的
时,向某恒容密闭容器中通入一定量的 和
和 进行反应Ⅱ,下列能判断反应Ⅱ已达到平衡的依据是___________(填标号)。
进行反应Ⅱ,下列能判断反应Ⅱ已达到平衡的依据是___________(填标号)。| A.容器中的压强不再改变 |
| B.混合气体的密度不再改变 |
C.每断裂 键,同时断裂 键,同时断裂 键 键 |
D. |
 和
和 ,其化学方程式为:
,其化学方程式为:
您最近一年使用:0次
2 . 某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合K时,观察到电流表的指针发生了偏转。
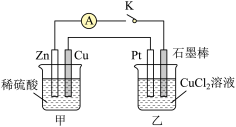
请回答下列问题。
(1)甲装置的名称是_______ ,装置乙中Pt为_______ 极。
(2)石墨电极的电极反应式为_______ 。
(3)当甲中产生 气体时,乙中产生的气体在标准状况下的体积为
气体时,乙中产生的气体在标准状况下的体积为_______ L。
(4)若乙中溶液不变,将其电极都换成铜电极,闭合K,一段时间后,乙中溶液的颜色_______ (填“变深”“变浅”或“无变化”)。
(5)若乙中电极不变,将其溶液换成 溶液,闭合K,一段时间后,乙中溶液的pH将
溶液,闭合K,一段时间后,乙中溶液的pH将_______ (填“增大”“减小”或“不变”)。

请回答下列问题。
(1)甲装置的名称是
(2)石墨电极的电极反应式为
(3)当甲中产生
 气体时,乙中产生的气体在标准状况下的体积为
气体时,乙中产生的气体在标准状况下的体积为(4)若乙中溶液不变,将其电极都换成铜电极,闭合K,一段时间后,乙中溶液的颜色
(5)若乙中电极不变,将其溶液换成
 溶液,闭合K,一段时间后,乙中溶液的pH将
溶液,闭合K,一段时间后,乙中溶液的pH将
您最近一年使用:0次
名校
解题方法
3 . 研究人员提出了一种基于 元素的电化学过程来合成氨,其工艺路线如图所示。下列说法不正确的是
元素的电化学过程来合成氨,其工艺路线如图所示。下列说法不正确的是
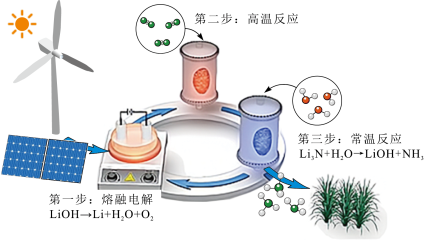
 元素的电化学过程来合成氨,其工艺路线如图所示。下列说法不正确的是
元素的电化学过程来合成氨,其工艺路线如图所示。下列说法不正确的是
A.第一步阳极反应式为 |
| B.第二步“高温反应”是氮的固定的一种形式 |
C.该工艺的总反应为 |
D.整个电化学合成氨过程中能循环利用的物质有 |
您最近一年使用:0次
2022-12-12更新
|
234次组卷
|
5卷引用:广东省揭阳市2021-2022学年高三上学期期末考试化学试题
4 . 对工业尾气中的氮氧化物、二氧化硫和氨气等进行综合应用,减少排放,让空气更加清洁是环境科学研究的重要课题之一,也是“打赢蓝天保卫战”的重要举措。回答下列问题:
(1)已知: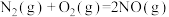
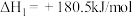

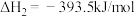
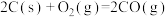
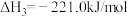
则

___________ 。
(2)科学探究得出汽油中挥发出来的烃类物质(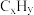 )能催化还原汽车尾气中的
)能催化还原汽车尾气中的 气体,从而消除
气体,从而消除 的污染,试写出该过程的化学方程式:
的污染,试写出该过程的化学方程式:___________ 。
(3)废气中的 经过净化后与空气混合进行催化氧化可制取硫酸,其中
经过净化后与空气混合进行催化氧化可制取硫酸,其中 发生催化氧化的反应为
发生催化氧化的反应为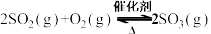 。往一恒容的密闭容器中通入
。往一恒容的密闭容器中通入 和
和 【其中
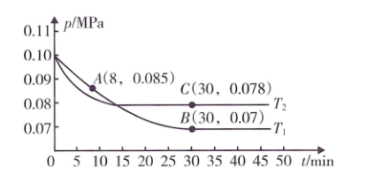
【其中 】,在不同温度下测得容器内总压强与反应时间的关系如下图所示。
】,在不同温度下测得容器内总压强与反应时间的关系如下图所示。
①对于反应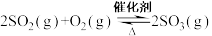 ,用压强表示的平衡常数表达式
,用压强表示的平衡常数表达式
___________ 。
②图中 点处
点处 的转化率为
的转化率为___________ 。
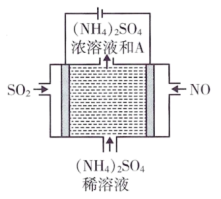
(4)废气中的 也可以通过电解法来除去,装置如图所示,请写出阳极的电极反应式:
也可以通过电解法来除去,装置如图所示,请写出阳极的电极反应式:___________ 。
(5)25℃时,某学习小组采用盐酸处理氨水时方法如下:将
 的氨水与
的氨水与 的盐酸等体积混合(混合后溶液总体积变化忽略不计),所得溶液中
的盐酸等体积混合(混合后溶液总体积变化忽略不计),所得溶液中 ,则此时溶液显
,则此时溶液显___________ (选填“酸”“碱”或“中”)性;用含 的代数式表示
的代数式表示 在该温度下的电离平衡常数
在该温度下的电离平衡常数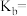
___________ 。
(1)已知:
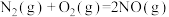
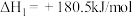

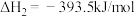
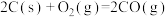
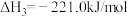
则


(2)科学探究得出汽油中挥发出来的烃类物质(
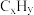 )能催化还原汽车尾气中的
)能催化还原汽车尾气中的 气体,从而消除
气体,从而消除 的污染,试写出该过程的化学方程式:
的污染,试写出该过程的化学方程式:(3)废气中的
 经过净化后与空气混合进行催化氧化可制取硫酸,其中
经过净化后与空气混合进行催化氧化可制取硫酸,其中 发生催化氧化的反应为
发生催化氧化的反应为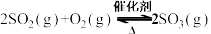 。往一恒容的密闭容器中通入
。往一恒容的密闭容器中通入 和
和 【其中
【其中 】,在不同温度下测得容器内总压强与反应时间的关系如下图所示。
】,在不同温度下测得容器内总压强与反应时间的关系如下图所示。
①对于反应
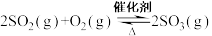 ,用压强表示的平衡常数表达式
,用压强表示的平衡常数表达式
②图中
 点处
点处 的转化率为
的转化率为(4)废气中的
 也可以通过电解法来除去,装置如图所示,请写出阳极的电极反应式:
也可以通过电解法来除去,装置如图所示,请写出阳极的电极反应式:
(5)25℃时,某学习小组采用盐酸处理氨水时方法如下:将

 的氨水与
的氨水与 的盐酸等体积混合(混合后溶液总体积变化忽略不计),所得溶液中
的盐酸等体积混合(混合后溶液总体积变化忽略不计),所得溶液中 ,则此时溶液显
,则此时溶液显 的代数式表示
的代数式表示 在该温度下的电离平衡常数
在该温度下的电离平衡常数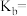
您最近一年使用:0次
5 . 用新型甲醇燃料电池电源电解硫酸铜溶液,下列有关说法正确的是


| A.甲醇一极的电极反应式为CH3OH-6e-+H2O=CO2↑+6H+ |
| B.若a为纯铜,b为粗铜,则该装置可用于粗铜的电解精炼 |
| C.若a、b均为石墨,b极反应为:4OH--4e-=2H2O+O2↑ |
| D.若a、b均为石墨,标准状况下消耗3.36L O2,则b极析出铜19.2g |
您最近一年使用:0次
2021-06-13更新
|
146次组卷
|
2卷引用:广东省揭阳市揭西县2023-2024学年高二上学期1月期末化学试题
6 . 电解Na2SO4溶液产生H2SO4和烧碱的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2。以下说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)

| A.产物丁为H2SO4 |
| B.a电极反应式:2H2O+2e-=H2↑+2OH- |
| C.离子交换膜d为阳离子交换膜 |
| D.每转移0.2 mol电子,产生1.12 L气体甲 |
您最近一年使用:0次
7 . (1)工业上以粗铜为原料采取如下图所示流程制备硝酸铜晶体:

①在步骤a中,还需要通入氧气和水,其目的是___________________________ 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在____________ 范围。
不用加水的方法调节溶液pH的原因是_______________________________________ 。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
_________________________________________________________________________ 。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是______________________ 。
(3)下图是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O ]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是__________ (填字母)。

a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3 NH
NH +NH
+NH ,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是______________________________________ ;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是______________________________________ 。

①在步骤a中,还需要通入氧气和水,其目的是
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
不用加水的方法调节溶液pH的原因是
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是
(3)下图是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O ]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是

a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3
 NH
NH +NH
+NH ,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
您最近一年使用:0次
8 . 按如图所示装置进行实验,并回答下列问题。

(1)甲池是_________ 池,通入CH3OH(甲醇)的电极作为_______ 极,电极反应式为________________________________________________ 。
(2)乙池是________ 池,A电极名称为______ 极,电极反应式为_______________________ ,乙池中的总反应化学方程式为________________________________ ,溶液的pH________ (填“增大”、“减小”或“不变”)。
(3)当甲池中消耗O2 0.56L(标准状况下)时,理论上乙池中B极的质量增加_______ g;此时丙装置中_____________ (填“c”或“d”)电极析出1.20g金属,则丙装置中的某盐溶液可能是________ (填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液

(1)甲池是
(2)乙池是
(3)当甲池中消耗O2 0.56L(标准状况下)时,理论上乙池中B极的质量增加
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
您最近一年使用:0次
名校
9 . 我国预计在2020年前后建成自己的载人空间站。为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如下图),实现了“太阳能一电能一化学能”转化,总反应方程式为2CO2=2CO+O2 。关于该装置的下列说法不正确的是

装置a 装置b
附:⊕表示阳离子,Θ表示阴离子

装置a 装置b
附:⊕表示阳离子,Θ表示阴离子
| A.装置a将太阳能转化为电能,装置b将电能转化为化学能 |
| B.工作过程中OH-向Y电极周围移动 |
| C.人体呼出的气体参与X电极的反应:CO2+2e-+H2O=CO+2OH- |
| D.反应完毕后恢复到原温度,装置b中电解质溶液的碱性减弱 |
您最近一年使用:0次
2018-01-30更新
|
932次组卷
|
3卷引用:广东省揭阳市2018届高三上学期期末学业水平考试化学试题
名校
解题方法
10 . 用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )
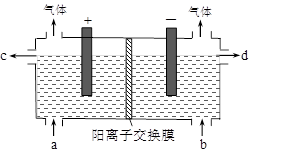

| A.通电后阳极区溶液pH增大 |
| B.阴极区的电极反应式为4OH-–4e-=O2↑+2H2O |
| C.当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成 |
| D.通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出 |
您最近一年使用:0次
2017-02-17更新
|
1067次组卷
|
9卷引用:广东省普宁市华美实验学校2017-2018学年高二上学期期末考试化学试题



