解题方法
1 . 完成下列问题
(1)写出Ni的元素名称_______ , 该元素在周期表的位置为第_______ 周期,第_______ 族。
(2)基态Si原子的电子排布式为_______ ,基态S原子的电子排布式为_______ 。
(3)写出基态Fe原子的价层电子排布式:_______ 。
(1)写出Ni的元素名称
(2)基态Si原子的电子排布式为
(3)写出基态Fe原子的价层电子排布式:
您最近一年使用:0次
解题方法
2 . 请根据构造原理,按要求写出下列电子排布式或原子结构示意图:
(1)16S的电子排布式___________ 。
(2)26Fe的简化电子排布式___________ 。
(3)某元素原子的电子排布式为[Ar]3d104s24p1,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
①该元素处于元素周期表的第___________ 周期。
②该元素处于元素周期表的第___________ 族。
③试推测该元素处于元素周期表的___________ 区。
(1)16S的电子排布式
(2)26Fe的简化电子排布式
(3)某元素原子的电子排布式为[Ar]3d104s24p1,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
①该元素处于元素周期表的第
②该元素处于元素周期表的第
③试推测该元素处于元素周期表的
您最近一年使用:0次
解题方法
3 . 下表是元素周期表的一部分,请回答:
(1)钠元素在元素周期表中的位置是___________ ;
(2)N、O、F三种元素中,非金属性最强的是___________ (填元素符号);
(3)由上表中两种元素组成的化合物是光导纤维的主要原料,该化合物的化学式为___________ ;
(4)碘与氯是同主族元素。下面关于碘的推断错误的是___________ (选填字母);
a.常温下,碘单质为气态 b.最高正化合价为+7 c.Cl2通入淀粉KI溶液中出现蓝色
(5)氮的氢化物和氯的氢化物反应生成一种铵盐,常用作氮肥,该反应的化学方程式为___________ 。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | ||||||||
| 2 | N | O | F | |||||
| 3 | Na | Si | Cl |
(1)钠元素在元素周期表中的位置是
(2)N、O、F三种元素中,非金属性最强的是
(3)由上表中两种元素组成的化合物是光导纤维的主要原料,该化合物的化学式为
(4)碘与氯是同主族元素。下面关于碘的推断错误的是
a.常温下,碘单质为气态 b.最高正化合价为+7 c.Cl2通入淀粉KI溶液中出现蓝色
(5)氮的氢化物和氯的氢化物反应生成一种铵盐,常用作氮肥,该反应的化学方程式为
您最近一年使用:0次
4 . 根据物质结构有关性质和特点,回答下列问题:
(1)钴位于元素周期表的___________ 。
(2)基态铝原子核外电子云轮廓图的形状有(填名称)___________ 。
(3)2020年新冠肺炎疫情席卷全球,酒精(CH3CH2OH)成为家庭必备品,乙醇分子中碳原子轨道的杂化类型是___________ 。
(4)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(III),是一种重要的配合物。该化合物中,所含非金属元素C的最高价氧化物的电子式为___________ ;Fe3+比Fe2+更稳定的原因___________ 。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________ 。
(6)高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为___________ ;
(1)钴位于元素周期表的
(2)基态铝原子核外电子云轮廓图的形状有(填名称)
(3)2020年新冠肺炎疫情席卷全球,酒精(CH3CH2OH)成为家庭必备品,乙醇分子中碳原子轨道的杂化类型是
(4)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(III),是一种重要的配合物。该化合物中,所含非金属元素C的最高价氧化物的电子式为
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为
(6)高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为
您最近一年使用:0次
解题方法
5 . 已知元素周期表中共有18个纵列,如图实线表示元素周期表的边界。按电子排布,可把周期表划分为几个区:s区、p区、d区、ds区等。除ds区外,其他区的名称来自按构造原理最后填入电子的能级符号。
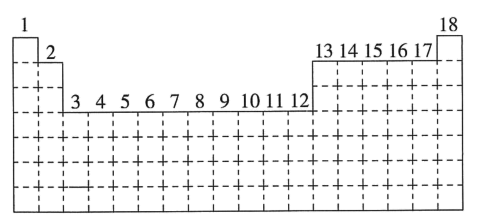
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影 和
和 表示d区和ds区
表示d区和ds区____ 。
(2)有的同学受这种划分的启发,认为d区内6、7纵列的部分元素可以排在另一区,你认为应排在_____ 区。
(3)请在元素周期表中用元素符号标出4s轨道处于半充满状态的元素____ 。

(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影
 和
和 表示d区和ds区
表示d区和ds区(2)有的同学受这种划分的启发,认为d区内6、7纵列的部分元素可以排在另一区,你认为应排在
(3)请在元素周期表中用元素符号标出4s轨道处于半充满状态的元素
您最近一年使用:0次
解题方法
6 . 请将表格补充完整:
| 原子电子排布式 | 族 | 周期 | 区 |
| ①1s22s22p63s2 | |||
| ②[Kr]4d105s25p2 | |||
| ③[Ar]3d14s2 | |||
| ④[Ar]3d104s1 |
您最近一年使用:0次
2022-08-28更新
|
912次组卷
|
2卷引用:第二节 原子结构与元素的性质 第1课时 原子结构与元素周期表
7 . 填空。
(1)某元素的原子序数为29,试回答下列问题:
①该元素基态原子的外围电子排布式是_______ ,有_______ 个未成对电子。
②它属于第_______ 周期_______ 族。
(2)元素金(Au)处于周期表中的第6周期,与Cu同族,Au原子外围电子排布式为_______ 。
(3)某元素原子的电子排布式为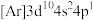 ,该元素处于元素周期表的第
,该元素处于元素周期表的第_______ 周期第_______ 族。
(4)某元素位于周期表中第4周期VA族,则该元素的名称是____ ,外围电子排布式为___ 。
(1)某元素的原子序数为29,试回答下列问题:
①该元素基态原子的外围电子排布式是
②它属于第
(2)元素金(Au)处于周期表中的第6周期,与Cu同族,Au原子外围电子排布式为
(3)某元素原子的电子排布式为
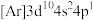 ,该元素处于元素周期表的第
,该元素处于元素周期表的第(4)某元素位于周期表中第4周期VA族,则该元素的名称是
您最近一年使用:0次
2022-08-22更新
|
201次组卷
|
2卷引用:专题2 原子结构与元素性质 第二单元 元素性质的递变规律 第1课时 原子核外电子排布的周期性
8 . 回答下列问题:
(1)硼酸(H3BO3)为一元弱酸,电离方程式H3BO3+H2O H++B(OH)
H++B(OH) 。已知:H3BO3的电离常数Ka=5.8×10−10,H2CO3的电离常数Ka1=4.4×10−7、Ka2=4.7×10−11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
。已知:H3BO3的电离常数Ka=5.8×10−10,H2CO3的电离常数Ka1=4.4×10−7、Ka2=4.7×10−11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式_______ 。
(2)已知戊烷(C5H12)的3种同分异构体的沸点数据如下表:
请从物质结构角度分析,正戊烷、异戊烷、新戊烷沸点依次降低的原因是_______ 。
(3)某第四周期元素位于元素周期表中的第六纵行,则该元素位于元素周期表中_______ 区(按电子排布分区),其基态原子的价电子轨道表达式为_______ 。
(1)硼酸(H3BO3)为一元弱酸,电离方程式H3BO3+H2O
 H++B(OH)
H++B(OH) 。已知:H3BO3的电离常数Ka=5.8×10−10,H2CO3的电离常数Ka1=4.4×10−7、Ka2=4.7×10−11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
。已知:H3BO3的电离常数Ka=5.8×10−10,H2CO3的电离常数Ka1=4.4×10−7、Ka2=4.7×10−11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式(2)已知戊烷(C5H12)的3种同分异构体的沸点数据如下表:
| 正戊烷 | 异戊烷 | 新戊烷 | |
| 沸点/℃ | 36.1 | 27.9 | 9.5 |
(3)某第四周期元素位于元素周期表中的第六纵行,则该元素位于元素周期表中
您最近一年使用:0次
名校
9 . 根据要求完成。
(1)基态氟原子氟原子有_______ 种不同能量的电子,价电子排布图为_______ 。
(2)已知锡位于第五周期,与C同主族,写出Sn2+的最外层电子排布式:_______ ; 中有
中有_______ 种运动状态不同的电子。
(3)基态硼原子的核外电子排布图为_______ 。
(4)基态K原子中,核外电子占据最高能层的符号是_______ ,占据该能层电子的电子云轮廓图形状为_______ 。
(5)锰元素在周期表中的位置为_______ ;属于_______ 区元素(填“s”“p”“d”“ds”或“f”)。铜、锌两种元素的第一电离能、第二电离能如表所示:
铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是_______ 。
(1)基态氟原子氟原子有
(2)已知锡位于第五周期,与C同主族,写出Sn2+的最外层电子排布式:
 中有
中有(3)基态硼原子的核外电子排布图为
(4)基态K原子中,核外电子占据最高能层的符号是
(5)锰元素在周期表中的位置为
电离能/ |  |  |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
您最近一年使用:0次
名校
10 . 许多金属及其化合物在生活、化工、医药、材料等各个领域有着广泛的应用。
(1)钛美誉为“未来钢铁”“战略金属”。基态钛原子中电子占据最高能级的符号为____ 。
(2)镓在周期表中的位置____ 。
(3)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因是____ 。
(4)下列Li原子电子排布图表示的状态中,能量最高的为____ (填字母)。
A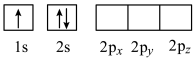 . B.
. B. 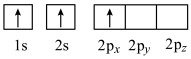 C.
C.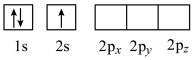
(5)Li+与H-具有相同的电子层结构,r(Li+)小于r(H-),原因是____ 。
(1)钛美誉为“未来钢铁”“战略金属”。基态钛原子中电子占据最高能级的符号为
(2)镓在周期表中的位置
(3)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因是
(4)下列Li原子电子排布图表示的状态中,能量最高的为
A
 . B.
. B.  C.
C.
(5)Li+与H-具有相同的电子层结构,r(Li+)小于r(H-),原因是
您最近一年使用:0次



