1 . 某元素基态原子的价电子排布为3d74s2,该元素在周期表中的位置是第_______ 周期,第_______ 族,该元素位于_______ 区。
您最近一年使用:0次
名校
2 . 已知 的3d轨道上有6个电子,试回答:
的3d轨道上有6个电子,试回答:
(1)M元素原子的核外电子排布式为_______ 。
(2)M元素在元素周期表中的位置为_______ 。
(3)M的基态原子共有_______ 种不同能级的电子,该原子最外层电子数为_______ ,价层电子数为_______ 。
(4)某元素原子的基态电子排布式为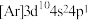 ,该元素处于元素周期表的第
,该元素处于元素周期表的第_______ 周期第_______ 族。试推测该元素处于元素周期表的_______ 区,该元素原子的价电子排布图为_______ 。
(5)与M元素相对比,铬(Cr)元素的原子核外电子排布有其特点,请写出Cr基态原子核外电子排布式_______ 。
 的3d轨道上有6个电子,试回答:
的3d轨道上有6个电子,试回答:(1)M元素原子的核外电子排布式为
(2)M元素在元素周期表中的位置为
(3)M的基态原子共有
(4)某元素原子的基态电子排布式为
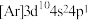 ,该元素处于元素周期表的第
,该元素处于元素周期表的第(5)与M元素相对比,铬(Cr)元素的原子核外电子排布有其特点,请写出Cr基态原子核外电子排布式
您最近一年使用:0次
名校
3 . 已知元素周期表中共有18纵行,如图实线表示元素周期表的边界。按电子排布,可把周期表里的元素划分为几个区:s区、p区、d区、ds区等。除ds区外,其他区的名称来自按构造原理最后填入的电子的能级符号。
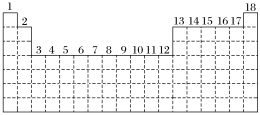
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影 和
和 表示d区和ds区。
表示d区和ds区。_______
(2)有的同学受这种划分的启发,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在_______ 区。
(3)请在元素周期表中用元素符号标出4s轨道半充满的元素。_________
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因:_______ 。
(5)随着科学技术的发展,不断有新的元素被发现。若把第七周期排满,则元素周期表共可以排布_______ 种元素。

(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影
 和
和 表示d区和ds区。
表示d区和ds区。(2)有的同学受这种划分的启发,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在
(3)请在元素周期表中用元素符号标出4s轨道半充满的元素。
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因:
(5)随着科学技术的发展,不断有新的元素被发现。若把第七周期排满,则元素周期表共可以排布
您最近一年使用:0次
4 . 分析下列图表,回答问题。
(1)N、Al、Si、Ge四种元素中,某种元素的电离能数据如下:
则该元素是_______ (填写元素符号)。
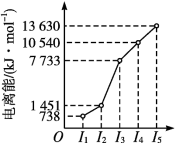
(2)短周期某主族元素M的电离能情况如图所示。则M元素位于周期表的第_______ 族。
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价层电子排布式:_______ ,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_______ 。
(1)N、Al、Si、Ge四种元素中,某种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | …… |
| In/( kJ∙mol−1) | 578 | 1 817 | 2 745 | 11 575 | …… |
(2)短周期某主族元素M的电离能情况如图所示。则M元素位于周期表的第

(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| I1 | 717 | 759 | |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
您最近一年使用:0次
5 . 合成氨是人类科学技术发展史上的一项重大成就,是化学和技术对社会发展与进步的巨大贡献。
(1)基态氮原子中,能量最高的电子的电子云在空间有_______ 个伸展方向。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为_______ 。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、
、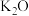 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。
①Cr原子的价电子排布图为_______ ;第四周期ds区元素中,与基态Cr原子最外层电子数目相同的元素的元素符号为_______ 。
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有_______ (填元素符号)
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①Mn在元素周期表中的位置_______ ,基态Mn原子未成对的电子数为_______ 。
②第三电离能
_______ 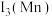 (填“>”或“<”),原因是
(填“>”或“<”),原因是_______ 。
(1)基态氮原子中,能量最高的电子的电子云在空间有
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
 、
、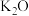 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。①Cr原子的价电子排布图为
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①Mn在元素周期表中的位置
②第三电离能

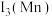 (填“>”或“<”),原因是
(填“>”或“<”),原因是
您最近一年使用:0次
2023-02-14更新
|
670次组卷
|
3卷引用:山东省泰安市2022-2023学年高二上学期期末考试化学试题
6 . I.2020年12月17日,我国“嫦娥五号”返回器携月壤成功着陆。研究发现,月壤中存在天然的铁、金、银、铅、锌、铜、锑、铼等矿物颗粒。
(1)写出铜的基态原子的电子排布式:______ 。
(2)基态Fe原子有______ 个未成对电子,Fe3+的电子排布式为______ 。
(3)Fe在周期表中位于第______ 周期第______ 族,属于______ 区。
Ⅱ.回答下列问题:
(4)p电子的原子轨道呈______ 形。
(5)基态Al3+核外共有______ 种不同运动状态的电子。
(6)钒(V)元素广泛用于催化及钢铁工业,其价层电子的轨道表示式为_______ 。
(1)写出铜的基态原子的电子排布式:
(2)基态Fe原子有
(3)Fe在周期表中位于第
Ⅱ.回答下列问题:
(4)p电子的原子轨道呈
(5)基态Al3+核外共有
(6)钒(V)元素广泛用于催化及钢铁工业,其价层电子的轨道表示式为
您最近一年使用:0次
名校
解题方法
7 . 一氯化碘(ICl)是一种卤素互化物,与卤素单质性质相似,可用于制农药等。
(1)Cl在元素周期表中位于第三周期、第_______ 族。
(2)Cl的最高价氧化物对应的水化物为HClO4,其中Cl元素的化合价为_______ 价。
(3)Cl的非金属性强于I的,用原子结构解释原因:Cl和I位于同一主族,最外层电子数相同,_______ ,得电子能力Cl强于I。
(4)下列推断中,正确的是_______ (填字母)。
a.ICl有氧化性
b.热稳定性:HI>HCl
c.I的最高价氧化物对应的水化物为HIO4
(1)Cl在元素周期表中位于第三周期、第
(2)Cl的最高价氧化物对应的水化物为HClO4,其中Cl元素的化合价为
(3)Cl的非金属性强于I的,用原子结构解释原因:Cl和I位于同一主族,最外层电子数相同,
(4)下列推断中,正确的是
a.ICl有氧化性
b.热稳定性:HI>HCl
c.I的最高价氧化物对应的水化物为HIO4
您最近一年使用:0次
2023-01-17更新
|
268次组卷
|
2卷引用:北京市2022-2023学年高二上学期第二次合格考化学试题
名校
8 . 下表中阿拉伯数字(1、2……)是元素周期表中行或列的序号。请参照元素A~I在周期表中的位置,回答下列问题。
(1)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素以原子个数之比为1∶1和1∶2形成两种离子化合物Z和M。写出Z与Y反应的化学方程式:_______ 。
(2)I元素在周期表中的位置是第_______ 周期、第_______ 族。
(3)实验室中采用下图所示装置模拟工业上同时制取元素A和I的单质的过程。
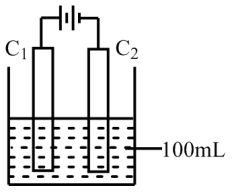
①写出电极C1上发生反应的电极反应式_______ 。
②当电极上产生112 mL(标准状况)元素I的单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=_______ 。(Kw=1.0×10-14)
纵行 横行 | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I |
(1)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素以原子个数之比为1∶1和1∶2形成两种离子化合物Z和M。写出Z与Y反应的化学方程式:
(2)I元素在周期表中的位置是第
(3)实验室中采用下图所示装置模拟工业上同时制取元素A和I的单质的过程。

①写出电极C1上发生反应的电极反应式
②当电极上产生112 mL(标准状况)元素I的单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=
您最近一年使用:0次
9 . 下表列出了①~④四种元素在周期表中的位置.
回答下列问题:
(1)①的元素符号为_____________ 。
(2)②的基态原子电子排布式为__________________________ 。
(3)③和④中原子半径较大的是_____________ (填元素符号)。
(4)如图是③原子中s电子和p电子的电子云轮廓图。s电子的电子云形状为_____________ 形;每个p能级都有_____________ 个相互垂直的电子云。

| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | |||||||
| 3 | ② | ③ | ||||||
| 4 | ④ |
回答下列问题:
(1)①的元素符号为
(2)②的基态原子电子排布式为
(3)③和④中原子半径较大的是
(4)如图是③原子中s电子和p电子的电子云轮廓图。s电子的电子云形状为

您最近一年使用:0次
名校
解题方法
10 . 为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、 ”元素的代言人。回答下列问题:
”元素的代言人。回答下列问题:
(1)据汞的原子结构示意图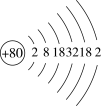 汞在第
汞在第___________ 周期。
(2)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷 也是氮族元素。
也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是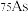 ,它的中子数为
,它的中子数为___________ 。
②已知 与
与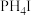 的性质相似,则对
的性质相似,则对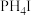 性质的推测不正确的是
性质的推测不正确的是___________ (填序号)。
a、含有离子键和共价键
b、能与 溶液反应
溶液反应
c、与 加热充分分解产物的种类完全一样
加热充分分解产物的种类完全一样
③砷酸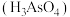 可用于制造杀虫剂、药物。
可用于制造杀虫剂、药物。 溶于稀硝酸中可得砷酸,此反应的化学方程式:
溶于稀硝酸中可得砷酸,此反应的化学方程式:___________ 。
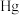 ”元素的代言人。回答下列问题:
”元素的代言人。回答下列问题:(1)据汞的原子结构示意图
 汞在第
汞在第(2)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷
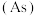 也是氮族元素。
也是氮族元素。①砷有多种同位素原子,其中稳定的核素是
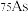 ,它的中子数为
,它的中子数为②已知
 与
与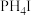 的性质相似,则对
的性质相似,则对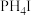 性质的推测不正确的是
性质的推测不正确的是a、含有离子键和共价键
b、能与
 溶液反应
溶液反应c、与
 加热充分分解产物的种类完全一样
加热充分分解产物的种类完全一样③砷酸
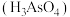 可用于制造杀虫剂、药物。
可用于制造杀虫剂、药物。 溶于稀硝酸中可得砷酸,此反应的化学方程式:
溶于稀硝酸中可得砷酸,此反应的化学方程式:
您最近一年使用:0次
2022-12-28更新
|
141次组卷
|
2卷引用:河南省商丘市第一高级中学2022-2023学年高二上学期期末考试化学试题



