解题方法
1 . 亚硫酰氯( )在医药、农药合成领域有广泛的应用。
)在医药、农药合成领域有广泛的应用。
(1) 含有S、O、Cl三种元素,其中位于元素周期表中第二周期的元素是
含有S、O、Cl三种元素,其中位于元素周期表中第二周期的元素是_______ 。
(2)Cl的非金属性强于S的非金属性。
①用原子结构解释:Cl和S位于元素周期表中同一周期,原子核外电子层数相同,核电荷数Cl大于S,原子半径_______ ,得电子能力Cl强于S。
②用实验事实验证:将 通入
通入 溶液中,生成淡黄色沉淀。淡黄色沉淀是
溶液中,生成淡黄色沉淀。淡黄色沉淀是_______ 。
(3)下列关于 的说法正确的是
的说法正确的是_______ (填字母)。
a.属于化合物 b.摩尔质量为119 g·mol
 )在医药、农药合成领域有广泛的应用。
)在医药、农药合成领域有广泛的应用。(1)
 含有S、O、Cl三种元素,其中位于元素周期表中第二周期的元素是
含有S、O、Cl三种元素,其中位于元素周期表中第二周期的元素是(2)Cl的非金属性强于S的非金属性。
①用原子结构解释:Cl和S位于元素周期表中同一周期,原子核外电子层数相同,核电荷数Cl大于S,原子半径
②用实验事实验证:将
 通入
通入 溶液中,生成淡黄色沉淀。淡黄色沉淀是
溶液中,生成淡黄色沉淀。淡黄色沉淀是(3)下列关于
 的说法正确的是
的说法正确的是a.属于化合物 b.摩尔质量为119 g·mol

您最近一年使用:0次
23-24高二上·浙江杭州·期末
2 . 氧(O)、硫(S)、硒、碲(Te)、钋(Po)、鉝(Lv)为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1)硒_______ (填元素符号);鉝(Lv)_______ (填原子序数);
(2)碲有多种同位素原子,其中的核素是128 Te,它的中子数为_______ ;
(3)还原性:H2O_______ H2S (填">"或"<")
(4)氧常见的氢化物有两种,双氧水(H2O2)和水。双氧水在实验室和实际生产生活都有重要的作用。
①写出H2O2的电子式:_______ 。
②金属Al加到双氧水与NaOH的混合溶液中,金属Al溶解,写出反应的离子方程式_______ ;
③S2Cl2有类似于H2O2的性质,该物质遇水不稳定,生成一种黄色沉淀和无色有刺激性气味的气体,还得到一种强酸溶液,试写出该过程的反应方程式_______ ;
④实验室制氧气有多种方法,下列反应可以用来实验室制氧气的是_______ 。
A.氯酸钾加少量高锰酸钾受热分解
B.双氧水加二氧化锰
C.过氧化钠加水
D.过氧化钠中通二氧化碳
E.次氯酸受热分解
(1)硒
(2)碲有多种同位素原子,其中的核素是128 Te,它的中子数为
(3)还原性:H2O
(4)氧常见的氢化物有两种,双氧水(H2O2)和水。双氧水在实验室和实际生产生活都有重要的作用。
①写出H2O2的电子式:
②金属Al加到双氧水与NaOH的混合溶液中,金属Al溶解,写出反应的离子方程式
③S2Cl2有类似于H2O2的性质,该物质遇水不稳定,生成一种黄色沉淀和无色有刺激性气味的气体,还得到一种强酸溶液,试写出该过程的反应方程式
④实验室制氧气有多种方法,下列反应可以用来实验室制氧气的是
A.氯酸钾加少量高锰酸钾受热分解
B.双氧水加二氧化锰
C.过氧化钠加水
D.过氧化钠中通二氧化碳
E.次氯酸受热分解
您最近一年使用:0次
23-24高二上·浙江·期末
解题方法
3 . 为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:
(1)据汞的原子结构示意图,汞在第_______ 周期。

(2)硒(Se)与硫位于同主族,均是生命必需元素。下列推断不正确的是_______ 。
a.硒元素的最低负化合价为-2
b.二氧化硒(SeO2)具有还原性
c.硒的氧化物对应的水化物属于强酸
(3)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是75As,它的中子数为_______ 。
②已知NH4Cl与PH4I的性质相似,则对PH4I性质的推测不正确的是_______ (填序号)。
a.含有离子键和共价键 b.能与NaOH溶液反应
c.与NH4Cl加热充分分解产物的种类完全一样
③下列关于第VA族元素及其化合物的说法不正确的是_______ (填字母)。
a.热稳定性:NH3>PH3
b.酸性:HNO3>H3AsO4
c. As的氧化物的水化物是强碱
d.形成的简单离子半径随着原子序数递增而增大
(1)据汞的原子结构示意图,汞在第

(2)硒(Se)与硫位于同主族,均是生命必需元素。下列推断不正确的是
a.硒元素的最低负化合价为-2
b.二氧化硒(SeO2)具有还原性
c.硒的氧化物对应的水化物属于强酸
(3)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是75As,它的中子数为
②已知NH4Cl与PH4I的性质相似,则对PH4I性质的推测不正确的是
a.含有离子键和共价键 b.能与NaOH溶液反应
c.与NH4Cl加热充分分解产物的种类完全一样
③下列关于第VA族元素及其化合物的说法不正确的是
a.热稳定性:NH3>PH3
b.酸性:HNO3>H3AsO4
c. As的氧化物的水化物是强碱
d.形成的简单离子半径随着原子序数递增而增大
您最近一年使用:0次
4 . 回答下列问题:
(1)第四周期中,未成对电子数最多的元素是_______ 。(填名称)
(2)它位于第_______ 族。
(3)核外电子排布式是_______ 。
(4)它有_______ 个能层,_______ 个能级,_______ 种运动状态不同的电子。
(5)价电子排布图_______ 。
(6)属于_______ 区。
(1)第四周期中,未成对电子数最多的元素是
(2)它位于第
(3)核外电子排布式是
(4)它有
(5)价电子排布图
(6)属于
您最近一年使用:0次
5 . 回答下列问题:
(1)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为_______ 。SiCl4可发生水解反应,机理如下:
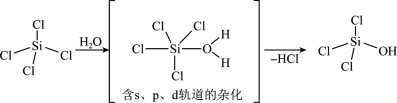
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为_______ (填标号)。
(2)四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
请回答下列问题:
①元素Z位于周期表中第_______ 周期_______ 族;
②X、Y两元素的氢化物中,水溶液呈碱性的是_______ (写化学式)
③Y和Z的氢化物中,较稳定的是_______ (填化学式)。
④Y的最高价氧化物对应水化物的化学式为_______ 。
(1)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为

含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为
(2)四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X | Y | |
| Z | W |
①元素Z位于周期表中第
②X、Y两元素的氢化物中,水溶液呈碱性的是
③Y和Z的氢化物中,较稳定的是
④Y的最高价氧化物对应水化物的化学式为
您最近一年使用:0次
6 . 完成下列问题:
(1)N、O、Mg、Al、S、Fe是常见的六种元素,按要求回答下列问题:
①Fe位于元素周期表第_____ 周期第_____ 族。
②基态N原子核外电子排布式为_____ ;基态O原子核外有_____ 种运动状态的电子。
③基态S原子核外电子占据的最高能级的电子云轮廓图为_____ 形。
④Mg、Al两种元素中第一电离能较大的是_____ 填元素符号)。
(2)几种元素的电负性数据如表:
①AlBr3的熔点_____ AlF3的熔点(填“大于”、“小于”或“等于”),原因是_____ 。
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为_____ 。
(1)N、O、Mg、Al、S、Fe是常见的六种元素,按要求回答下列问题:
①Fe位于元素周期表第
②基态N原子核外电子排布式为
③基态S原子核外电子占据的最高能级的电子云轮廓图为
④Mg、Al两种元素中第一电离能较大的是
(2)几种元素的电负性数据如表:
| O | F | Al | Br | …… |
| 3.5 | 4.0 | 1.5 | 2.8 | …… |
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为
您最近一年使用:0次
7 . 黑火药的爆炸反应原理为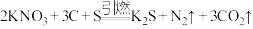 。请回答下列问题:
。请回答下列问题:
(1)基态 原子核外有
原子核外有___________ 种空间运动状态的电子。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为___________ 。
(3)K位于周期表的___________ 区;基态钾离子的电子占据的最高能层符号是___________ 。
(4) 与
与 具有相同的电子构型,
具有相同的电子构型,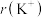 小于
小于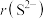 ,原因是
,原因是___________ 。
(5)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是___________ 。
a.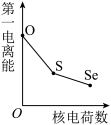 b.
b.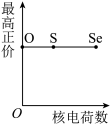 c.
c.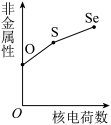 d.
d.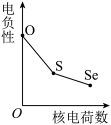
(6)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能 。
。 的Born-Haber循环如图所示。
的Born-Haber循环如图所示。

由图可知, 原子的第二电离能为
原子的第二电离能为___________  ;
; 键的键能为
键的键能为___________  ;氧原子的第一电子亲和能为
;氧原子的第一电子亲和能为___________  ;
; 的晶格能为
的晶格能为___________  。
。
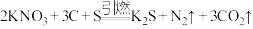 。请回答下列问题:
。请回答下列问题:(1)基态
 原子核外有
原子核外有(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为(3)K位于周期表的
(4)
 与
与 具有相同的电子构型,
具有相同的电子构型,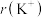 小于
小于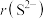 ,原因是
,原因是(5)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是
a.
 b.
b. c.
c. d.
d.
(6)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能
 。
。 的Born-Haber循环如图所示。
的Born-Haber循环如图所示。
由图可知,
 原子的第二电离能为
原子的第二电离能为 ;
; 键的键能为
键的键能为 ;氧原子的第一电子亲和能为
;氧原子的第一电子亲和能为 ;
; 的晶格能为
的晶格能为 。
。
您最近一年使用:0次
8 . 立方砷化硼具有高载流子迁移率,超越硅的导热、导电性能,有望成为硅基元器件的替代方案,其晶胞结构如图所示,请回答下列问题:
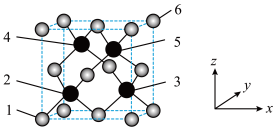
(1)As在元素周期表中的位置是_______ 。As属于_______ 区元素。
(2)该晶胞的化学式为_______ 。2、3、4、5四个原子所围成的空间结构为_______ 形。
(3)晶胞有两个基本要素。
①原子坐标参数,表示晶胞内部各原子的相对位置,图中1号原子的坐标参数为 ,6号原子的坐标参数为
,6号原子的坐标参数为 ,则2号原子的坐标参数为
,则2号原子的坐标参数为_______ 。
②晶胞参数是用来描述晶胞大小和形状的,设该晶胞的晶胞参数为a pm,阿伏加德罗常数为 ,则B、As原子之间的最短距离为
,则B、As原子之间的最短距离为_______ pm,该晶胞的密度为_______  。
。

(1)As在元素周期表中的位置是
(2)该晶胞的化学式为
(3)晶胞有两个基本要素。
①原子坐标参数,表示晶胞内部各原子的相对位置,图中1号原子的坐标参数为
 ,6号原子的坐标参数为
,6号原子的坐标参数为 ,则2号原子的坐标参数为
,则2号原子的坐标参数为②晶胞参数是用来描述晶胞大小和形状的,设该晶胞的晶胞参数为a pm,阿伏加德罗常数为
 ,则B、As原子之间的最短距离为
,则B、As原子之间的最短距离为 。
。
您最近一年使用:0次
9 . 某元素基态原子的价电子排布为3d74s2,该元素在周期表中的位置是第_______ 周期,第_______ 族,该元素位于_______ 区。
您最近一年使用:0次
名校
10 . 已知 的3d轨道上有6个电子,试回答:
的3d轨道上有6个电子,试回答:
(1)M元素原子的核外电子排布式为_______ 。
(2)M元素在元素周期表中的位置为_______ 。
(3)M的基态原子共有_______ 种不同能级的电子,该原子最外层电子数为_______ ,价层电子数为_______ 。
(4)某元素原子的基态电子排布式为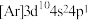 ,该元素处于元素周期表的第
,该元素处于元素周期表的第_______ 周期第_______ 族。试推测该元素处于元素周期表的_______ 区,该元素原子的价电子排布图为_______ 。
(5)与M元素相对比,铬(Cr)元素的原子核外电子排布有其特点,请写出Cr基态原子核外电子排布式_______ 。
 的3d轨道上有6个电子,试回答:
的3d轨道上有6个电子,试回答:(1)M元素原子的核外电子排布式为
(2)M元素在元素周期表中的位置为
(3)M的基态原子共有
(4)某元素原子的基态电子排布式为
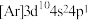 ,该元素处于元素周期表的第
,该元素处于元素周期表的第(5)与M元素相对比,铬(Cr)元素的原子核外电子排布有其特点,请写出Cr基态原子核外电子排布式
您最近一年使用:0次



