名校
1 . 金属钛被誉为“二十一世纪金属”。回答下列问题:
(1)钛在周期表中的位置___________ ,位于元素周期表中___________ 区,钛原子核外有___________ 种空间运动状态不同的电子,Ti2+电子占据的最高能层的电子排布式为___________ 。
(2)TiO2的晶胞如图所示,则该晶体的密度为___________ g⋅cm-3 (设阿伏加德罗常数的值为NA,用含a、b、NA的代数式表示)。
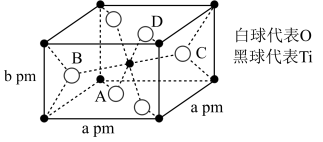
(1)钛在周期表中的位置
(2)TiO2的晶胞如图所示,则该晶体的密度为

您最近一年使用:0次
名校
2 . 元素在周期表中的位置,反映了元素的原子结构和性质。如图是元素周期表的一部分,请按照要求回答下列问题:
(1)①的元素符号是______ ,元素②位于周期表中的第______ 周期第______ 族。
(2)②、③两种元素中,非金属性较强的是______ (填元素符号)
(3)①、②、④三种元素中,原子半径最大的是______ (填元素符号)。
(4)④、⑤两种元素中最高价氧化物对应的水化物,属于两性氢氧化物的是______ (填化学式)。
(5)常温下,将元素⑥的单质通入 溶液中可制得漂白液,其有效成分是
溶液中可制得漂白液,其有效成分是 ,请写出该反应的离子方程式
,请写出该反应的离子方程式______
| 族 周期 | IA | 0 | ||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | |||||
(2)②、③两种元素中,非金属性较强的是
(3)①、②、④三种元素中,原子半径最大的是
(4)④、⑤两种元素中最高价氧化物对应的水化物,属于两性氢氧化物的是
(5)常温下,将元素⑥的单质通入
 溶液中可制得漂白液,其有效成分是
溶液中可制得漂白液,其有效成分是 ,请写出该反应的离子方程式
,请写出该反应的离子方程式
您最近一年使用:0次
2023-06-08更新
|
192次组卷
|
2卷引用:云南省宣威市第三中学2023-2024学年高二上学期第二次月考化学试题
解题方法
3 . 水泥是人类最伟大的发明之一,主要成分为硅酸三钙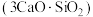 。将其与适量的水反应,形成相互交联的结构,发生的反应为
。将其与适量的水反应,形成相互交联的结构,发生的反应为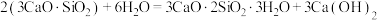 。回答下列问题:
。回答下列问题:
(1)为了加快硅酸三钙与水的反应速率,可采用的方式为_______ (填一种即可)。
(2)Si在元素周期表中的位置为_______ 。
(3) 的电子式为
的电子式为_______ , 的空间结构为
的空间结构为_______ 。
(4)元素C、O、Si、Ca的原子半径由大到小的顺序为_______ 。
(5)带有玻璃塞的磨口玻璃瓶不能用来盛装NaOH溶液的原因为_______ (用化学方程式表示)。
(6)写出 在农业上的一种用途:
在农业上的一种用途:_______ 。
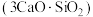 。将其与适量的水反应,形成相互交联的结构,发生的反应为
。将其与适量的水反应,形成相互交联的结构,发生的反应为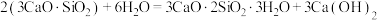 。回答下列问题:
。回答下列问题:(1)为了加快硅酸三钙与水的反应速率,可采用的方式为
(2)Si在元素周期表中的位置为
(3)
 的电子式为
的电子式为 的空间结构为
的空间结构为(4)元素C、O、Si、Ca的原子半径由大到小的顺序为
(5)带有玻璃塞的磨口玻璃瓶不能用来盛装NaOH溶液的原因为
(6)写出
 在农业上的一种用途:
在农业上的一种用途:
您最近一年使用:0次
2023-06-07更新
|
69次组卷
|
2卷引用:陕西省西安市选课分科摸底考2023-2024学年高二下学期4月月考化学试题
4 . 人类赖以生存的大千世界是由众多物质组成的,而数量如此庞大的物质却仅由百余种化学元素组成。我们要探索元素性质的递变规律,理解原子是如何通过相互作用构建物质。
(1)下列说法不正确的是__________
(2)下列说法正确的是___________
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4,Ni(CO)4呈正四面体形,Ni(CO)4易溶于下列物质中的__________
(4)氯原子最外层电子的原子轨道有___________ 种不同的伸展方向。
(5)写出与氯同周期,有3个未成对电子的基态原子的价电子轨道表示式为:___________ 。
(6)元素周期表中与氧元素相邻,且第一电离能比氧大的元素是___________ (填元素符号),它们与氧元素电负性由大到小的顺序为___________ 。
(7)根据价层电子对互斥理论判断下列问题:H2S中心原子的杂化方式为___________ 杂化,VSEPR构型为___________ ,分子的立体构型为___________ 。
(8)海洋元素中的氯、溴、碘统称为海水中的卤素资源,它们的化学性质既有相似性,也体现其递变性,用原子结构理论解释原因___________ 。
(1)下列说法不正确的是__________
A. 键是原子轨道以“肩并肩”方式相互重叠而形成的 键是原子轨道以“肩并肩”方式相互重叠而形成的 |
B.2个原子形成的多重共价键中,只能有一个是 键,而 键,而 键可以是一个或多个 键可以是一个或多个 |
C.s电子与s电子间形成的键是 键,p电子与p电子间形成的键是 键,p电子与p电子间形成的键是 键 键 |
| D.共价键一定有原子轨道的重叠 |
| A.氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少 |
| B.最外层电子数为ns2的元素都在元素周期表第2列 |
C.处于最低能量的原子叫做基态原子,1s22s22p →1s22s22p →1s22s22p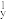 过程中形成的是发射光谱 过程中形成的是发射光谱 |
| D.已知某元素+3价基态离子的核外电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期ⅥB族位置,属于d区 |
| A.水 | B.CCl4 | C.苯 | D.NiSO4溶液 |
(5)写出与氯同周期,有3个未成对电子的基态原子的价电子轨道表示式为:
(6)元素周期表中与氧元素相邻,且第一电离能比氧大的元素是
(7)根据价层电子对互斥理论判断下列问题:H2S中心原子的杂化方式为
(8)海洋元素中的氯、溴、碘统称为海水中的卤素资源,它们的化学性质既有相似性,也体现其递变性,用原子结构理论解释原因
您最近一年使用:0次
名校
5 . 消毒剂在新冠疫情期间具有重要作用。消毒剂除了常见的有体积分数75%的医用酒精、漂白液溶液,还有高铁酸钾。
I.高铁酸钾 是一种比
是一种比 、
、 和
和 的氧化能力强的强氧化剂和消毒剂。
的氧化能力强的强氧化剂和消毒剂。
(1)下列基态原子或离子的电子排布式或排布图中,违反洪特规则的是_______ ;违反泡利原理的是_______ 。
① :
: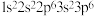
② :
: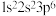
③P:
④Fe:
⑤ :
: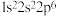
⑥C: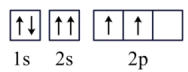
(2)高铁酸钾在水质处理中发挥着重要作用。查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:_______ 。
Ⅱ、关于原子表示时,我们也用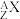 格式表示原子:请回答以下问题
格式表示原子:请回答以下问题
(3)中性原子的中子数N=_______ 。(用A和Z表示)
(4)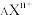 共有X个电子,则该阳离子的中子数N=
共有X个电子,则该阳离子的中子数N=_______ 。(用A、X、n表示)
Ⅲ、喷洒家用“84”消毒液是预防病毒的有效方法,某实验小组探究某品牌“84”消毒液的性质,取某品牌“84”消毒液5mL进行如表实验。
(5)写出实验室制备“84”消毒液反应的化学方程式:_______ 。
(6)查阅资料:酚酞的变色范围为8.2~10.0,且酚酞在强碱性溶液中红色会褪去。为探究操作a中溶液褪色的原因,又补充了如下实验(请将横线内容补充完整)。
获得结论:此实验小组使用的上述消毒液具有_______ 性。
I.高铁酸钾
 是一种比
是一种比 、
、 和
和 的氧化能力强的强氧化剂和消毒剂。
的氧化能力强的强氧化剂和消毒剂。(1)下列基态原子或离子的电子排布式或排布图中,违反洪特规则的是
①
 :
: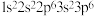
②
 :
: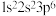
③P:

④Fe:

⑤
 :
: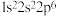
⑥C:

(2)高铁酸钾在水质处理中发挥着重要作用。查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:
Ⅱ、关于原子表示时,我们也用
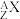 格式表示原子:请回答以下问题
格式表示原子:请回答以下问题(3)中性原子的中子数N=
(4)
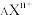 共有X个电子,则该阳离子的中子数N=
共有X个电子,则该阳离子的中子数N=Ⅲ、喷洒家用“84”消毒液是预防病毒的有效方法,某实验小组探究某品牌“84”消毒液的性质,取某品牌“84”消毒液5mL进行如表实验。
| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 |  ,溶液变红,5min后褪色 ,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(6)查阅资料:酚酞的变色范围为8.2~10.0,且酚酞在强碱性溶液中红色会褪去。为探究操作a中溶液褪色的原因,又补充了如下实验(请将横线内容补充完整)。
| 操作 | 现象 |
| 取 | 溶液变红,30min后褪色 |
您最近一年使用:0次
名校
解题方法
6 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂、钛酸锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。Li位于周期表中_____ 区;基态Ti原子的价电子排布式为_____ ;基态Fe3+、Fe2+离子中未成对的电子数之比为_____ 。
您最近一年使用:0次
名校
7 . 如图是元素周期表的一部分:

(1)写出元素①的元素符号___________ ,与①同周期的主族元素中,第一电离能比①大的有___________ 种。该周期的某种元素基态原子的核外电子排布式为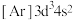 ,则该元素在元素周期表中的位置为
,则该元素在元素周期表中的位置为___________ 。
(2)基态锑(Sb)原子的价电子排布式为___________ 。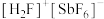 (氟酸锑)是一种超强酸,
(氟酸锑)是一种超强酸, 离子的空间构型为
离子的空间构型为___________ ,写出一种与 互为等电子体的分子
互为等电子体的分子___________ 。
(3)处于分界线的元素Al可形成多种化合物。
 中三种元素的基态原子的第一电离能从大到小的顺序是
中三种元素的基态原子的第一电离能从大到小的顺序是___________ (填元素符号)。
 中铝的杂化方式为
中铝的杂化方式为___________ ,其中阴离子的立体结构为___________ ,
(4)下列说法正确的是___________
a. 、SiC,
、SiC, 是空间构型均为正四面体的三种物质,键角与其他两种物质不同的是SiC
是空间构型均为正四面体的三种物质,键角与其他两种物质不同的是SiC
b.基态P原子中,电子占据的最高能级符号为M
c.Sb位于p区
d.升温实现液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性共价键
(5)周期表中元素的性质呈现出周期性变化。元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能( )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示,其中除氮元素外,其他元素的
变化趋势如图所示,其中除氮元素外,其他元素的 自左而右依次增大的原因是
自左而右依次增大的原因是___________ ;氮元素的 呈现异常的原因是
呈现异常的原因是___________ 。


(1)写出元素①的元素符号
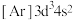 ,则该元素在元素周期表中的位置为
,则该元素在元素周期表中的位置为(2)基态锑(Sb)原子的价电子排布式为
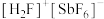 (氟酸锑)是一种超强酸,
(氟酸锑)是一种超强酸, 离子的空间构型为
离子的空间构型为 互为等电子体的分子
互为等电子体的分子(3)处于分界线的元素Al可形成多种化合物。
 中三种元素的基态原子的第一电离能从大到小的顺序是
中三种元素的基态原子的第一电离能从大到小的顺序是 中铝的杂化方式为
中铝的杂化方式为(4)下列说法正确的是
a.
 、SiC,
、SiC, 是空间构型均为正四面体的三种物质,键角与其他两种物质不同的是SiC
是空间构型均为正四面体的三种物质,键角与其他两种物质不同的是SiCb.基态P原子中,电子占据的最高能级符号为M
c.Sb位于p区
d.升温实现液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性共价键
(5)周期表中元素的性质呈现出周期性变化。元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(
 )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示,其中除氮元素外,其他元素的
变化趋势如图所示,其中除氮元素外,其他元素的 自左而右依次增大的原因是
自左而右依次增大的原因是 呈现异常的原因是
呈现异常的原因是
您最近一年使用:0次
名校
8 . 按要求填空:
(1)某主族元素R的原子结构示意图: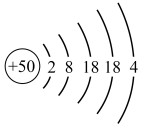 ,R在元素周期表中的位置是
,R在元素周期表中的位置是___________ ,R的最高价氧化物能与NaOH溶液反应生成钠盐,写出发生反应的化学方程式:___________ 。
(2)有下列几种物质:①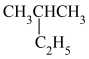 ;②乙烯;③乙酸;④油酸;⑤硬脂酸;⑥正丁烷,其中互为同系物的是
;②乙烯;③乙酸;④油酸;⑤硬脂酸;⑥正丁烷,其中互为同系物的是___________ (填序号,下同),①③⑤⑥四种物质按它们的沸点由高到低的顺序排列正确的是___________ 。
(3)某有机物A的分子式为 ,在
,在 作用下可发生水解,得到物质的量之比2∶1的B和C,且B和C碳原子数相等,则A的结构简式
作用下可发生水解,得到物质的量之比2∶1的B和C,且B和C碳原子数相等,则A的结构简式___________ ,请写出C被空气中的氧气催化氧化的化学方程式___________ 。
(1)某主族元素R的原子结构示意图:
 ,R在元素周期表中的位置是
,R在元素周期表中的位置是(2)有下列几种物质:①
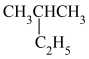 ;②乙烯;③乙酸;④油酸;⑤硬脂酸;⑥正丁烷,其中互为同系物的是
;②乙烯;③乙酸;④油酸;⑤硬脂酸;⑥正丁烷,其中互为同系物的是(3)某有机物A的分子式为
 ,在
,在 作用下可发生水解,得到物质的量之比2∶1的B和C,且B和C碳原子数相等,则A的结构简式
作用下可发生水解,得到物质的量之比2∶1的B和C,且B和C碳原子数相等,则A的结构简式
您最近一年使用:0次
2023-05-19更新
|
112次组卷
|
2卷引用:湖南省岳阳市岳汨联考2023-2024学年高二下学期5月月考化学试题
9 . 元素周期表中锑元素的数据如图。

(1)根据锑的价层电子排布式5s25p3可知,锑在元素周期表中位于第___________ 周期,第___________ 族。
(2)基态锑原子中有___________ 个未成对电子,这些未成对电子具有___________ (填“相同”或“不同”)的自旋状态。
(3)基态锑原子的5s轨道形状为___________ 形,该原子最外层电子占有___________ 个轨道。
(4)Bi在元素周期表中与Sb相邻,位于Sb的正下方。则两种元素的电负性Sb___________ Bi;原子半径Sb___________ Bi (填“>”或“<”)。

(1)根据锑的价层电子排布式5s25p3可知,锑在元素周期表中位于第
(2)基态锑原子中有
(3)基态锑原子的5s轨道形状为
(4)Bi在元素周期表中与Sb相邻,位于Sb的正下方。则两种元素的电负性Sb
您最近一年使用:0次
10 . C、N、O、F等元素的化合物在航天、美容、食品等多领域中有广泛的用途,请回答:
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为______ ;N、O、F的第一电离能由大到小的顺序为_____ (用元素符号表示)。
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为______ 晶体(填晶体类型)。
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第______ 周期第______ 族。
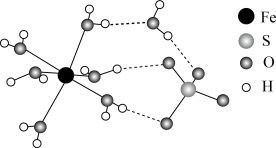
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO 的作用类型分别是
的作用类型分别是______ 、______ 。
A.离子键 B.配位键 C.氢键 D.金属键 中键角的大小并解释原因:
中键角的大小并解释原因:______ 。
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO
 的作用类型分别是
的作用类型分别是A.离子键 B.配位键 C.氢键 D.金属键
 中键角的大小并解释原因:
中键角的大小并解释原因:
您最近一年使用:0次
2023-04-20更新
|
204次组卷
|
3卷引用:山西省大同市2022-2023学年高二下学期期中考试化学试题



