解题方法
1 . 已知钛元素是22号元素。
(1)钛元素位于第___________ 周期,有___________ 个电子层。
(2)如果原子轨道上都排满电子,前三个电子层最多容纳的电子数分别为___________ 、___________ 、___________ 。如果前两个电子层排满,可以判断第三层电子___________ (填“排满”或“没排满”)
(1)钛元素位于第
(2)如果原子轨道上都排满电子,前三个电子层最多容纳的电子数分别为
您最近一年使用:0次
名校
2 . 某种牛奶的营养成分表如下所示(NRV%是指每100g食品中营养素的含量占该营养素每日摄入量的比例)。
回答下列问题。
(1)成分表中含有的元素有Na、Ca、H、C、N、O,其中位于同周期的元素是___________ (填元素名称)。
(2)Na在元素周期表中的位置是___________ ,它与氧元素形成的常见化合物中含有非极性共价键,其电子式为___________ 。
(3)比较下列物质的性质,用“>”或“<”填空。
①半径:r(Na+)___________ r(O2-);②沸点:NH3___________ CH4
(4)设计实验证明Ca、Mg都能与水反应,且比较它们与水反应的难易程度。
(限选试剂与仪器:烧杯、小试管、胶头滴管、酚酞、蒸馏水、钙、镁条、砂纸)
| 营养成分表 | ||
| 项目 | 每100g | NRV% |
| 能量 | 309kJ | 4% |
| 蛋白质 | 3.6g | 4% |
| 脂肪 | 4.4g | 7% |
| 碳水化合物 | 5.0g | 2% |
| 钠 | 65mg | 3% |
| 钙 | 120mg | 15% |
(1)成分表中含有的元素有Na、Ca、H、C、N、O,其中位于同周期的元素是
(2)Na在元素周期表中的位置是
(3)比较下列物质的性质,用“>”或“<”填空。
①半径:r(Na+)
(4)设计实验证明Ca、Mg都能与水反应,且比较它们与水反应的难易程度。
(限选试剂与仪器:烧杯、小试管、胶头滴管、酚酞、蒸馏水、钙、镁条、砂纸)
| Ca | Mg | |
| 操作 | 取绿豆大小的一块钙投入盛有水的 | 将打磨后的镁条投入盛有冷水的试管中。 |
| 现象 | 钙先沉入水中,表面产生大量气体,一段时间后上浮,溶液变浑浊。 | 一段时间后,镁条表面有细小气泡产生。 |
| 描述或推测 | ①钙密度比水大; ②溶液中产生的沉淀主要是 | 由细小气泡猜测Mg可能与水发生反应,还需要补充的实验操作及现象是 |
| 结论 | 钙能与水反应生成沉淀和氢气,且反应剧烈。 | 镁能与水缓慢反应,化学方程式为 |
您最近一年使用:0次
2023-07-07更新
|
148次组卷
|
2卷引用:四川省成都市2022-2023学年高二下学期期末零诊测试化学试卷
名校
解题方法
3 . 单质硅是制造太阳能电池板的主要原料,制备电池板时还需添加硼、氮、钛、钴、钙等多种化学物质。
请回答下列问题:
(1)基态硼原子的电子排布式为___________ ,下列钴原子的价层电子轨道表示式中,不符合洪特规则的是___________ (填选项字母)。
A.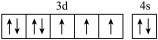 B.
B.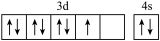
C.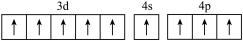 D.
D.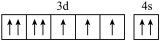
(2)氮与其同周期相邻两元素的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(3)钛元素位于元素周期表___________ 区;基态钛原子中,最外层电子的电子云轮廓图为___________ 。
请回答下列问题:
(1)基态硼原子的电子排布式为
A.
 B.
B.
C.
 D.
D.
(2)氮与其同周期相邻两元素的第一电离能由大到小的顺序为
(3)钛元素位于元素周期表
您最近一年使用:0次
4 . 元素周期律是对元素性质的规律性总结,元素周期表是这种规律的呈现形式。利用元素周期律可以推测一些未知元素可能的性质。根据你所学的周期律,回答下列问题:
(1)元素周期表有几个周期,几个主族。正确选项是
(2)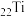 被誉为21世纪明星金属,其最外层电子数为___________(填序号)。
被誉为21世纪明星金属,其最外层电子数为___________(填序号)。
(3)元素周期表中,第三电子层有一个未成对电子的元素有___________种(填序号)。
(1)元素周期表有几个周期,几个主族。正确选项是
| A.6,7 | B.7,7 | C.7,18 | D.7,14 |
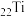 被誉为21世纪明星金属,其最外层电子数为___________(填序号)。
被誉为21世纪明星金属,其最外层电子数为___________(填序号)。| A.1个 | B.2个 | C.3个 | D.5个 |
| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
解题方法
5 . 铁是一种重要的元素,在成人体中的含量达44~5g,铁的配合物在有机合成、催化等领域中发挥重要作用。
Ⅰ.Fe³⁺的配合物在溶液中呈现不同的颜色,如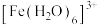 呈淡紫色(稀溶液时为无色),
呈淡紫色(稀溶液时为无色),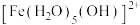 、
、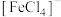 呈黄色。在黄色
呈黄色。在黄色 溶液中,加入稀
溶液中,加入稀 至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L
至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L NaCl溶液,溶液又变为黄色。
NaCl溶液,溶液又变为黄色。
(1)铁元素位于元素周期表的第___________ 周期第___________ 族。
(2)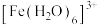 中,中心离子为
中,中心离子为___________ ,配位原子是___________ ,配位数为___________ 。
(3)加入NaCl溶液后,溶液又变为黄色的原因:___________ (用离子方程式表示)。
Ⅱ. 不易被人体吸收,维生素C可帮助人体将
不易被人体吸收,维生素C可帮助人体将 转变为易吸收的
转变为易吸收的 。
。
(4)维生素C的分子结构如下图所示,分子中碳原子的杂化方式有___________ ;推测维生素C在水中的溶解性:___________ (填“难溶于水”或“易溶于水”)。
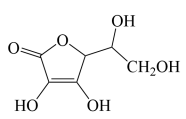
(5)根据维生素C的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。 (若不需要“可反应的试剂”,可对应填写“没有”)
②___________ 、___________ ;
③___________ 、___________ 、___________ 。
Ⅰ.Fe³⁺的配合物在溶液中呈现不同的颜色,如
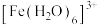 呈淡紫色(稀溶液时为无色),
呈淡紫色(稀溶液时为无色),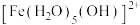 、
、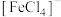 呈黄色。在黄色
呈黄色。在黄色 溶液中,加入稀
溶液中,加入稀 至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L
至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L NaCl溶液,溶液又变为黄色。
NaCl溶液,溶液又变为黄色。(1)铁元素位于元素周期表的第
(2)
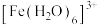 中,中心离子为
中,中心离子为(3)加入NaCl溶液后,溶液又变为黄色的原因:
Ⅱ.
 不易被人体吸收,维生素C可帮助人体将
不易被人体吸收,维生素C可帮助人体将 转变为易吸收的
转变为易吸收的 。
。(4)维生素C的分子结构如下图所示,分子中碳原子的杂化方式有

(5)根据维生素C的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。 (若不需要“可反应的试剂”,可对应填写“没有”)
| 序号 | 结构特征 | 可反应的试剂 | 反应类型 |
| ① | 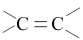 |  | 加成反应 |
| ② | 氧化反应 | ||
| ③ |
③
您最近一年使用:0次
名校
6 . 金属钛被誉为“二十一世纪金属”。回答下列问题:
(1)钛在周期表中的位置___________ ,位于元素周期表中___________ 区,钛原子核外有___________ 种空间运动状态不同的电子,Ti2+电子占据的最高能层的电子排布式为___________ 。
(2)TiO2的晶胞如图所示,则该晶体的密度为___________ g⋅cm-3 (设阿伏加德罗常数的值为NA,用含a、b、NA的代数式表示)。
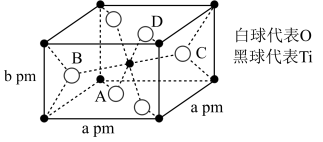
(1)钛在周期表中的位置
(2)TiO2的晶胞如图所示,则该晶体的密度为

您最近一年使用:0次
名校
7 . 元素在周期表中的位置,反映了元素的原子结构和性质。如图是元素周期表的一部分,请按照要求回答下列问题:
(1)①的元素符号是______ ,元素②位于周期表中的第______ 周期第______ 族。
(2)②、③两种元素中,非金属性较强的是______ (填元素符号)
(3)①、②、④三种元素中,原子半径最大的是______ (填元素符号)。
(4)④、⑤两种元素中最高价氧化物对应的水化物,属于两性氢氧化物的是______ (填化学式)。
(5)常温下,将元素⑥的单质通入 溶液中可制得漂白液,其有效成分是
溶液中可制得漂白液,其有效成分是 ,请写出该反应的离子方程式
,请写出该反应的离子方程式______
| 族 周期 | IA | 0 | ||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | |||||
(2)②、③两种元素中,非金属性较强的是
(3)①、②、④三种元素中,原子半径最大的是
(4)④、⑤两种元素中最高价氧化物对应的水化物,属于两性氢氧化物的是
(5)常温下,将元素⑥的单质通入
 溶液中可制得漂白液,其有效成分是
溶液中可制得漂白液,其有效成分是 ,请写出该反应的离子方程式
,请写出该反应的离子方程式
您最近一年使用:0次
2023-06-08更新
|
180次组卷
|
2卷引用:云南省宣威市第三中学2023-2024学年高二上学期第二次月考化学试题
解题方法
8 . 水泥是人类最伟大的发明之一,主要成分为硅酸三钙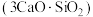 。将其与适量的水反应,形成相互交联的结构,发生的反应为
。将其与适量的水反应,形成相互交联的结构,发生的反应为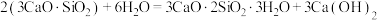 。回答下列问题:
。回答下列问题:
(1)为了加快硅酸三钙与水的反应速率,可采用的方式为_______ (填一种即可)。
(2)Si在元素周期表中的位置为_______ 。
(3) 的电子式为
的电子式为_______ , 的空间结构为
的空间结构为_______ 。
(4)元素C、O、Si、Ca的原子半径由大到小的顺序为_______ 。
(5)带有玻璃塞的磨口玻璃瓶不能用来盛装NaOH溶液的原因为_______ (用化学方程式表示)。
(6)写出 在农业上的一种用途:
在农业上的一种用途:_______ 。
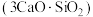 。将其与适量的水反应,形成相互交联的结构,发生的反应为
。将其与适量的水反应,形成相互交联的结构,发生的反应为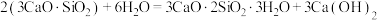 。回答下列问题:
。回答下列问题:(1)为了加快硅酸三钙与水的反应速率,可采用的方式为
(2)Si在元素周期表中的位置为
(3)
 的电子式为
的电子式为 的空间结构为
的空间结构为(4)元素C、O、Si、Ca的原子半径由大到小的顺序为
(5)带有玻璃塞的磨口玻璃瓶不能用来盛装NaOH溶液的原因为
(6)写出
 在农业上的一种用途:
在农业上的一种用途:
您最近一年使用:0次
2023-06-07更新
|
62次组卷
|
2卷引用:陕西省西安市选课分科摸底考2023-2024学年高二下学期4月月考化学试题
9 . 人类赖以生存的大千世界是由众多物质组成的,而数量如此庞大的物质却仅由百余种化学元素组成。我们要探索元素性质的递变规律,理解原子是如何通过相互作用构建物质。
(1)下列说法不正确的是__________
(2)下列说法正确的是___________
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4,Ni(CO)4呈正四面体形,Ni(CO)4易溶于下列物质中的__________
(4)氯原子最外层电子的原子轨道有___________ 种不同的伸展方向。
(5)写出与氯同周期,有3个未成对电子的基态原子的价电子轨道表示式为:___________ 。
(6)元素周期表中与氧元素相邻,且第一电离能比氧大的元素是___________ (填元素符号),它们与氧元素电负性由大到小的顺序为___________ 。
(7)根据价层电子对互斥理论判断下列问题:H2S中心原子的杂化方式为___________ 杂化,VSEPR构型为___________ ,分子的立体构型为___________ 。
(8)海洋元素中的氯、溴、碘统称为海水中的卤素资源,它们的化学性质既有相似性,也体现其递变性,用原子结构理论解释原因___________ 。
(1)下列说法不正确的是__________
A. 键是原子轨道以“肩并肩”方式相互重叠而形成的 键是原子轨道以“肩并肩”方式相互重叠而形成的 |
B.2个原子形成的多重共价键中,只能有一个是 键,而 键,而 键可以是一个或多个 键可以是一个或多个 |
C.s电子与s电子间形成的键是 键,p电子与p电子间形成的键是 键,p电子与p电子间形成的键是 键 键 |
| D.共价键一定有原子轨道的重叠 |
| A.氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少 |
| B.最外层电子数为ns2的元素都在元素周期表第2列 |
C.处于最低能量的原子叫做基态原子,1s22s22p →1s22s22p →1s22s22p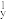 过程中形成的是发射光谱 过程中形成的是发射光谱 |
| D.已知某元素+3价基态离子的核外电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期ⅥB族位置,属于d区 |
| A.水 | B.CCl4 | C.苯 | D.NiSO4溶液 |
(5)写出与氯同周期,有3个未成对电子的基态原子的价电子轨道表示式为:
(6)元素周期表中与氧元素相邻,且第一电离能比氧大的元素是
(7)根据价层电子对互斥理论判断下列问题:H2S中心原子的杂化方式为
(8)海洋元素中的氯、溴、碘统称为海水中的卤素资源,它们的化学性质既有相似性,也体现其递变性,用原子结构理论解释原因
您最近一年使用:0次
名校
10 . 消毒剂在新冠疫情期间具有重要作用。消毒剂除了常见的有体积分数75%的医用酒精、漂白液溶液,还有高铁酸钾。
I.高铁酸钾 是一种比
是一种比 、
、 和
和 的氧化能力强的强氧化剂和消毒剂。
的氧化能力强的强氧化剂和消毒剂。
(1)下列基态原子或离子的电子排布式或排布图中,违反洪特规则的是_______ ;违反泡利原理的是_______ 。
① :
: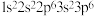
② :
: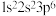
③P:
④Fe:
⑤ :
: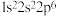
⑥C: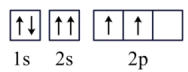
(2)高铁酸钾在水质处理中发挥着重要作用。查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:_______ 。
Ⅱ、关于原子表示时,我们也用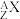 格式表示原子:请回答以下问题
格式表示原子:请回答以下问题
(3)中性原子的中子数N=_______ 。(用A和Z表示)
(4)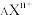 共有X个电子,则该阳离子的中子数N=
共有X个电子,则该阳离子的中子数N=_______ 。(用A、X、n表示)
Ⅲ、喷洒家用“84”消毒液是预防病毒的有效方法,某实验小组探究某品牌“84”消毒液的性质,取某品牌“84”消毒液5mL进行如表实验。
(5)写出实验室制备“84”消毒液反应的化学方程式:_______ 。
(6)查阅资料:酚酞的变色范围为8.2~10.0,且酚酞在强碱性溶液中红色会褪去。为探究操作a中溶液褪色的原因,又补充了如下实验(请将横线内容补充完整)。
获得结论:此实验小组使用的上述消毒液具有_______ 性。
I.高铁酸钾
 是一种比
是一种比 、
、 和
和 的氧化能力强的强氧化剂和消毒剂。
的氧化能力强的强氧化剂和消毒剂。(1)下列基态原子或离子的电子排布式或排布图中,违反洪特规则的是
①
 :
: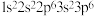
②
 :
: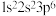
③P:

④Fe:

⑤
 :
: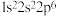
⑥C:

(2)高铁酸钾在水质处理中发挥着重要作用。查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:
Ⅱ、关于原子表示时,我们也用
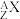 格式表示原子:请回答以下问题
格式表示原子:请回答以下问题(3)中性原子的中子数N=
(4)
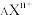 共有X个电子,则该阳离子的中子数N=
共有X个电子,则该阳离子的中子数N=Ⅲ、喷洒家用“84”消毒液是预防病毒的有效方法,某实验小组探究某品牌“84”消毒液的性质,取某品牌“84”消毒液5mL进行如表实验。
| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 |  ,溶液变红,5min后褪色 ,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(6)查阅资料:酚酞的变色范围为8.2~10.0,且酚酞在强碱性溶液中红色会褪去。为探究操作a中溶液褪色的原因,又补充了如下实验(请将横线内容补充完整)。
| 操作 | 现象 |
| 取 | 溶液变红,30min后褪色 |
您最近一年使用:0次



