22-23高一下·上海浦东新·期中
名校
解题方法
1 . 元素周期表是元素周期律的具体表现,是学习和研究化学的一种重要工具。下图是元素周期表的一部分:
回答下列问题:
(1)As元素在周期表中的位置是:___________ 。
(2)元素①气态氢化物分子的空间构型是___________ 。请用一个方程式比较元素①和元素②的非金属性强弱:___________ 。
(3)元素③、④、⑤的简单离子半径由大到小排序为:___________ (用离子符号表示)。
(4)元素⑤、⑥非金属性更强的是:___________ (用元素符号表示),请从原子结构的角度解释:___________ 。
电离能是指由气态原子失去电子形成阳离子需要的能量。从中性原子中失去第一个电子所需要的能量为第一电离能( ),失去第二个电子所需要的能量为第二电离能(
),失去第二个电子所需要的能量为第二电离能( ),依次类推。下图为1-19号元素第一电离能
),依次类推。下图为1-19号元素第一电离能 。
。
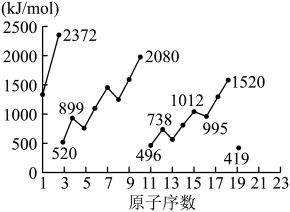
回答下列问题:
(5)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常,预测下列关系式中正确的是___________(填编号)。
(6)10号元素Ne的 值较大的原因是
值较大的原因是___________ 。
| ① | ② | ③ | ||
| ④ | P | ⑤ | ⑥ | |
| Ga | Ge | As | Se | Br |
回答下列问题:
(1)As元素在周期表中的位置是:
(2)元素①气态氢化物分子的空间构型是
(3)元素③、④、⑤的简单离子半径由大到小排序为:
(4)元素⑤、⑥非金属性更强的是:
电离能是指由气态原子失去电子形成阳离子需要的能量。从中性原子中失去第一个电子所需要的能量为第一电离能(
 ),失去第二个电子所需要的能量为第二电离能(
),失去第二个电子所需要的能量为第二电离能( ),依次类推。下图为1-19号元素第一电离能
),依次类推。下图为1-19号元素第一电离能 。
。
回答下列问题:
(5)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常,预测下列关系式中正确的是___________(填编号)。
A.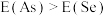 | B. | C. | D.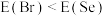 |
 值较大的原因是
值较大的原因是
您最近一年使用:0次
2 . 下面为元素周期表的一部分,根据元素①~⑧在表中的位置回答下列问题。
(1)①的元素名称为:___________ ,元素④的原子结构示意图为___________ 。
(2)②的最高价氧化物对应水化物酸性比③的最高价氧化物对应水化物酸性弱的原因是___________(填字母)。
(3)②、④组成的能引起温室效应的化合物的电子式为___________ ,其中含有的化学键为___________ 。
(4)②、⑧的最高价氧化物对应水化物的酸性从强到弱的顺序为___________ (用化学式表示)。
(5)③、⑤、⑦三种元素的离子半径从大到小顺序为___________ (用元素符号表示)。
(6)写出元素⑤⑥对应的最高价氧化物的水化物相互之间发生反应的化学方程式___________ 。
族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)②的最高价氧化物对应水化物酸性比③的最高价氧化物对应水化物酸性弱的原因是___________(填字母)。
| A.②的单质为固体,而③的单质为气体 |
| B.原子半径②比③大 |
| C.②的非金属性比③弱 |
| D.原子序数③比②大 |
(4)②、⑧的最高价氧化物对应水化物的酸性从强到弱的顺序为
(5)③、⑤、⑦三种元素的离子半径从大到小顺序为
(6)写出元素⑤⑥对应的最高价氧化物的水化物相互之间发生反应的化学方程式
您最近一年使用:0次
2022-02-26更新
|
326次组卷
|
2卷引用:广东省潮州市潮安区2021-2022学年高一上学期期末考试化学试题
解题方法
3 . 下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
针对元素①~⑩回答下列问题。
(1)元素①和②的单质化合形成的化合物NaH中H元素的化合价为_______ ;NaH能与水反应生成氢气,在反应后的溶液中滴入酚酞,溶液变红,其化学方程式为_______ 。
(2)元素④是人体必不可缺少的一种元素,缺乏会出现骨质疏松、易骨折等症状,请写出其原子结构示意图_______ 。
(3)由元素①和⑥形成的一种物质是天然气的主要成分,其电子式为_______ ;元素⑥还可以和⑦形成一种三原子直线型分子,其结构式为_______ ;元素②的单质在元素⑦的单质中点燃生成的淡黄色固体将其投入硫酸亚铁溶液中,预测主要的反应现象是_______ 。
(4)元素③、⑧、⑨的简单离子中半径最大是_______ (填离子符号),元素②和⑤的最高价氧化物对应的水化物之间可以发生反应,其反应的离子方程式为_______ 。
(5)表中元素⑨和⑩的气态氢化物中更稳定的是_______ (填化学式)。
| 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ⑤ | ⑧ | ⑨ | ||||
| 4 | ③ | ④ | ⑩ |
(1)元素①和②的单质化合形成的化合物NaH中H元素的化合价为
(2)元素④是人体必不可缺少的一种元素,缺乏会出现骨质疏松、易骨折等症状,请写出其原子结构示意图
(3)由元素①和⑥形成的一种物质是天然气的主要成分,其电子式为
(4)元素③、⑧、⑨的简单离子中半径最大是
(5)表中元素⑨和⑩的气态氢化物中更稳定的是
您最近一年使用:0次
解题方法
4 . I. 下面是部分元素原子或离子的结构示意图。请你仔细观察、分析,然后回答问题:
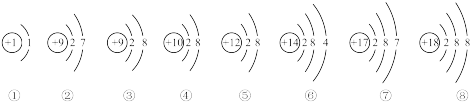
(1)用序号填空:上述粒子中,属于稀有气体元素的原子是_______ ;在化学反应中容易得到电子的是_______ ;属于阳离子的是_______ ;表示F-离子的是_______ ;属于同一种元素的是_______ ;属于非金属元素的是_______ ;电子层数相同,最外层电子数也相同的粒子有_______ ;能与①形成AB4型分子的是_______ 。
II.某微粒的结构示意图可表示为
(2)当x=10+y时,该粒子为_______ (填“原子”、“阳粒子”或“阴离子”),当x<10+y时,该粒子为_______ 。
(3)当y=2时x=_______ 。该元素能形成的离子符号为_______ 。
(4)若该结构示意图表示的粒子是R-,则x=_______ ,y=_______ 。
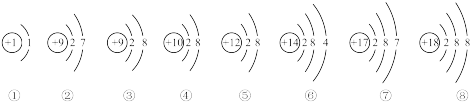
(1)用序号填空:上述粒子中,属于稀有气体元素的原子是
II.某微粒的结构示意图可表示为

(2)当x=10+y时,该粒子为
(3)当y=2时x=
(4)若该结构示意图表示的粒子是R-,则x=
您最近一年使用:0次
5 . 人体必需的一些元素在周期表中的分布情况如下:

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是___________ 。H2O2是一种绿色氧化剂,电子式为___________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为___________ 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是___________ ,原子序数为___________ 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为___________ 。
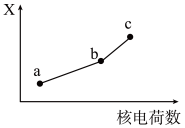
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。

| A.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第IA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
2023-12-05更新
|
264次组卷
|
3卷引用:湖北省宜城市第一中学等六校2023-2024学年高二上学期期中考试化学试题
20-21高二·全国·课时练习
解题方法
6 . 指出下列元素在周期表中的位置:
(1)基态原子的电子排布式为[Ar]4s1的元素:第___ 周期、__ 族。
(2)基态原子的电子排布式为[Ar]3d34s2的元素:第__ 周期、__ 族。
(3)基态原子的电子排布式为[Ar]3d104s1的元素:第__ 周期、__ 族。
(4)基态原子的电子排布式为[Ne]3s23p5的元素:第__ 周期、__ 族。
(1)基态原子的电子排布式为[Ar]4s1的元素:第
(2)基态原子的电子排布式为[Ar]3d34s2的元素:第
(3)基态原子的电子排布式为[Ar]3d104s1的元素:第
(4)基态原子的电子排布式为[Ne]3s23p5的元素:第
您最近一年使用:0次
7 . 下表是元素周期表的一部分根据A~G元素在周期表中的位置,用化学式填写空白。
(1)氧化性最强的单质是______ ,还原性最强的单质是______ ,化学性质最不活泼的单质是______ 。(填相应的化学式)
(2)最稳定的氢化物是______ 。(填相应的化学式)
(3)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是__________________ 。(填相应的化学式)
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | A | |||||||
| 2 | D | F | H | |||||
| 3 | B | C | E | G |
(1)氧化性最强的单质是
(2)最稳定的氢化物是
(3)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是
您最近一年使用:0次
8 . 已知某主族元素的原子结构示意图如下,请写出它们在周期表中的位置。
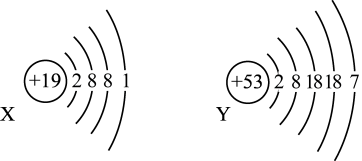
X:_______ ,Y:_______ 。

X:
您最近一年使用:0次
2022-04-28更新
|
558次组卷
|
2卷引用:上海市青浦区第一中学2021-2022学年高一下学期期中线上质量检测化学试题
解题方法
9 . 下表列出了 九种元素在周期表中的位置,根据要求回答下列问题:
九种元素在周期表中的位置,根据要求回答下列问题:

(1)f的名称是_______ ,d的元素符号是_______ ;
(2)a在周期表中的位置是_______ ;
(3)h的原子结构示意图是_______ ;
(4)e、g、i按原子半径由大到小的顺序排列为_______ (填元素符号);
(5)c与h相比非金属性较强的是_______ (填元素符号),h的氢化物与i的氢化物相比,稳定性较弱的是_______ (填化学式);
(6)e的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物,在水溶液中反应的离子方程式为_______ ;
(7)g的单质与氧化铁在高温条件下反应的化学方程式为_______ ;
(8)i的氢化物的电子式为_______ 。
 九种元素在周期表中的位置,根据要求回答下列问题:
九种元素在周期表中的位置,根据要求回答下列问题:
(1)f的名称是
(2)a在周期表中的位置是
(3)h的原子结构示意图是
(4)e、g、i按原子半径由大到小的顺序排列为
(5)c与h相比非金属性较强的是
(6)e的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物,在水溶液中反应的离子方程式为
(7)g的单质与氧化铁在高温条件下反应的化学方程式为
(8)i的氢化物的电子式为
您最近一年使用:0次
名校
解题方法
10 . 下图为元素周期表的一部分,根据元素①~⑧在表中的位置回答下列问题。
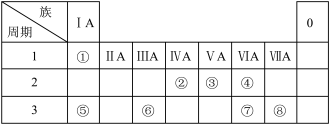
(1)元素⑧的最高价氧化物对应水化物的分子式为_______ ;
(2)元素①与④形成的18电子的化合物的结构式为_______ ;
(3)用电子式表示元素⑤与⑧形成化合物的过程_______ ;
(4)元素⑥的单质与⑤的最高价氧化物对应水化物反应的化学方程式_______ ;
(5)假设元素⑧的对应元素符号为X,若在一定条件下,X单质能够与硫反应生成一种用途广泛的硫化剂S2X2。该硫化剂S2X2与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液褪色的无色气体,则该反应的化学方程式是_______ (元素X请用具体元素符号表示)。

(1)元素⑧的最高价氧化物对应水化物的分子式为
(2)元素①与④形成的18电子的化合物的结构式为
(3)用电子式表示元素⑤与⑧形成化合物的过程
(4)元素⑥的单质与⑤的最高价氧化物对应水化物反应的化学方程式
(5)假设元素⑧的对应元素符号为X,若在一定条件下,X单质能够与硫反应生成一种用途广泛的硫化剂S2X2。该硫化剂S2X2与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液褪色的无色气体,则该反应的化学方程式是
您最近一年使用:0次
2021-03-16更新
|
685次组卷
|
6卷引用:湖南省长沙市雅礼中学2020-2021学年高一下学期开学考化学试题



