1 . 合成氨是人类科学技术发展史上的一项重大成就,是化学和技术对社会发展与进步的巨大贡献。
(1)基态氮原子中,能量最高的电子的电子云在空间有___________ 个伸展方向。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为___________ 。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有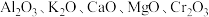 等氧化物中的几种。
等氧化物中的几种。
①Cr原子的价电子排布图为___________ ;第四周期ds区元素中,与基态Cr原子最外层电子数目相同的元素的元素符号为___________ 。
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有___________ (填元素符号)。
(4)我国科研人员研制出了 (M为Fe、Mn等金属)等催化剂,使得合成氨工业温度,压强分别降到了350℃、
(M为Fe、Mn等金属)等催化剂,使得合成氨工业温度,压强分别降到了350℃、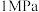 ,这是近年来合成氨反应研究中的重要突破。第三电离能
,这是近年来合成氨反应研究中的重要突破。第三电离能
___________ 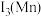 (填“>”或“<”),原因是
(填“>”或“<”),原因是___________ 。
(1)基态氮原子中,能量最高的电子的电子云在空间有
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
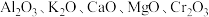 等氧化物中的几种。
等氧化物中的几种。①Cr原子的价电子排布图为
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有
(4)我国科研人员研制出了
 (M为Fe、Mn等金属)等催化剂,使得合成氨工业温度,压强分别降到了350℃、
(M为Fe、Mn等金属)等催化剂,使得合成氨工业温度,压强分别降到了350℃、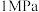 ,这是近年来合成氨反应研究中的重要突破。第三电离能
,这是近年来合成氨反应研究中的重要突破。第三电离能
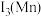 (填“>”或“<”),原因是
(填“>”或“<”),原因是
您最近一年使用:0次
名校
2 . 已知 的3d轨道上有6个电子,试回答:
的3d轨道上有6个电子,试回答:
(1)M元素原子的核外电子排布式为_______ 。
(2)M元素在元素周期表中的位置为_______ 。
(3)M的基态原子共有_______ 种不同能级的电子,该原子最外层电子数为_______ ,价层电子数为_______ 。
(4)某元素原子的基态电子排布式为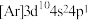 ,该元素处于元素周期表的第
,该元素处于元素周期表的第_______ 周期第_______ 族。试推测该元素处于元素周期表的_______ 区,该元素原子的价电子排布图为_______ 。
(5)与M元素相对比,铬(Cr)元素的原子核外电子排布有其特点,请写出Cr基态原子核外电子排布式_______ 。
 的3d轨道上有6个电子,试回答:
的3d轨道上有6个电子,试回答:(1)M元素原子的核外电子排布式为
(2)M元素在元素周期表中的位置为
(3)M的基态原子共有
(4)某元素原子的基态电子排布式为
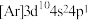 ,该元素处于元素周期表的第
,该元素处于元素周期表的第(5)与M元素相对比,铬(Cr)元素的原子核外电子排布有其特点,请写出Cr基态原子核外电子排布式
您最近一年使用:0次
解题方法
3 . 下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
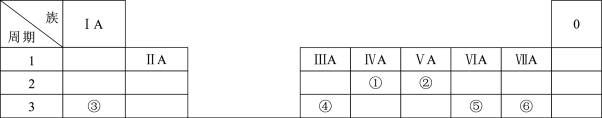
(1)②的原子结构示意图是_______ 。
(2)写出①的最高价氧化物的电子式:_______ 。
(3)⑤和⑥分别形成的最简单氢化物更稳定的是_______ (填化学式)。
(4)③对应的最高价氧化物形成的水化物与④形成的氧化物反应的离子方程式为_______ 。

(1)②的原子结构示意图是
(2)写出①的最高价氧化物的电子式:
(3)⑤和⑥分别形成的最简单氢化物更稳定的是
(4)③对应的最高价氧化物形成的水化物与④形成的氧化物反应的离子方程式为
您最近一年使用:0次
4 . 钡元素在周期表中位于__ (填“s”“d”或“p”)区。
您最近一年使用:0次
5 . 某学习小组探究B及其化合物的性质。
(1)元素周期表中虚线相连的元素的性质具有一定的相似性,即对角线法则。
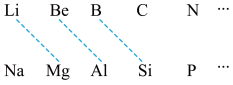
B在元素周期表中的位置是_______ 。其最高价氧化物的化学式为_______ ,与氢氧化钠溶液反应的化学方程式为_______ 。
(2)某科研团队研究发现硼氢化钠( )在催化剂表面与水反应可生成
)在催化剂表面与水反应可生成 。
。
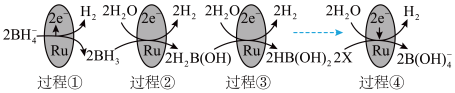
①上图中X的化学式为_______ 。
② 以二聚物的形式存在,分子结构中存在两个
以二聚物的形式存在,分子结构中存在两个 键共用一对共用电子的氢桥键,用
键共用一对共用电子的氢桥键,用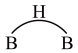 表示,则二聚物结构式为
表示,则二聚物结构式为_______ 。
③图中反应的总化学方程式为_______ 。
④_______ g 的还原能力与标准状况下22.4L
的还原能力与标准状况下22.4L 的还原能力相当(还原能力即生成
的还原能力相当(还原能力即生成 失去电子的量)。
失去电子的量)。
(1)元素周期表中虚线相连的元素的性质具有一定的相似性,即对角线法则。

B在元素周期表中的位置是
(2)某科研团队研究发现硼氢化钠(
 )在催化剂表面与水反应可生成
)在催化剂表面与水反应可生成 。
。
①上图中X的化学式为
②
 以二聚物的形式存在,分子结构中存在两个
以二聚物的形式存在,分子结构中存在两个 键共用一对共用电子的氢桥键,用
键共用一对共用电子的氢桥键,用 表示,则二聚物结构式为
表示,则二聚物结构式为③图中反应的总化学方程式为
④
 的还原能力与标准状况下22.4L
的还原能力与标准状况下22.4L 的还原能力相当(还原能力即生成
的还原能力相当(还原能力即生成 失去电子的量)。
失去电子的量)。
您最近一年使用:0次
名校
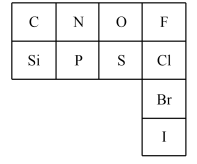
6 . 元素周期表是指导我们系统学习化学的重要工具。下图是元素周期表的一部分。___________ 相同。
(2)氮元素的最低化合价为___________ ,其气态氢化物的电子式为___________ 。在表中所列元素的最高价氧化物对应水化物中酸性最强的是___________ (写化学式)。
(3)Cl的非金属性___________ (填“强于”、“弱于”或“等于”)Br的非金属性。(海水提溴的原理是用氯气将溴离子氧化,请写出氯气与溴化钠溶液反应的化学方程式,并标出电子转移的方向和数目。___________ 。
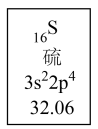
(4)元素周期表中每种元素的具体信息如图示例,从中你可以获取硫元素的哪些信息,请简要阐述。___________ (任写一个)。
(2)氮元素的最低化合价为
(3)Cl的非金属性
(4)元素周期表中每种元素的具体信息如图示例,从中你可以获取硫元素的哪些信息,请简要阐述。
您最近一年使用:0次
7 . 联合国将2019年定为“国际化学元素周期表年”,新版周期表包含118种元素,下表代表元素周期表前四周期,回答下列问题:

(1)表中的实线是元素周期表的部分边界,请在图中用实线画出金属元素与非金属元素的分界线,将硼、磷的元素符号填写在上述周期表相应的空格中_____ 。
(2)某元素的原子次外层电子数比最外层电子数多1个,单质常温下为黄绿色气体,该元素的最高价氧化物对应水化物的电离方程式为_____ 。
(3)下列有关性质的比较正确,且能用元素周期律解释的是___________ 。
a.非金属性:O>S b.热稳定性:HF<HCl
c.酸性:HCl>H2SO3 d.碱性:NaOH>Mg(OH)2
(4)某金属单质既可以和强酸反应也可以和强碱溶液反应,写出对应的离子方程式___________ ;___________ 。
(5)硒(Se)是人体必需的微量元素,其原子结构示意图为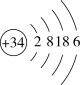 。
。
①Se在元素周期表中的位置是___________ 。
②Se的简单气态氢化物的化学式为___________ 。
③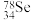 和
和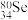 互称为
互称为___________ 。

(1)表中的实线是元素周期表的部分边界,请在图中用实线画出金属元素与非金属元素的分界线,将硼、磷的元素符号填写在上述周期表相应的空格中
(2)某元素的原子次外层电子数比最外层电子数多1个,单质常温下为黄绿色气体,该元素的最高价氧化物对应水化物的电离方程式为
(3)下列有关性质的比较正确,且能用元素周期律解释的是
a.非金属性:O>S b.热稳定性:HF<HCl
c.酸性:HCl>H2SO3 d.碱性:NaOH>Mg(OH)2
(4)某金属单质既可以和强酸反应也可以和强碱溶液反应,写出对应的离子方程式
(5)硒(Se)是人体必需的微量元素,其原子结构示意图为
 。
。①Se在元素周期表中的位置是
②Se的简单气态氢化物的化学式为
③
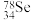 和
和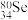 互称为
互称为
您最近一年使用:0次
名校
8 . 下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题。
(1)②表示的元素是___________ (填元素符号);
(2)①②⑤三种元素的原子半径从大到小排列为:___________ (填元素符号);
(3)③④两种元素的金属性强弱顺序为:③___________ ④(填“<”或“>”);
(4)③与②两种元素所形成化合物的阴阳离子个数比为___________ ;
(5)④和⑥两种元素组成的化合物中含有的化学键为___________ (填“离子键”或“共价键”)。
族 周期 | ⅠA | 0 | |||||||
| 1 | H | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | F | Ne | |||||
| 3 | ③ | Mg | ④ | Si | ⑤ | ⑥ | |||
(1)②表示的元素是
(2)①②⑤三种元素的原子半径从大到小排列为:
(3)③④两种元素的金属性强弱顺序为:③
(4)③与②两种元素所形成化合物的阴阳离子个数比为
(5)④和⑥两种元素组成的化合物中含有的化学键为
您最近一年使用:0次
名校
9 . 1869年俄国科学家门捷列夫绘制出了第一张元素周期表,成为化学史上的里程碑之一,且大大地促进了化学学科的快速发展。下表是现代元素周期表的一部分,请据表回答下列问题:
(1)元素③的名称是___________ ,金属性最强的元素是___________ (填元素符号)。
(2)①②⑤三种元素原子半径由大到小的顺序为___________ (填序号)。
(3)元素⑦的单质的一种用途是___________ (填写“制造玻璃”或“制造计算机芯片”)。
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是___________ (填化学式)。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
二 | ① | ② | ③ | ||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)元素③的名称是
(2)①②⑤三种元素原子半径由大到小的顺序为
(3)元素⑦的单质的一种用途是
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是
您最近一年使用:0次
2022-03-16更新
|
640次组卷
|
3卷引用:湖南省长沙市长郡中学2020-2021学年高一下学期期中考试化学试题
解题方法
10 . 如图为元素周期表的一部分,几种元素的位置如图所示,试回答下列问题:
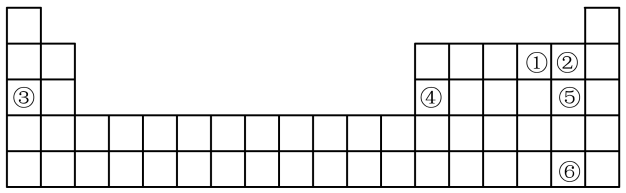
(1)元素①的原子结构示意图为__________ ,元素⑥在周期表中的位置是__________ 。
(2)元素①和③形成含共价键的化合物电子式为__________ ,其中阴阳离子个数比为__________ 。
(3)氯元素的“价类二维图”的部分信息如图,写出Y、Z的化学式__________ 、__________ 。
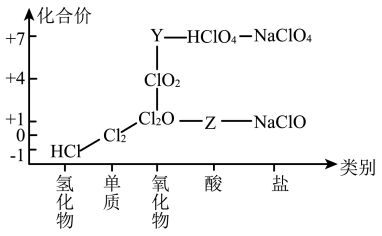
(4)元素②③④简单离子半径从小到大的顺序为:__________ (用离子符号表示)。
(5)写出④的单质与③的最高价氧化物水化物发生反应的离子方程式:__________
(6)氰 性质与卤素单质相似,称为“拟卤素”,它和碱的反应与卤素单质和碱的反应类似。写出氰
性质与卤素单质相似,称为“拟卤素”,它和碱的反应与卤素单质和碱的反应类似。写出氰 与NaOH溶液发生反应的化学方程式:
与NaOH溶液发生反应的化学方程式:__________ 。

(1)元素①的原子结构示意图为
(2)元素①和③形成含共价键的化合物电子式为
(3)氯元素的“价类二维图”的部分信息如图,写出Y、Z的化学式

(4)元素②③④简单离子半径从小到大的顺序为:
(5)写出④的单质与③的最高价氧化物水化物发生反应的离子方程式:
(6)氰
 性质与卤素单质相似,称为“拟卤素”,它和碱的反应与卤素单质和碱的反应类似。写出氰
性质与卤素单质相似,称为“拟卤素”,它和碱的反应与卤素单质和碱的反应类似。写出氰 与NaOH溶液发生反应的化学方程式:
与NaOH溶液发生反应的化学方程式:
您最近一年使用:0次



