名校
1 . 下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为_______ 。
(2)地壳中含量最多的金属元素是____ ,写出元素⑥的简单气态氢化物的化学式______ 。
(3)这些元素中的最高价氧化物对应的水化物中,碱性最强的是______ ,呈两性的氢氧化物是_______ 。
(4)写出②、③、⑤对应离子的离子半径由大到小的顺序是______ ,
(5)写出②、⑦、⑩对应阴离子还原性由强到弱的顺序是______ 。
(6)元素⑦与元素⑩相比,非金属性较强的是____ ,能证明这一事实的依据是_____ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ⑥ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑪ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)地壳中含量最多的金属元素是
(3)这些元素中的最高价氧化物对应的水化物中,碱性最强的是
(4)写出②、③、⑤对应离子的离子半径由大到小的顺序是
(5)写出②、⑦、⑩对应阴离子还原性由强到弱的顺序是
(6)元素⑦与元素⑩相比,非金属性较强的是
您最近一年使用:0次
名校
2 . 下表列出了13种元素在元素周期表中的位置:
(1)画出这13钟元素中,非金属性最强的元素的原子结构示意图:_______
(2)元素④⑤⑩分别和①形成的气体化合物中,最稳定的是(填化学式,下同)_______ ;⑦⑫⑬形成的简单离子半径由大到小的顺序是_______ 。
(3)这些元素的最高价氧化物对应的水化物中酸性最强的是_______ ,碱性最强的是_______ ,呈两性的氢氧化物是_______ 。写出三者之间两两反应的化学方程式:_______ 。
(4)可以用来证明⑦和⑧两种元素金属性强弱的实验是_______(填字母)
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ||
| 四 | ⑫ | ⑬ |
(1)画出这13钟元素中,非金属性最强的元素的原子结构示意图:
(2)元素④⑤⑩分别和①形成的气体化合物中,最稳定的是(填化学式,下同)
(3)这些元素的最高价氧化物对应的水化物中酸性最强的是
(4)可以用来证明⑦和⑧两种元素金属性强弱的实验是_______(填字母)
| A.将在空气中放置已久的两种元素的块状单质分别放入水中 |
| B.将形状、大小相同的无氧化膜的两种元素的单质分别和同浓度同体积的盐酸反应 |
| C.将形状、大小相同的无氧化膜的两种元素的单质分别和温度相同的热水作用,并滴入酚酞 |
| D.比较两种元素氢化物的热稳定性 |
您最近一年使用:0次
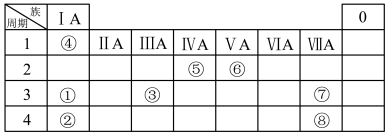
3 . 几种主族元素在周期表中的位置如下
(1)⑥元素的简单氢化物的化学式是_______ 。
(2)①③⑦三种元素原子半径由大到小的顺序是_______ (用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_______ ,该元素在周期表中的位置是_______ 。
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是_______ (填化学式)①与③最高价氧化物对应水化物反应的离子方程_______ 。
(5)⑦的非金属性强于⑧,从原子结构的角度解释其原因:_______ 。下列表述中能证明这一事实的是_______ (填字母)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
(1)⑥元素的简单氢化物的化学式是
(2)①③⑦三种元素原子半径由大到小的顺序是
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是
(5)⑦的非金属性强于⑧,从原子结构的角度解释其原因:
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
您最近一年使用:0次
2022-01-22更新
|
940次组卷
|
4卷引用:广东省湛江市2021-2022学年高一上学期期末调研考试化学试题
广东省湛江市2021-2022学年高一上学期期末调研考试化学试题(已下线)【知识图鉴】单元讲练测必修第一册第四单元02基础练(已下线)专题突破卷05?物质结构 元素周期律?-2024年高考化学一轮复习考点通关卷(新教材新高考)天津市武清区黄花店中学2023-2024学年高三上学期第二次练习化学试题
名校
4 . 下表是元素周期表的一部分。
(1)表中元素③的氢化物的电子式为___________ ;此氢化物的稳定性比元素④的氢化物的稳定性___________ (选填“强”或“弱”);此氢化物与元素⑧的氢化物反应生成的化合物其水溶液呈酸性,用离子方程式表示其原因是___________ 。
(2)③④⑤⑥元素中,原子半径最大的元素是___________ (填元素符号);这四种元素形成的简单离子中离子半径最小的是___________ (填离子符号)。
(3)⑤、⑥两元素相比较,金属性较强是___________ (填元素符号),可以证明该结论的实验是___________ 。
a.比较这两种元素最高价氧化物对应的水化物的碱性
b.比较这两种元素的气态氢化物的稳定性
c.将这两种元素的单质分别放入冷水中
d.比较这两种元素的单质与酸反应时失电子的数目
(4)请用一个化学方程式证明元素⑦和⑧的非金属性强弱关系___________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ① | ② | ③ | ④ | |||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)③④⑤⑥元素中,原子半径最大的元素是
(3)⑤、⑥两元素相比较,金属性较强是
a.比较这两种元素最高价氧化物对应的水化物的碱性
b.比较这两种元素的气态氢化物的稳定性
c.将这两种元素的单质分别放入冷水中
d.比较这两种元素的单质与酸反应时失电子的数目
(4)请用一个化学方程式证明元素⑦和⑧的非金属性强弱关系
您最近一年使用:0次
2021-11-08更新
|
351次组卷
|
2卷引用:上海市南洋模范中学2021-2022学年高二上学期期中考试化学(等级考)试题
解题方法
5 . 下表列出了9种元素在元素周期表中的位置示意。
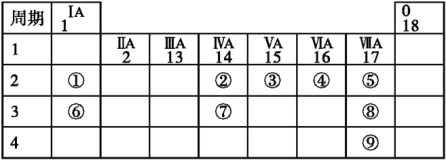
请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是_______ ,中子数为_______ 。
(2)画出元素⑧形成的简单离子的结构示意图_______ 。
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为_______ ;元素④的简单氢化物的电子式为_______ ,该物质的空间构型为_______
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是_______ 。
(5)比较元素⑤、⑥形成的简单离子半径大小_______ ;比较元素③、⑦的最高价氧化物对应水化物的酸性强弱_______ 。
(6)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是_______ (填化学式);写出元素⑥的单质与水反应的离子方程式:_______ ;写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式_______ 。

请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是
(2)画出元素⑧形成的简单离子的结构示意图
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是
(5)比较元素⑤、⑥形成的简单离子半径大小
(6)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是
您最近一年使用:0次
名校
6 . 下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
请完成下列空白。
(1)写出 52 号元素在元素周期表中的位置___________ ;写出③和⑨两元素原子序数的差值___________
(2)写出③与⑦形成的化合物的电子式___________
(3)写出一个能够证明④的最高价氧化物的水化物的碱性弱于③的最高价氧化物的水化物的碱性的离子反应方程式___________
(4)写出由②、⑤、⑥三种元素构成的物质的水溶液与 CO2 反应的化学方程式___________
(5)写出一个能够证明⑦的非金属性强于⑧的离子反应方程式___________
| IA | IIA | IIIA | VA | 0 | ||||
| 1 | ① | |||||||
| 2 | ⑥ | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑦ | |||
| 4 | ⑨ | ⑧ | ⑩ |
请完成下列空白。
(1)写出 52 号元素在元素周期表中的位置
(2)写出③与⑦形成的化合物的电子式
(3)写出一个能够证明④的最高价氧化物的水化物的碱性弱于③的最高价氧化物的水化物的碱性的离子反应方程式
(4)写出由②、⑤、⑥三种元素构成的物质的水溶液与 CO2 反应的化学方程式
(5)写出一个能够证明⑦的非金属性强于⑧的离子反应方程式
您最近一年使用:0次
名校
解题方法
7 . 下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①___________ ,⑦___________ 。
(2)画出原子的结构示意图:④___________ ,⑧___________ 。
(3)在①—⑫元素中,金属性最强的元素是___________ ,非金属性最强的元素是___________ ,最不活泼的元素是___________ 。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是___________ (用元素符号表示),下列表述中能证明这一事实的是___________ 。
a.常温下⑦的单质和⑧的单质状态不同 b.⑧的氢化物比⑦的氢化物稳定 c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是___________ (填序号),跟它同周期原子半径最小的元素是___________ (填序号),它们可以形成 ___________ (填“离子”或“共价”)化合物,用电子式表示其形成过程如下:___________ 。
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,它可与⑧形成一种AB4型化合物,请写出该化合物的电子式:___________ 。
 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:④
(3)在①—⑫元素中,金属性最强的元素是
(4)元素⑦与元素⑧相比,非金属性较强的是
a.常温下⑦的单质和⑧的单质状态不同 b.⑧的氢化物比⑦的氢化物稳定 c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,它可与⑧形成一种AB4型化合物,请写出该化合物的电子式:
您最近一年使用:0次
2021高三·全国·专题练习
8 . (NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)是一种重要的化工原料,用途广泛。完成下列填空:
(1)铁在元素周期表的第ⅦB和第ⅠB之间。铁位于第___ 周期___ 族。
(2)写出Fe与水反应的化学方程式:___ 。
(3)将(NH4)2Fe(SO4)2中非金属元素的简单阴离子按半径由小到大的顺序排列:___ 。
(4)同温度同浓度的FeSO4和(NH4)2Fe(SO4)2溶液中,c(Fe2+)是否相等___ ?为什么?___ 。
(5)设计实验,证明(NH4)2Fe(SO4)2·6H2O晶体中含有Fe2+___ 。
(6)已知:(NH4)2Fe(SO4)2·6H2O在200℃失去全部结晶水。将一定质量的粉末状该晶体置于坩埚中,保持200℃受热,经冷却、恒重等正确操作,计算得到的1mol晶体中结晶水含量总是偏低,偏低的可能原因是___ (写一条即可)。
(1)铁在元素周期表的第ⅦB和第ⅠB之间。铁位于第
(2)写出Fe与水反应的化学方程式:
(3)将(NH4)2Fe(SO4)2中非金属元素的简单阴离子按半径由小到大的顺序排列:
(4)同温度同浓度的FeSO4和(NH4)2Fe(SO4)2溶液中,c(Fe2+)是否相等
(5)设计实验,证明(NH4)2Fe(SO4)2·6H2O晶体中含有Fe2+
(6)已知:(NH4)2Fe(SO4)2·6H2O在200℃失去全部结晶水。将一定质量的粉末状该晶体置于坩埚中,保持200℃受热,经冷却、恒重等正确操作,计算得到的1mol晶体中结晶水含量总是偏低,偏低的可能原因是
您最近一年使用:0次
9 . 下表是元素周期表的一部分。请按要求回答下列有关问题:
(1)元素⑨单质形成的晶体的晶体类型是___________ 。
(2)在这些主族元素中,原子半径最大的是___________ 。(填元素符号)
(3)最高价氧化物对应水化物酸性最强物质的化学式是___________ 。
(4)最高价氧化物对应的水化物中,碱性最强的物质与呈两性的氢氧化物反应的离子反应方程式为___________ 。
(5)证明⑧与⑫的单质活泼性强弱的离子方程式为___________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
(2)在这些主族元素中,原子半径最大的是
(3)最高价氧化物对应水化物酸性最强物质的化学式是
(4)最高价氧化物对应的水化物中,碱性最强的物质与呈两性的氢氧化物反应的离子反应方程式为
(5)证明⑧与⑫的单质活泼性强弱的离子方程式为
您最近一年使用:0次
2021-07-17更新
|
442次组卷
|
3卷引用:江苏省常州市武进区横山桥高级中学2020-2021学年高一下学期期中考试化学试题
江苏省常州市武进区横山桥高级中学2020-2021学年高一下学期期中考试化学试题(已下线)第四章 物质结构 元素周期律(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)新疆克孜勒苏柯尔克孜自治州阿克陶县2022-2023学年高一上学期11月期中考试化学试题
10 . 根据元素周期表中短周期的下列内容,用对应的化学符号回答问题:
(1)元素①~⑨形成的单质中,化学性质最稳定的是___________ 。⑤在元素周期表中的位置是___________ 。
(2)③、⑨和H元素可形成一种常见的盐,其电子式为___________ ,其中存在的化学键类型为___________ 。用电子式表示⑥和⑨形成化合物的过程:___________ 。
(3)⑧的一种核素原子的中子数与其核外电子数相同,则该核素是___________ ,其离子结构示意图___________ 。
(4)④、⑧元素各自形成的简单氢化物的沸点较高的是___________ ,原因___________ 。
(5)写出一个可证明②和⑦非金属性强弱的离子方程式:_____
(6)单质②与⑧对应的最高价氧化物的水化物的浓溶液反应的化学方程式:___________ 。
| H | ① | ||||||
| ② | ③ | ④ | ⑤ | ||||
| ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)元素①~⑨形成的单质中,化学性质最稳定的是
(2)③、⑨和H元素可形成一种常见的盐,其电子式为
(3)⑧的一种核素原子的中子数与其核外电子数相同,则该核素是
(4)④、⑧元素各自形成的简单氢化物的沸点较高的是
(5)写出一个可证明②和⑦非金属性强弱的离子方程式:
(6)单质②与⑧对应的最高价氧化物的水化物的浓溶液反应的化学方程式:
您最近一年使用:0次



