名校
1 . 下表列出了 A〜R 9种元系在周期表中的位置
(1) 这9中元素中金属性最强的是_________________ ;(填元素符号)
(2) 化学性质最不活泼的元素是_________________ ;(填元素符号)
(3) G的最高价含氧酸的化学式是_________________ ;
(4) 写出一个化学方程式证明G和H的非金属性强弱____________________ 。
族 周期 | IA | IIA | ⅢA | IVA | VA | VIA | ⅦA | 0 |
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1) 这9中元素中金属性最强的是
(2) 化学性质最不活泼的元素是
(3) G的最高价含氧酸的化学式是
(4) 写出一个化学方程式证明G和H的非金属性强弱
您最近一年使用:0次
名校
2 . 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
I.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
_________ 与盐酸反应最剧烈;________ 与盐酸反应的速度最慢;_________ 与盐酸反应产生的气体最多。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH碱性强于NH3·H2O,继而可以验证Na的金属性强于氮,你认为此设计是否合理?并说明理由___________ 。
II. 利用如图装置可验证同主族元素非金属性的变化规律。
(3)仪器B的名称为________ ,干燥管D的作用为_______ 。
(4)若要证明非金属性Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________ (填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_______ 溶液吸收尾气。
(5)若要证明非金属性C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_____ (填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________ 溶液的洗气瓶除去。
I.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH碱性强于NH3·H2O,继而可以验证Na的金属性强于氮,你认为此设计是否合理?并说明理由
II. 利用如图装置可验证同主族元素非金属性的变化规律。
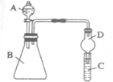
(3)仪器B的名称为
(4)若要证明非金属性Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液
(5)若要证明非金属性C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液
您最近一年使用:0次
2017-04-01更新
|
586次组卷
|
2卷引用:2016-2017学年山东省枣庄市第八中学北校区高一下学期第一次月考化学试卷
名校
3 . 下列为元素周期表中的一部分:

已知:⑤的氢化物常温下为气体,该气体可使湿润的红色石蕊试纸变蓝。
用化学式或元素符号回答下列问题:
(1) ④在周期表中的位置_______ 。
(2) ①②③中,最高价氧化物对应的水化物碱性最强的物质的电子式为_________ 。
(3) ①②⑥的简单离子半径由大到小的顺序是___________ 。(填离子符号)
(4) 用一个化学方程式证明Cl元素与⑦非金属性的强弱:____________ 。
(5) ①和⑥形成的一种化合物A中含有一种10电子微粒和一种18电子微粒,则A中含有的化学键类型为______ 。
(6) ⑥、⑦分别形成的氢化物沸点高的是_______ (填化学式)。原因是_______ 。
(7) ①、③分别形成的最高价氧化物对应的水化物相互反应的离子方程式为_________ 。

已知:⑤的氢化物常温下为气体,该气体可使湿润的红色石蕊试纸变蓝。
用化学式或元素符号回答下列问题:
(1) ④在周期表中的位置
(2) ①②③中,最高价氧化物对应的水化物碱性最强的物质的电子式为
(3) ①②⑥的简单离子半径由大到小的顺序是
(4) 用一个化学方程式证明Cl元素与⑦非金属性的强弱:
(5) ①和⑥形成的一种化合物A中含有一种10电子微粒和一种18电子微粒,则A中含有的化学键类型为
(6) ⑥、⑦分别形成的氢化物沸点高的是
(7) ①、③分别形成的最高价氧化物对应的水化物相互反应的离子方程式为
您最近一年使用:0次
名校
4 . 根据所学知识,回答下列问题:
(1)元素周期表1~20号元素中,金属性最强的元素是__________ (填元素符号,下同);属于稀有气体的是________________ ;非金属性最强的元素在周期表中的位置是_______________________ 。
(2)已知NO2和N2O4之间发生可逆反应:2NO2 (g) (红棕色) N2O4(g) (无色)。将装有NO2 和N2O4混合气体的烧瓶浸入热水中,观察到的现象是
N2O4(g) (无色)。将装有NO2 和N2O4混合气体的烧瓶浸入热水中,观察到的现象是____________________ ,产生该现象的原因是____________________________________ 。
(3)一定条件下,向2L恒容密闭容器中按体积比1:3充入4.48L(标准状况)N2和H2的混合气体,发生反应N2(g)+3H2(g) 2NH3(g),3min时反应达到平衡状态,测得c(N2)=0.02mol·L-1。
2NH3(g),3min时反应达到平衡状态,测得c(N2)=0.02mol·L-1。
① 0~3min内,v (NH3)=___________________ 。
②下列叙述可证明上述反应达到平衡状态的是_________ (填序号)。
a. v(H2)= 3 v(N2) b.容器内压强保持不变
c.每消耗1mol N2,同时生成2mol NH3
d. N2、H2和NH3的物质的量浓度不再变化
(1)元素周期表1~20号元素中,金属性最强的元素是
(2)已知NO2和N2O4之间发生可逆反应:2NO2 (g) (红棕色)
 N2O4(g) (无色)。将装有NO2 和N2O4混合气体的烧瓶浸入热水中,观察到的现象是
N2O4(g) (无色)。将装有NO2 和N2O4混合气体的烧瓶浸入热水中,观察到的现象是(3)一定条件下,向2L恒容密闭容器中按体积比1:3充入4.48L(标准状况)N2和H2的混合气体,发生反应N2(g)+3H2(g)
 2NH3(g),3min时反应达到平衡状态,测得c(N2)=0.02mol·L-1。
2NH3(g),3min时反应达到平衡状态,测得c(N2)=0.02mol·L-1。① 0~3min内,v (NH3)=
②下列叙述可证明上述反应达到平衡状态的是
a. v(H2)= 3 v(N2) b.容器内压强保持不变
c.每消耗1mol N2,同时生成2mol NH3
d. N2、H2和NH3的物质的量浓度不再变化
您最近一年使用:0次
2017-05-17更新
|
278次组卷
|
2卷引用:山东省潍坊市2016-2017学年高一下学期期中考试化学试题
名校
解题方法
5 . 下图为元素周期表的一部分,参照元素①~⑩在表中的位置,请用化学用语作答:
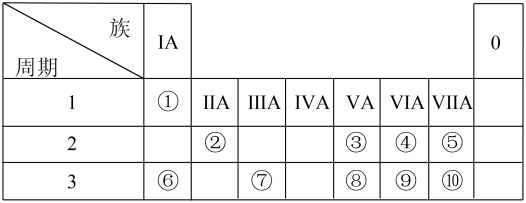
(1)⑤、⑥、⑦的离子半径由大到小的顺序为_________ 。(填离子符号)
(2)⑧、⑨、⑩的最高价含氧酸的酸性由强到弱为_______ 。(用化学式表示)
(3)写出⑥在空气中加热生成的产物的电子式:_______ 。与⑧同族的砷(As)的原子结构示意图为_____________ 。
(4)⑦和⑩形成的化合物的物理性质非常特殊,其的熔点为190℃(2.02×105Pa),但在180℃就开始升华。据此判断,该是_______ (填“共价化合物”或“离子化合物”) ,可以证明你的判断正确的实验依据是________________ 。
(5)表中所列元素的原子间反应最容易形成离子键的是_________ (填元素符号)。⑧与⑩元素形成的常见分子中所有原子______ (填“是”或“不是”)都满足最外层为8电子结构。
(6)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式:______________ 。

(1)⑤、⑥、⑦的离子半径由大到小的顺序为
(2)⑧、⑨、⑩的最高价含氧酸的酸性由强到弱为
(3)写出⑥在空气中加热生成的产物的电子式:
(4)⑦和⑩形成的化合物的物理性质非常特殊,其的熔点为190℃(2.02×105Pa),但在180℃就开始升华。据此判断,该是
(5)表中所列元素的原子间反应最容易形成离子键的是
(6)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式:
您最近一年使用:0次
6 . 短周期主族元素 A、B、C、D、E、F 的原子序数依次增大,A 原子核外最外 层电子数是其电子层数的 2 倍,A、B 的核电荷数之比为 3:4。C 与 D 均为金属元素,5.8 g D 的氢氧化物恰好能与 100 mL 2 mol·L-1 盐酸完全反应,D 原子核中质子数和中子数相等。E 与F 相邻,F-的最外层为 8 电子结构。根据上述条件,用化.学.用.语.回答:
(1)D 在周期表中的位置____ ;
(2)B、C 易形成淡黄色化合物,其电子式为____ ,该物质含有的化学键 类型为_____ ;
(3)用电子式表示 DF2 的形成过程____ ;
(4)元素 E、F 中非金属性较强的是____ ,请用一个置换反应证明____ (写化学反应方程式);
(5)原子半径:C____ E;熔点:DB____ CF(填“>”“<”或“=”);
(6)A、B、E 可形成一个三原子分子,且每个原子均达到 8 电子稳定结构,则该分子的 结构式为____ ;含 A元素的化合物在是自然界种类最多的原因是____ 。
(1)D 在周期表中的位置
(2)B、C 易形成淡黄色化合物,其电子式为
(3)用电子式表示 DF2 的形成过程
(4)元素 E、F 中非金属性较强的是
(5)原子半径:C
(6)A、B、E 可形成一个三原子分子,且每个原子均达到 8 电子稳定结构,则该分子的 结构式为
您最近一年使用:0次
13-14高三上·上海虹口·期末
7 . 下表中所列的字母分别代表某一化学元素。完成下列填空:
(1)h的最外层有____ 种运动状态的电子。a、b、c三种元素形成的化合物电子式为________ 。
(2)d单质溶于i的最高价氧化物对应水化物的溶液时发生反应的离子方程式为____________ 。
(3) 元素e与f元素相比,非金属性较强的是__________ (写元素符号),下列表述中能证明这一事实的是__________ (选填序号)。
a. e的阴离子还原性强于f的阴离子 b. f的氢化物酸性强于e的氢化物
c. e单质的熔点高于f单质 d. e和f形成的化合物中,e显正价,f显负价
(4)元素X(非a~i元素)是所在周期原子半径最大的非金属元素,它的气态氢化物为三角锥形极性分子,写出X在周期表中的位置_______________________________ 。
| a | |||||||||||||||||
| b | |||||||||||||||||
| c | d | e | f | ||||||||||||||
| g | |||||||||||||||||
| h | |||||||||||||||||
| i | |||||||||||||||||
(1)h的最外层有
(2)d单质溶于i的最高价氧化物对应水化物的溶液时发生反应的离子方程式为
(3) 元素e与f元素相比,非金属性较强的是
a. e的阴离子还原性强于f的阴离子 b. f的氢化物酸性强于e的氢化物
c. e单质的熔点高于f单质 d. e和f形成的化合物中,e显正价,f显负价
(4)元素X(非a~i元素)是所在周期原子半径最大的非金属元素,它的气态氢化物为三角锥形极性分子,写出X在周期表中的位置
您最近一年使用:0次
12-13高一下·甘肃天水·期中
8 . 如图是元素周期表的框架,请在表中①~⑩元素中回答问题

请用化学语言回答下列问题:
(1)在表中④、⑤、⑥三种元素的简单离子半径由大到小的顺序为______。
(2)其中⑤与⑦两元素的最高价氧化物的水化物反应的离子方程式为______。
(3)⑧与⑩两种元素非金属较强的是______,请用一个离子方程式证明该结论______。
(4)①与③的两种单质可以在金属铂做电极时构成一种对环境友好的燃料电池,电解质为⑨的最高价氧化物的水化物,请书写出正极反应式______,电池工作时阴离子定向移动到______极(填正或负)。
(5)元素①与⑧的两种单质在一定条件下可反应生成一种化合物甲,已知下表中的数据是破坏1mol物质中的化学键所吸收的能量(kJ),则生成1mol甲时释放的能量为______kJ。

请用化学语言回答下列问题:
(1)在表中④、⑤、⑥三种元素的简单离子半径由大到小的顺序为______。
(2)其中⑤与⑦两元素的最高价氧化物的水化物反应的离子方程式为______。
(3)⑧与⑩两种元素非金属较强的是______,请用一个离子方程式证明该结论______。
(4)①与③的两种单质可以在金属铂做电极时构成一种对环境友好的燃料电池,电解质为⑨的最高价氧化物的水化物,请书写出正极反应式______,电池工作时阴离子定向移动到______极(填正或负)。
(5)元素①与⑧的两种单质在一定条件下可反应生成一种化合物甲,已知下表中的数据是破坏1mol物质中的化学键所吸收的能量(kJ),则生成1mol甲时释放的能量为______kJ。
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
您最近一年使用:0次
2016-12-09更新
|
987次组卷
|
3卷引用:2012-2013学年甘肃省甘谷县甘谷一中高一下学期期中考试化学试卷
9 . (8分)下表是元素周期表的一部分, 针对表中的①~⑥元素,填写下列空白:
(1)在这些元素中,化学性质最活泼的金属元素是:_______ (填具体元素符号)。
(2)元素②与⑥形成的BA型化合物所含的化学键类型为:______ 键。
(3)元素④的单质制造的器具不能盛装碱性溶液也不能盛装酸性溶液,请写出元素④的单质与氢氧化钠溶液反应的离子方程式:__________ 。
(4)设计实验证明:元素①比元素⑤的非金属性强:______ 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 二 | ① | |||||||
| 三 | ② | ③ | ④ | ⑤ | ⑥ |
(1)在这些元素中,化学性质最活泼的金属元素是:
(2)元素②与⑥形成的BA型化合物所含的化学键类型为:
(3)元素④的单质制造的器具不能盛装碱性溶液也不能盛装酸性溶液,请写出元素④的单质与氢氧化钠溶液反应的离子方程式:
(4)设计实验证明:元素①比元素⑤的非金属性强:
您最近一年使用:0次
9-10高一下·广东佛山·期末
解题方法
10 . W、X、Y、Z是原子序数依次增大的同一短同期的四种元素。W、X是金属元素,Y、Z是非金属元素。Y的氧化物是现代光学及光纤制品的基本原料。请回答:
(1)Y元素原子结构示意图________________________ 。
(2)将Z单质通入水中,可得到具有漂白作用的溶液,请写出反应的化学方程式:
___________________________________________________________________ 。
(3)0.5 mol X单质与足量W的最高价氧化物对应水化物的溶液发生反应,生成
气体的体积(标准状况)为_________________ 。
(4)WZ是生活中常见的盐,实验室检验该盐中阴离子的操作方法和现象为:取
少量WZ固体溶于水,滴加稀硝酸和硝酸银溶液,若产生白色沉淀,则证明WZ中
有该阴离子。请写出反应的离子方程式:__________________________________
(1)Y元素原子结构示意图
(2)将Z单质通入水中,可得到具有漂白作用的溶液,请写出反应的化学方程式:
(3)0.5 mol X单质与足量W的最高价氧化物对应水化物的溶液发生反应,生成
气体的体积(标准状况)为
(4)WZ是生活中常见的盐,实验室检验该盐中阴离子的操作方法和现象为:取
少量WZ固体溶于水,滴加稀硝酸和硝酸银溶液,若产生白色沉淀,则证明WZ中
有该阴离子。请写出反应的离子方程式:
您最近一年使用:0次



