11-12高三上·福建三明·阶段练习
1 . 下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问题:
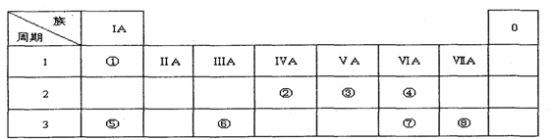
I.(1)请画出元素⑧的离子结构示意图_______________ 。
(2)元素⑦中质子数和中子数相等的同位素符号是_____________ 。
(3)④、⑤、⑦的原子半径由大到小的顺序为_________________ 。(用半径符号表示)
(4)⑦和⑧的最高价氧化物对应水化物的酸性强弱为_____________ >___________ 。
II.由表中①~⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答:
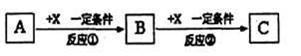
(1)若X是强氧化性单质,则A不可能是___________ (填序号)。
a.S b.N2 c.C d.Al
(2)若A是饮食中的有机物,B与C分子量相差16,则写出A与C反应的方程式,并指出反应类型_____________________________________________________
(3)若A、B、C为含有同一非金属元素的非电解质,写出符合上述关系A转化为B的化学方程式:_______________________________________

I.(1)请画出元素⑧的离子结构示意图
(2)元素⑦中质子数和中子数相等的同位素符号是
(3)④、⑤、⑦的原子半径由大到小的顺序为
(4)⑦和⑧的最高价氧化物对应水化物的酸性强弱为
II.由表中①~⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答:

(1)若X是强氧化性单质,则A不可能是
a.S b.N2 c.C d.Al
(2)若A是饮食中的有机物,B与C分子量相差16,则写出A与C反应的方程式,并指出反应类型
(3)若A、B、C为含有同一非金属元素的非电解质,写出符合上述关系A转化为B的化学方程式:
您最近一年使用:0次
23-24高二上·浙江杭州·期末
2 . 氧(O)、硫(S)、硒、碲(Te)、钋(Po)、鉝(Lv)为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1)硒_______ (填元素符号);鉝(Lv)_______ (填原子序数);
(2)碲有多种同位素原子,其中的核素是128 Te,它的中子数为_______ ;
(3)还原性:H2O_______ H2S (填">"或"<")
(4)氧常见的氢化物有两种,双氧水(H2O2)和水。双氧水在实验室和实际生产生活都有重要的作用。
①写出H2O2的电子式:_______ 。
②金属Al加到双氧水与NaOH的混合溶液中,金属Al溶解,写出反应的离子方程式_______ ;
③S2Cl2有类似于H2O2的性质,该物质遇水不稳定,生成一种黄色沉淀和无色有刺激性气味的气体,还得到一种强酸溶液,试写出该过程的反应方程式_______ ;
④实验室制氧气有多种方法,下列反应可以用来实验室制氧气的是_______ 。
A.氯酸钾加少量高锰酸钾受热分解
B.双氧水加二氧化锰
C.过氧化钠加水
D.过氧化钠中通二氧化碳
E.次氯酸受热分解
(1)硒
(2)碲有多种同位素原子,其中的核素是128 Te,它的中子数为
(3)还原性:H2O
(4)氧常见的氢化物有两种,双氧水(H2O2)和水。双氧水在实验室和实际生产生活都有重要的作用。
①写出H2O2的电子式:
②金属Al加到双氧水与NaOH的混合溶液中,金属Al溶解,写出反应的离子方程式
③S2Cl2有类似于H2O2的性质,该物质遇水不稳定,生成一种黄色沉淀和无色有刺激性气味的气体,还得到一种强酸溶液,试写出该过程的反应方程式
④实验室制氧气有多种方法,下列反应可以用来实验室制氧气的是
A.氯酸钾加少量高锰酸钾受热分解
B.双氧水加二氧化锰
C.过氧化钠加水
D.过氧化钠中通二氧化碳
E.次氯酸受热分解
您最近一年使用:0次
名校
3 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系,下图是元素周期表的一部分,回答下列问题:
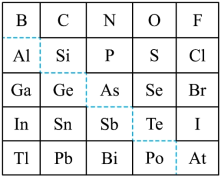
(1)元素Ga在元素周期表中的位置为:______ ;
(2)Sn的最高正价为______ ,C1的最高价氧化物对应水化物的化学式为______ ;
(3)根据元素周期律,推断
①表中元素形成的氢化物中热稳定性最高的是______ (写化学式),其电子式为______ 。
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4______ H2SeO4(填“>”、<”、“=”或“无法比较”);
③氢化物的还原性:H2O______ H2S(填“>”、“<”、“=”或“无法比较”)。
④原子半径比较:N______ Si(填“>”、“<”、“=”或“无法比较”)。

(1)元素Ga在元素周期表中的位置为:
(2)Sn的最高正价为
(3)根据元素周期律,推断
①表中元素形成的氢化物中热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4
③氢化物的还原性:H2O
④原子半径比较:N
您最近一年使用:0次
名校
4 . 下表是元素周期表的一部分,请用标出的元素回答有关问题:
⑴表中给出的化学性质最不活泼的元素,其原子结构示意图为__________________ 。
⑵表中能形成两性氢氧化物的元素是___________ (用元素符号表示),写出该元素形成的单质与⑨最高价氧化物对应的水化物反应的离子方程式:_______________________ 。
⑶用电子式表示④元素与⑦元素形成化合物的过程___________________________ 。
⑷写出②的最高价氧化物对应的水化物与其简单气态氢化物反应的生成物的化学式___________ 。
⑸③元素与⑩元素两者核电荷数之差是______________ 。
⑹为探究元素性质的递变规律,某化学兴趣小组将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由。______ ;_______________ 。
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
⑴表中给出的化学性质最不活泼的元素,其原子结构示意图为
⑵表中能形成两性氢氧化物的元素是
⑶用电子式表示④元素与⑦元素形成化合物的过程
⑷写出②的最高价氧化物对应的水化物与其简单气态氢化物反应的生成物的化学式
⑸③元素与⑩元素两者核电荷数之差是
⑹为探究元素性质的递变规律,某化学兴趣小组将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由。
您最近一年使用:0次
名校
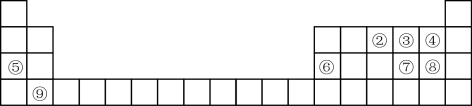
5 . 下表为元素周期表的一部分,用化学用语回答下列问题:___________ 。
(2)⑥、⑦、⑧、③的简单离子的半径由大到小顺序为___________ 。(写离子符号)
(3)元素③、⑤、⑧组成的化合物是84消毒液的主要成分,可以在碱性条件下处理CN-,将CN-氧化成CO 和N2,写出反应的离子方程式
和N2,写出反应的离子方程式___________ 。
(4)将⑤和⑥单质各1mol投入足量水中,充分反应后,所得溶液体积为500mL,则该过程可得标况下气体体积___________ L。最终获得溶液的物质的量浓度为___________ mol/L。
(2)⑥、⑦、⑧、③的简单离子的半径由大到小顺序为
(3)元素③、⑤、⑧组成的化合物是84消毒液的主要成分,可以在碱性条件下处理CN-,将CN-氧化成CO
 和N2,写出反应的离子方程式
和N2,写出反应的离子方程式(4)将⑤和⑥单质各1mol投入足量水中,充分反应后,所得溶液体积为500mL,则该过程可得标况下气体体积
您最近一年使用:0次
23-24高二上·浙江·期末
解题方法
6 . 为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:
(1)据汞的原子结构示意图,汞在第_______ 周期。

(2)硒(Se)与硫位于同主族,均是生命必需元素。下列推断不正确的是_______ 。
a.硒元素的最低负化合价为-2
b.二氧化硒(SeO2)具有还原性
c.硒的氧化物对应的水化物属于强酸
(3)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是75As,它的中子数为_______ 。
②已知NH4Cl与PH4I的性质相似,则对PH4I性质的推测不正确的是_______ (填序号)。
a.含有离子键和共价键 b.能与NaOH溶液反应
c.与NH4Cl加热充分分解产物的种类完全一样
③下列关于第VA族元素及其化合物的说法不正确的是_______ (填字母)。
a.热稳定性:NH3>PH3
b.酸性:HNO3>H3AsO4
c. As的氧化物的水化物是强碱
d.形成的简单离子半径随着原子序数递增而增大
(1)据汞的原子结构示意图,汞在第

(2)硒(Se)与硫位于同主族,均是生命必需元素。下列推断不正确的是
a.硒元素的最低负化合价为-2
b.二氧化硒(SeO2)具有还原性
c.硒的氧化物对应的水化物属于强酸
(3)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是75As,它的中子数为
②已知NH4Cl与PH4I的性质相似,则对PH4I性质的推测不正确的是
a.含有离子键和共价键 b.能与NaOH溶液反应
c.与NH4Cl加热充分分解产物的种类完全一样
③下列关于第VA族元素及其化合物的说法不正确的是
a.热稳定性:NH3>PH3
b.酸性:HNO3>H3AsO4
c. As的氧化物的水化物是强碱
d.形成的简单离子半径随着原子序数递增而增大
您最近一年使用:0次
7 . 下表是元素周期表的一部分。请按要求回答下列问题:
(1)氧元素在周期表中的位置是___________ ,⑦的最高价氧化物对应水化物的化学式___________ 。
(2)上述所列元素最高价氧化物对应水化物碱性最强的是___________ (填化学式)。
(3)写出由上述所列元素形成的18电子的双原子分子的化学式___________ 。
(4)已知X为第四周期第IIIA族元素,其原子序数为a,Y与X位于同一周期,且为第IIA族元素,写出Y的原子序数b=___________ (用含a的代数式表示)。
(5)下列说法不正确的是___________。
(6)BrCl属于卤素互化物,性质与Cl2相似。写出BrCl与氢氧化钠溶液反应的化学方程式___________ 。
族 周期 | IA | 0 | ||||||
| 1 | ④ | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ⑦ | |||||
| 4 | ② | ⑧ | ||||||
(2)上述所列元素最高价氧化物对应水化物碱性最强的是
(3)写出由上述所列元素形成的18电子的双原子分子的化学式
(4)已知X为第四周期第IIIA族元素,其原子序数为a,Y与X位于同一周期,且为第IIA族元素,写出Y的原子序数b=
(5)下列说法不正确的是___________。
| A.⑥形成的最简单氢化物比⑤形成的最简单氢化物的稳定性高 |
| B.元素最高正价与最低负价绝对值相等的元素一定处于第IVA族 |
| C.第5周期第VIIA族元素的原子序数为53 |
| D.周期表中当某元素的周期序数大于其主族序数时,该元素可能属于金属或非金属 |
您最近一年使用:0次
8 . 元素在周期表中的位置反映了元素的原子结构和元素的性质。针对下表中的①~⑩种元素,回答以下问题:

(1)第三周期金属元素中原子半径最小的元素为________ (写序号);表中的X元素在第________ 周期第________ 族。
(2)④、⑤分别与①元素组成含10个电子的分子化学式分别为________ 、________ ;
(3)通过单质之间的置换反应,可以比较卤素单质的氧化性强弱。请用离子方程式表示⑧和⑨元素单质的氧化性强弱:________________ ;
(4)用电子式表示②与⑦形成化合物的过程:________________ ;
(5)由①②⑤元素组成的化合物的化学键类型为________ 、________ ;
(6)写出能证明②的金属性强于③的化学事实________ (任写一条)。

(1)第三周期金属元素中原子半径最小的元素为
(2)④、⑤分别与①元素组成含10个电子的分子化学式分别为
(3)通过单质之间的置换反应,可以比较卤素单质的氧化性强弱。请用离子方程式表示⑧和⑨元素单质的氧化性强弱:
(4)用电子式表示②与⑦形成化合物的过程:
(5)由①②⑤元素组成的化合物的化学键类型为
(6)写出能证明②的金属性强于③的化学事实
您最近一年使用:0次
解题方法
9 . 回答下列问题。
(1)下表是元素周期表的一部分,将 Na、Mg、Al 三种元素填入相应位置。___________
(2)Na、Mg、Al这三种元素中,原子半径由大到小的顺序是___________ 。
(3)由于金属离子的氧化性强弱存在差异,使得它们被还原为单质的难易程度不同,因此金属冶炼的方法不同,活泼金属常用电解法冶炼。下列金属需要使用电解法冶炼的是___________。
(1)下表是元素周期表的一部分,将 Na、Mg、Al 三种元素填入相应位置。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ||||||||
| 二 | ||||||||
| 三 | ||||||||
(2)Na、Mg、Al这三种元素中,原子半径由大到小的顺序是
(3)由于金属离子的氧化性强弱存在差异,使得它们被还原为单质的难易程度不同,因此金属冶炼的方法不同,活泼金属常用电解法冶炼。下列金属需要使用电解法冶炼的是___________。
| A.Na | B.Fe | C.Cu | D.Au |
您最近一年使用:0次
解题方法
10 . 下表是元素周期表的一部分。请按要求回答下列问题:___________ ,⑦的最高价氧化物对应水化物的化学式___________ 。
(2)上述所列元素最高价氧化物对应水化物碱性最强的是___________ (填化学式)。
(3)写出由上述所列元素形成的18电子的双原子分子的化学式___________ 。
(4)下列说法不正确的是___________。
(5)BrCl属于卤素互化物,性质与Cl2相似。写出BrCl与氢氧化钠溶液反应的化学方程式___________ 。
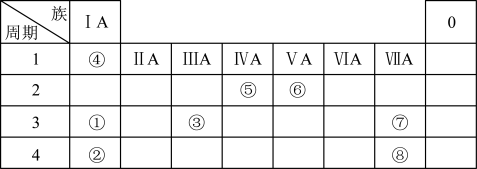
(2)上述所列元素最高价氧化物对应水化物碱性最强的是
(3)写出由上述所列元素形成的18电子的双原子分子的化学式
(4)下列说法不正确的是___________。
| A.⑥形成的最简单氢化物比⑤形成的最简单氢化物的稳定性高 |
| B.元素最高正价与最低负价绝对值相等的元素一定处于第ⅣA族 |
| C.第5周期第ⅦA族元素的原子序数为53 |
| D.周期表中当某元素的周期序数大于其主族序数时,该元素可能属于金属或非金属 |
(5)BrCl属于卤素互化物,性质与Cl2相似。写出BrCl与氢氧化钠溶液反应的化学方程式
您最近一年使用:0次



