名校
1 . 下图是中学教材中元素周期表的一部分,其中标出A-Q14种元素,试回答下列问题:[(1) (2)问用具体的元素符号或离子符号或化学式回答]
(1)在上表所列出的短周期元素中
①性质最不活泼的是_______ ;②原子半径最大的是_____ (除稀有气体元素)
③形成的气态氢化物最稳定的是_______ ;
④最高价氧化物对应的水化物中酸性最强的是_______ 碱性最强的是_______ 。
⑤形成的阴离子还原性最弱的是_______ ,阳离子半径最小的是_______ 。
(2)用电子式表示F与D形成化合物的过程
________________________________________________________________________ ;
(3)设P的原子序数为Z,则F的原子序数为___________ ,Q的原子序数为____________ 。
| A | B | C | D | ||||||||||||||
| E | F | G | H | I | J | K | L | ||||||||||
| P | Q |
(1)在上表所列出的短周期元素中
①性质最不活泼的是
③形成的气态氢化物最稳定的是
④最高价氧化物对应的水化物中酸性最强的是
⑤形成的阴离子还原性最弱的是
(2)用电子式表示F与D形成化合物的过程
(3)设P的原子序数为Z,则F的原子序数为
您最近一年使用:0次
名校
2 . 下表是元素周期表的一部分,表中字母分别代表一种元素。回答下列问题。
(1)表中所标元素,最活泼的金属元素形成简单离子符号为____ ;最不活泼的元素的原子结构示意图为 _____ ;其中一种元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该盐是_______ 。
(2)写出两种满足下列条件的物质______ (写化学式)。
①由c、x、e组成的;②含有共价键的离子化合物。
(3)g、x、y的气态氢化物,最稳定的是______ (填化学式)。
(4)表中元素的最高价氧化物的水化物中:酸性最强的是______ (填化学式,下同);碱性最强的是_______ ,这两种物质反应的离子方程式为_________ 。
(5)推测元素的非金属性:a______ g(填“>”或“<”)。利用图装置设计实验,证明推测结论。

①仪器A的名称为___________ ,干燥管D的作用是______________ 。
②填空。
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | a | b | c | d | ||||
| 3 | e | f | g | x | y | z |
(2)写出两种满足下列条件的物质
①由c、x、e组成的;②含有共价键的离子化合物。
(3)g、x、y的气态氢化物,最稳定的是
(4)表中元素的最高价氧化物的水化物中:酸性最强的是
(5)推测元素的非金属性:a

①仪器A的名称为
②填空。
| 装置内试剂 | C中发生反应的化学方程式 | ||
| A | B | C | |
| 稀硫酸 | 碳酸钠 | ||
您最近一年使用:0次
名校
3 . 下表是元素周期表的一部分。
(1) 和
和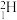 互为
互为___________ ,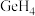 分子的空间结构为
分子的空间结构为___________ 。
(2) 为
为___________ (填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为___________ 。
(3)能作为氯、溴、碘元素非金属性递变规律的判断依据是___________。
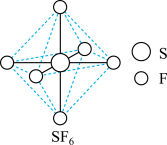
(4) 分子的空间结构为正八面体形,如图所示。
分子的空间结构为正八面体形,如图所示。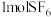 中含有
中含有___________ 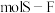 键,它的一氯代物
键,它的一氯代物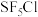 有
有___________ 种。
(5)研究发现,给小鼠喂食适量硒酸钠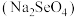 可减轻重金属铊引起的中毒。Na、Se、O形成的简单离子的半径由大到小的顺序为
可减轻重金属铊引起的中毒。Na、Se、O形成的简单离子的半径由大到小的顺序为___________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | H | ||||||
| 二 | C | O | F | ||||
| 三 | Na | Si | S | Cl | |||
| 四 | Ca | Ge | Se | Br |
 和
和 互为
互为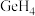 分子的空间结构为
分子的空间结构为(2)
 为
为(3)能作为氯、溴、碘元素非金属性递变规律的判断依据是___________。
A. , , , , 的熔点 的熔点 | B. , , , , 的氧化性 的氧化性 |
C. 、 、 、 、 的热稳定性 的热稳定性 | D. 、 、 、 、 的酸性 的酸性 |
 分子的空间结构为正八面体形,如图所示。
分子的空间结构为正八面体形,如图所示。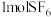 中含有
中含有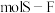 键,它的一氯代物
键,它的一氯代物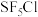 有
有
(5)研究发现,给小鼠喂食适量硒酸钠
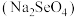 可减轻重金属铊引起的中毒。Na、Se、O形成的简单离子的半径由大到小的顺序为
可减轻重金属铊引起的中毒。Na、Se、O形成的简单离子的半径由大到小的顺序为
您最近一年使用:0次
解题方法
4 . 含氯物质在生产、生活中有重要作用。工业上常用次氯酸钠处理含有NO等氮氧化物的尾气,反应方程式如下:NaClO + NO + H2O —— NaCl + HNO3 (未配平)。完成下列填空。
(1)氯在元素周期表中的位置是______________________________ ,其所在主族的元素中,最高价氧化物对应的水化物酸性最强的是_______________ (填化学式)。
(2)配平上述反应方程式_______ 。
每有0.3mol电子发生转移,可消耗标准状况下NO气体的体积约为____________ L。
(3)NaClO溶液中存在如下关系:c(OH-)_____ c(HClO)(填“>”、“=”、或“<”)。
其他条件相同,随着NaClO溶液初始pH(用稀硫酸调节)的不同,NO转化率如图。
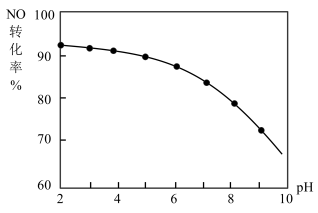
(4)NaClO溶液的初始pH越大,NO的转化率越________________ (填“高”或“低”),其原因是_____________________ 。取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
(5)取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
请将表格填写完整。
(1)氯在元素周期表中的位置是
(2)配平上述反应方程式
每有0.3mol电子发生转移,可消耗标准状况下NO气体的体积约为
(3)NaClO溶液中存在如下关系:c(OH-)
其他条件相同,随着NaClO溶液初始pH(用稀硫酸调节)的不同,NO转化率如图。

(4)NaClO溶液的初始pH越大,NO的转化率越
(5)取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
请将表格填写完整。
滴加KI溶液 | 再滴加CCl4,振荡、静置 | 结论 | |
A试管 | 溶液变为棕黄色 | 溶液分层,下层显 | 氧化性强弱:(填“>”或“<”) KClO3 |
B试管 | 无现象 | 溶液分层,均无色 |
您最近一年使用:0次
解题方法
5 . 下表是元素周期表的一部分,针对a~k十一种元素回答下列问题(请用具体化学式回答,否则不给分):
(1)这些元素中非金属性最强的单质是_________ ,最高价氧化物对应水化物酸性最强的是_________ ,最高价氧化物对应水化物碱性最强的是_________ 。
(2)表中k的氢化物的化学式为_____ ,它的还原性比j的氢化物还原性_______ (填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性_______ (填“强”或“弱”)。
(3)e单质为________ ,其结构式为________________ 。
(4)用电子式表示h与k构成化合物的形成过程________________
(5)写出i的氧化物与强碱溶液反应的离子方程式________________
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热。将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应。下列说法正确的是____ (填写选项)。
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
(1)这些元素中非金属性最强的单质是
(2)表中k的氢化物的化学式为
(3)e单质为
(4)用电子式表示h与k构成化合物的形成过程
(5)写出i的氧化物与强碱溶液反应的离子方程式
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热。将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应。下列说法正确的是
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡
您最近一年使用:0次
2016-12-09更新
|
434次组卷
|
2卷引用:2015-2016学年辽宁葫芦岛一中高二上期初考试化学试卷
名校
6 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
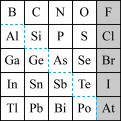
(1)元素Ga的原子结构示意图___________ ,镓(Ga)的氯化物与氨水反应的化学方程式为___________ ,
(2)Ge 的最高价氧化物对应水化物的化学式为___________ ,Bi的最高价氧化物为___________ 。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是___________ 元素(填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4___________ (填“>”“<”或“=”)H2SeO4。
③金属性比较:Tl___________ (填“>”“<”或“=”)Sn。
④氢化物的还原性:H2S___________ (填“>”“<”或“=”)H2O。
(4)工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为___________ 。

(1)元素Ga的原子结构示意图
(2)Ge 的最高价氧化物对应水化物的化学式为
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4
③金属性比较:Tl
④氢化物的还原性:H2S
(4)工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为
您最近一年使用:0次
7 . 在日常生活中,为了达到更好的清洁效果,经常有人会将洁厕液(含有盐酸)与84消毒液混合使用,从而会发生引发中毒的事故。
(1)两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是_______ 。
(2)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:_______ 。
(3)洁厕灵的主要成分是HCl。下列关于卤化氢的性质比较中错误的是_______。
(4)常温下,0.1mol/L的NaClO溶液的PH=9.7,原因_______ 。常温下HClO的电离平衡常数为_______ 。洁厕液与84消毒液混合后会生成有毒的氯气。写出该反应的离子方程式_______ 。
(5)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为_______ 。
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
K2FeO4在水溶液中易水解:4 +10H2O⇌4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
+10H2O⇌4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______ 溶液(填序号)
a.水 b.NH4Cl、异丙醇 c.Fe(NO3)3、异丙醇 d.CH3COONa、异丙醇
(6)消毒效率是物质单位质量得到的电子数,则Cl2与NaClO两种消毒剂的消毒效率之比为__ 。
(1)两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是
(2)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:
(3)洁厕灵的主要成分是HCl。下列关于卤化氢的性质比较中错误的是_______。
| A.酸性:HF>HCl>HBr>HI | B.键能:H—F>H—Cl>H—Br>H—I |
| C.熔点:HF<HCl<HBr<HI | D.还原性:HF<HCl<HBr<HI |
(5)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
K2FeO4在水溶液中易水解:4
 +10H2O⇌4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
+10H2O⇌4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用a.水 b.NH4Cl、异丙醇 c.Fe(NO3)3、异丙醇 d.CH3COONa、异丙醇
(6)消毒效率是物质单位质量得到的电子数,则Cl2与NaClO两种消毒剂的消毒效率之比为
您最近一年使用:0次
8 . 如图1是元素周期表的一部分。回答下列问题:
(1)硒是人体必需的微量元素。
①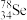 与
与 互称为
互称为_______ 。
②硒元素的气态氢化物的化学式为_______ 。
(2)溴被称为海洋元素。
①溴元素在周期表中的位置为_______ 。
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的是_______ (填化学式)。
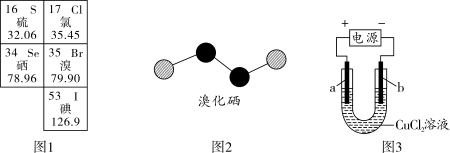
③溴化硒是一种重要的电子元件材料,其分子的球棍模型如图2所示。下列说法正确的是_______ (填字母)。
a.溴化硒属于离子化合物 b.原子半径:r(Se)>r(Br)
c.Se元素的非金属性比Br的强 d.溴化硒的相对分子质量为317.72
(3)氯是卤族元素之一,电解氯化铜溶液可以得到Cl2,实验装置如图3所示。(已知a、b均为石墨电极)
①分别用湿润的淀粉碘化钾试纸置于a、b上方,可观察到的现象是_______ 。
②a电极上的电极反应式为_______ 。
(4)下列事实不能说明氯的非金属性比硫强的是_______ (填字母)。
a.化合物SCl2中硫显正价而氯显负价
b.热稳定性:HCl>H2S
c.将氯气通入Na2S溶液中,有淡黄色沉淀生成
d.次氯酸的氧化性比稀硫酸的氧化性强

(1)硒是人体必需的微量元素。
①
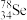 与
与 互称为
互称为②硒元素的气态氢化物的化学式为
(2)溴被称为海洋元素。
①溴元素在周期表中的位置为
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的是
③溴化硒是一种重要的电子元件材料,其分子的球棍模型如图2所示。下列说法正确的是
a.溴化硒属于离子化合物 b.原子半径:r(Se)>r(Br)
c.Se元素的非金属性比Br的强 d.溴化硒的相对分子质量为317.72
(3)氯是卤族元素之一,电解氯化铜溶液可以得到Cl2,实验装置如图3所示。(已知a、b均为石墨电极)
①分别用湿润的淀粉碘化钾试纸置于a、b上方,可观察到的现象是
②a电极上的电极反应式为
(4)下列事实不能说明氯的非金属性比硫强的是
a.化合物SCl2中硫显正价而氯显负价
b.热稳定性:HCl>H2S
c.将氯气通入Na2S溶液中,有淡黄色沉淀生成
d.次氯酸的氧化性比稀硫酸的氧化性强
您最近一年使用:0次
20-21高一下·浙江·阶段练习
解题方法
9 . 1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一。下表是元素周期表的一部分:
注意:用元素符号或化学式填空。
(1)①到⑩号元素中,所形成的氢化物最稳定的是___________ ,最高价氧化物对应的水化物酸性最强的是___________ 。③号元素在元素周期表中的位置是___________ 。
(2)实验室制备②的气态氢化物的化学方程式为___________ 。
(3)元素⑤的最高价氧化物对应水化物含有的化学键类型为:___________ (选填“离子键”“极性键”“非极性键”),其与⑦的最高价氧化物所对应的水化物能相互反应,反应的离子方程式是:___________ 。
(4)下列说法正确的是___________
A.碱金属单质的金属性很强,均易与氧气发生反应,加热时生成的氧化物为R2O
B.一定条件下,随着核电荷数的增加,卤素单质与H2化合越来越难
C.随着核电荷数的增加,卤族单质的氧化性逐渐增强
D.周期表七行七个周期,18列16族
| ① | ||||||||
| ② | ③ | ④ | ||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 过渡元素 | ⑩ |
注意:用元素符号或化学式填空。
(1)①到⑩号元素中,所形成的氢化物最稳定的是
(2)实验室制备②的气态氢化物的化学方程式为
(3)元素⑤的最高价氧化物对应水化物含有的化学键类型为:
(4)下列说法正确的是
A.碱金属单质的金属性很强,均易与氧气发生反应,加热时生成的氧化物为R2O
B.一定条件下,随着核电荷数的增加,卤素单质与H2化合越来越难
C.随着核电荷数的增加,卤族单质的氧化性逐渐增强
D.周期表七行七个周期,18列16族
您最近一年使用:0次
名校
10 . 下表为元素周期表的一部分。
(1)表中元素_______ 的非金属性最强;元素_______ 的金属性最强; (写元素符号)。
(2)表中半径最大的元素是_______ ;(写元素符号)
(3)表中元素⑤、⑥、⑦对应的单质氧化性最强的是_______ ;(写化学式,下同)
(4)表中元素⑥、⑦氢化物的稳定性顺序为_______ ;
(5)表中元素最高价氧化物对应水化物酸性最强的酸是_______ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ⑤ | |||||
| 三 | ③ | ⑥ | |||||
| 四 | ④ | ⑦ | |||||
(1)表中元素
(2)表中半径最大的元素是
(3)表中元素⑤、⑥、⑦对应的单质氧化性最强的是
(4)表中元素⑥、⑦氢化物的稳定性顺序为
(5)表中元素最高价氧化物对应水化物酸性最强的酸是
您最近一年使用:0次



