名校
1 . I.请用下列10种物质的序号填空。
①N2 ②NH4Cl ③RbOH ④ ⑤ KCl ⑥
⑤ KCl ⑥ ⑦
⑦ ⑧H2SO4 ⑨
⑧H2SO4 ⑨ ⑩氦气
⑩氦气
(1)既含离子键又含共价键的是___________ ;只含共价键的的是___________ ;④的电子式为___________ ;⑦的空间构型为:___________ 。
II.下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
针对元素①~⑭回答下列问题。
(2)i.⑪~⑭元素的非金属性由强到弱的顺序为:___________ (填元素符号)。
ii.能作为卤素非金属性递变规律的判断依据的是:___________ 。
A.⑪~⑭元素形成的单质熔点逐渐升高
B.⑪~⑭元素形成的简单离子还原性逐渐增强
C.⑪~⑭元素形成的气态氢化物稳定性逐渐减弱
D.⑪~⑭元素形成的无氧酸酸性逐渐增强
iii.从原子结构角度解释卤素非金属性递变的原因___________ 。
(3)下列关于②~⑤元素叙述正确的是___________。
(4)③⑧⑩元素最高价氧化物对应的水化物之间可以两两发生反应,其中能体现水化物呈“两性”的离子方程式分别为___________ 、___________ 。
(5)上述元素形成的最高价氧化物的水化物中酸性最强的是___________ (用化学式表示)。
(6)元素④⑦⑩⑫对应的具有稳定结构的简单离子的半径由大到小的排序为___________ (用相应的离子符号排序)。
(7)用电子式表示①和⑦形成化合物的过程___________ ,该化合物与水反应的化学方程式是___________ 。
①N2 ②NH4Cl ③RbOH ④
 ⑤ KCl ⑥
⑤ KCl ⑥ ⑦
⑦ ⑧H2SO4 ⑨
⑧H2SO4 ⑨ ⑩氦气
⑩氦气(1)既含离子键又含共价键的是
II.下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
| 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ⑨ | ⑪ | |||||
| 3 | ③ | ⑥ | ⑧ | ⑩ | ⑫ | |||
| 4 | ④ | ⑦ | ⑬ | |||||
| 5 | ⑤ | ⑭ |
(2)i.⑪~⑭元素的非金属性由强到弱的顺序为:
ii.能作为卤素非金属性递变规律的判断依据的是:
A.⑪~⑭元素形成的单质熔点逐渐升高
B.⑪~⑭元素形成的简单离子还原性逐渐增强
C.⑪~⑭元素形成的气态氢化物稳定性逐渐减弱
D.⑪~⑭元素形成的无氧酸酸性逐渐增强
iii.从原子结构角度解释卤素非金属性递变的原因
(3)下列关于②~⑤元素叙述正确的是___________。
| A.从上到下②~⑤单质与水反应越来越剧烈 |
| B.②~⑤单质与氧气反应均可生成过氧化物 |
| C.从上到下②~⑤单质熔沸点逐渐升高 |
| D.②~⑤元素的最高价氧化物的水化物碱性增强 |
(5)上述元素形成的最高价氧化物的水化物中酸性最强的是
(6)元素④⑦⑩⑫对应的具有稳定结构的简单离子的半径由大到小的排序为
(7)用电子式表示①和⑦形成化合物的过程
您最近一年使用:0次
名校
解题方法
2 . 海洋是资源的宝库,蕴藏着丰富的氯、溴、碘等元素。氯、溴、碘是典型的非金属元素,都能与大多数金属化合生成盐,故统称为卤素;卤素单质都具有氧化性。
(1)氯在元素周期表中的位置___________
(2)氯气是重要的化工产品,工业可以由电解氯化钠溶液得到,同时还生成NaOH和H2.写出该电解过程的离子方程式___________
(3)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,它们阴离子的还原性强弱顺序为: 。试写出:在NaBr和KSCN的混合溶液中滴加少量(CN)2,请写出发生反应的离子方程式
。试写出:在NaBr和KSCN的混合溶液中滴加少量(CN)2,请写出发生反应的离子方程式___________ 。
(4)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应: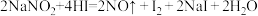
Ⅰ.上述反应的还原剂是___________
Ⅱ.根据上述反应,鉴别某白色固体是NaNO2还是NaCl。可选用的物质有:①水 ②淀粉碘化钾试纸 ③淀粉溶液 ④白酒 ⑤食醋(稀的醋酸溶液),你认为必须选用的物质有___________ (填字母)。
A.③⑤ B.①②⑤ C.①②④
Ⅲ.某厂废液中,含有2%~5%的NaNO2直接排放会造成污染,下列试剂能使NaNO2转化为N2防止污染的是___________ 。(填字母)
A.NaCl B. C.
C. D.浓
D.浓
(1)氯在元素周期表中的位置
(2)氯气是重要的化工产品,工业可以由电解氯化钠溶液得到,同时还生成NaOH和H2.写出该电解过程的离子方程式
(3)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,它们阴离子的还原性强弱顺序为:
 。试写出:在NaBr和KSCN的混合溶液中滴加少量(CN)2,请写出发生反应的离子方程式
。试写出:在NaBr和KSCN的混合溶液中滴加少量(CN)2,请写出发生反应的离子方程式(4)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:
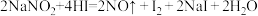
Ⅰ.上述反应的还原剂是
Ⅱ.根据上述反应,鉴别某白色固体是NaNO2还是NaCl。可选用的物质有:①水 ②淀粉碘化钾试纸 ③淀粉溶液 ④白酒 ⑤食醋(稀的醋酸溶液),你认为必须选用的物质有
A.③⑤ B.①②⑤ C.①②④
Ⅲ.某厂废液中,含有2%~5%的NaNO2直接排放会造成污染,下列试剂能使NaNO2转化为N2防止污染的是
A.NaCl B.
 C.
C. D.浓
D.浓
您最近一年使用:0次
名校
解题方法
3 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)②的最高价氧化物的分子式为_______ ;⑦的最高价氧化物对应水化物的分子式为_______ 。
(2)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:_______ 。
(3)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是_______(填字母)。
(4)已知Cs元素位于元素周期表中第六周期第IA族,请回答下列问题:
①铯的原子序数为_______ 。
②铯单质与 反应的化学反应方程式为
反应的化学反应方程式为_______ 。
③预测铯单质的还原性比钠单质的还原性_______ (填“弱”或“强”)。
④下列推断正确的是_______ (填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(5)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为_______ 。
族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:
(3)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是_______(填字母)。
| A.在化合物中最高正化合价为+6 | B.单质可以与 气体反应并置换出单质S 气体反应并置换出单质S |
| C.最高价氧化物对应水化物的酸性比硫酸弱 | D.单质在常温下可与氢气化合 |
①铯的原子序数为
②铯单质与
 反应的化学反应方程式为
反应的化学反应方程式为③预测铯单质的还原性比钠单质的还原性
④下列推断正确的是
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(5)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为
您最近一年使用:0次
2023-11-10更新
|
892次组卷
|
2卷引用:广西柳州铁一中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
4 . 几种主族元素在周期表中的位置如下:
(1)①⑨形成的化合物属于___________ (填“离子化合物”或“共价化合物”),用电子式表示其形成过程___________ 。
(2)以上元素的最高价氧化物对应的水化物的酸性最强的分子式为___________ 。
(3)比较⑦、⑧简单氢化物的还原性:___________ (填化学式);比较①、⑥、⑦三种简单离子的半径大小,其由大到小的顺序___________ (填离子符号)。
(4)下列可以判断①和③金属性强弱的是___________(填字母)。
(5)金属镓 常用作光学玻璃、真空管、半导体的原料。
常用作光学玻璃、真空管、半导体的原料。
预测 的化学性质并填写表格:
的化学性质并填写表格:
以上预测都是依据___________ 。
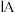 | 0 | |||||||
| 1 | ④ | 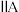 | 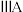 | 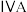 | 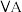 | 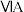 | 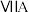 | |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ⑨ | ⑦ | ||||
| 4 | ② |  | ⑧ | |||||
(2)以上元素的最高价氧化物对应的水化物的酸性最强的分子式为
(3)比较⑦、⑧简单氢化物的还原性:
(4)下列可以判断①和③金属性强弱的是___________(填字母)。
A.单质的熔点: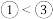 | B.化合价: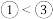 |
| C.单质与水反应的剧烈程度:①>③ | D.最高价氧化物对应水化物的碱性:①>③ |
 常用作光学玻璃、真空管、半导体的原料。
常用作光学玻璃、真空管、半导体的原料。预测
 的化学性质并填写表格:
的化学性质并填写表格:| 预测性质(所填物质类别不同) | 反应后可能的生成物(填化学式) |
 能与 能与 | 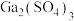 、 、 |
 能与 能与 | 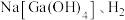 |
您最近一年使用:0次
名校
5 . 下表是元素周期表的一部分,根据表中的①~⑩种元素,按要求填写下列空白:
(1)在这些元素中,化学性质最不活泼元素的原子结构示意图为___________ 。
(2)①用于考古的一种核素符号为___________ 。①和⑦简单氢化物稳定性较差的是___________ (填化学式)。
(3)元素②和⑥对应的离子半径较小的是___________ (填离子符号)。⑤和⑧最高价氧化物对应水化物酸性较强的是___________ (填化学式)。④和⑥最高价氧化物对应水化物碱性较弱的是___________ (填化学式)。
(4)写出②与④形成原子个数为1:2的化合物的电子式___________ 。
(5)下列关于⑩元素硒(Se)说法推断正确的是___________(填标号)。
(6)④和⑥最高价氧化物对应水化物相互反应的离子方程式为___________ 。
| 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ④ | ⑥ | ⑦ | ⑤ | ⑧ | ⑨ | ||
| 4 | ③ | ⑩ |
(2)①用于考古的一种核素符号为
(3)元素②和⑥对应的离子半径较小的是
(4)写出②与④形成原子个数为1:2的化合物的电子式
(5)下列关于⑩元素硒(Se)说法推断正确的是___________(填标号)。
A. 属于共价化合物,只具有还原性 属于共价化合物,只具有还原性 |
B.Se的最低负化合价是负2价;但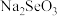 中Se化合价为+4 中Se化合价为+4 |
| C.Se元素非金属性比⑤强 |
| D.Se元素原子半径小于③ |
您最近一年使用:0次
名校
6 . 门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。加上之前发现的碳(C)、铅(Pb)、锡(Sn),这一主族的元素趋于完善。回答下列问题:
(1)①硅在元素周期表中的位置是_______ ;根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是_______ 。
②硅和锗单质分别与H2反应生成的氢化物更稳定的是_______ (填“硅”或“锗”)。
(2)已知锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡元素和+4价铅元素的化合物均是不稳定的,+2价锡元素的化合物有强还原性,+4价铅元素的化合物有强氧化性,Sn2+还原性比Fe2+还原性强。
①氯气与锡共热的化学方程式_______ ;
②写出SnCl2溶液和FeCl3溶液反应的离子方程式_______ ;
③PbO2与浓盐酸共热能体现+4价Pb的强氧化性,写出离子方程式_______ 。
(1)①硅在元素周期表中的位置是
②硅和锗单质分别与H2反应生成的氢化物更稳定的是
(2)已知锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡元素和+4价铅元素的化合物均是不稳定的,+2价锡元素的化合物有强还原性,+4价铅元素的化合物有强氧化性,Sn2+还原性比Fe2+还原性强。
①氯气与锡共热的化学方程式
②写出SnCl2溶液和FeCl3溶液反应的离子方程式
③PbO2与浓盐酸共热能体现+4价Pb的强氧化性,写出离子方程式
您最近一年使用:0次
名校
解题方法
7 . 1869年俄国化学家门捷列夫制出第一张元素周期表元素,下图是元素周期表的一部分。回答下列问题:
(1)Ga的原子结构示意图为________ 。
(2)Ge位于金属元素和非金属元素的分界处,可以做________ 材料,其最高正价为________ 。
(3)Cl元素的最高价氧化物对应的水化物为________ (填化学式),设计实验方案证明Cl的得电子能力强于S。
(4)Bi的最高价氧化物为________ (填化学式), ,
, 混合溶液中滴入
混合溶液中滴入 溶液,溶液变为紫红色,
溶液,溶液变为紫红色, 转化为可溶的
转化为可溶的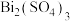 ,该反应的离子方程式为
,该反应的离子方程式为________ 。
(5)根据元素周期律,推断
①表中气态氢化物中稳定性最高的物质为________ (填名称),该物质的电子式为________ 。
②氢化物的还原性:
________  (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。
③ 、
、 、
、 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为________ 。
④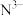 、
、 、
、 、
、 ,四种离子半径由大到小的顺序为
,四种离子半径由大到小的顺序为________ (用离子符号表示)。
B | C | N | O | F |
Al | Si | P | S | Cl |
Ga | Ge | As | Se | Br |
In | Sn | Sb | Te | I |
Tl | Pb | Bi | Po | At |
(2)Ge位于金属元素和非金属元素的分界处,可以做
(3)Cl元素的最高价氧化物对应的水化物为
(4)Bi的最高价氧化物为
 ,
, 混合溶液中滴入
混合溶液中滴入 溶液,溶液变为紫红色,
溶液,溶液变为紫红色, 转化为可溶的
转化为可溶的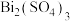 ,该反应的离子方程式为
,该反应的离子方程式为(5)根据元素周期律,推断
①表中气态氢化物中稳定性最高的物质为
②氢化物的还原性:

 (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。③
 、
、 、
、 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为④
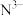 、
、 、
、 、
、 ,四种离子半径由大到小的顺序为
,四种离子半径由大到小的顺序为
您最近一年使用:0次
10-11高三上·北京·阶段练习
8 . 元素在周期表中的位置,反映了元素的原子结构和元素的性质,右图是元素周期表的一部分。
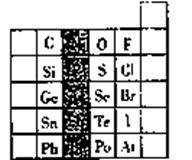
(1)阴影部分元素在元素周期表中的位置为第_________ 族。根据元素周期律、预测;酸性强弱H3AsO4______ H3PO4(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为________ ,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度____________ 。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是__________
(4)下列说法正确的是__________
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱

(1)阴影部分元素在元素周期表中的位置为第
(2)元素S的最高正价和最低负价的代数和为
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
(4)下列说法正确的是
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
您最近一年使用:0次
9 . 下表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
(1)得电子能力最强的原子是___________ ;
(2)化学性质最不活泼的单质是___________ ﹔
(3)F与Cl相比,原子半径较大的是___________ ;
(4) 与
与 相比,热稳定性较强的是
相比,热稳定性较强的是___________ ﹔
(5)原子最外层电子数与最内层电子数相等的元素是___________ ﹔
(6)某阴离子的结构示意图为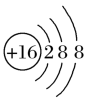 ,其离子符号是
,其离子符号是___________ ;
(7) 与
与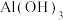 中,能与
中,能与 溶液反应的是
溶液反应的是___________ ﹔
(8)第三周期元素中能与冷水剧烈反应的金属单质是___________ ,写出该反应的化学方程式:___________ ;
(9)碳的一种氢化物结构式为 ,其分子式是
,其分子式是___________ ,其中碳元素与氢元素的质量比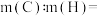
___________ ;(相对原子质量:C-12,H-1)
(10)下列各项性质的比较,符合相关性质递变规律的是___________(填标号 )。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | Ne | |||
| 3 | Na | Mg | Al | S | Cl |
(1)得电子能力最强的原子是
(2)化学性质最不活泼的单质是
(3)F与Cl相比,原子半径较大的是
(4)
 与
与 相比,热稳定性较强的是
相比,热稳定性较强的是(5)原子最外层电子数与最内层电子数相等的元素是
(6)某阴离子的结构示意图为
 ,其离子符号是
,其离子符号是(7)
 与
与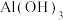 中,能与
中,能与 溶液反应的是
溶液反应的是(8)第三周期元素中能与冷水剧烈反应的金属单质是
(9)碳的一种氢化物结构式为
 ,其分子式是
,其分子式是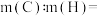
(10)下列各项性质的比较,符合相关性质递变规律的是___________(填
A.还原性: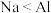 | B.非金属性: |
C.酸性: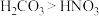 | D.碱性: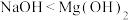 |
您最近一年使用:0次
解题方法
10 . 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了a~f6元素在周期表中的位置。
回答下列问题
(1)写出a单质的电子式________ 。
(2)画出b的原子结构示意图:__________ 。
(3)写出c单质和水反应的化学方程式:__________ 。
(4)金属性c强于d,请用原子结构理论解释原因______________
(5)已知硒(Se)与e同主族,且位于e的下一个周期,根据硒元素在元素周期表中的位置推测硒及其化合物可能具有的性质是______ 。
①最高价氧化物对应的水化物的化学式为H2SeO3
②SeO2既有氧化性又有还原性
③气态氢化物的稳定性比e元素的弱
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ||||||||
| 二 | a | b | ||||||
| 三 | c | d | e | f |
回答下列问题
(1)写出a单质的电子式
(2)画出b的原子结构示意图:
(3)写出c单质和水反应的化学方程式:
(4)金属性c强于d,请用原子结构理论解释原因
(5)已知硒(Se)与e同主族,且位于e的下一个周期,根据硒元素在元素周期表中的位置推测硒及其化合物可能具有的性质是
①最高价氧化物对应的水化物的化学式为H2SeO3
②SeO2既有氧化性又有还原性
③气态氢化物的稳定性比e元素的弱
您最近一年使用:0次



