名校
1 . 如表是元素周期表的一部分,根据表中给出的10种元素(其中X、Y分别表示某种化学元素),按要求作答。
(1)X、Y两种元素符号分别是____ 和____ 。
(2)Mg的原子序数为____ 。
(3)氧元素位于第二周期第____ 。
(4)表中失电子能力最强的原子是____ 。
(5)表中某原子最外层电子数为4,其元素符号是____ 。
(6)F与N相比,原子半径较小的是____ 。
(7)O2与S单质相比,更难与H2化合的是____ 。
(8)NH3中N元素的化合价为____ ,其水溶液呈____ (填“酸性”或“碱性”)。
(9)Cl2与水反应的生成物中具有漂白作用的是____ (填“HCl”或“HClO”),写出该反应的化学方程式:____ 。
(10)下列各项比较,符合相关性质递变规律的是____ (填标号)。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | N | O | F | X | ||||
| 3 | Na | Y | Al | Si | S | Cl |
(2)Mg的原子序数为
(3)氧元素位于第二周期第
(4)表中失电子能力最强的原子是
(5)表中某原子最外层电子数为4,其元素符号是
(6)F与N相比,原子半径较小的是
(7)O2与S单质相比,更难与H2化合的是
(8)NH3中N元素的化合价为
(9)Cl2与水反应的生成物中具有漂白作用的是
(10)下列各项比较,符合相关性质递变规律的是
| A.氧化性:O2>N2 | B.金属性:Na<Mg |
| C.酸性:H2SO4>HClO4 | D.碱性:NaOH<Mg(OH)2 |
您最近一年使用:0次
2022-07-11更新
|
448次组卷
|
2卷引用:2022年01月福建省普通高中高一学业水平合格性考试真题化学试题
名校
解题方法
2 . 硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取硒。
(1)硒在元素周期表中的位置如图所示:
Se
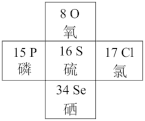
①Se在元素周期表中位置表示为________ ,H2Se的电子式为________________
②从原子结构角度解释硫与硒元素性质相似与不同的原因:同一主族______________ 。
(2)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
ⅰ.将含硒阳极泥与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ⅱ.用水吸收ⅰ中混合气体,可得Se固体
①请写出C与浓H2SO4反应的化学方程式________________ 。
②焙烧过程产生的烟气中含有少量SeO2的,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为________________ 。
③ 写出步骤ⅱ中的化学方程式________________ 。
(3)下列说法合理的是________________ 。
a.SeO2既有氧化性又有还原性 b.原子半径由大到小顺序:Se>Br>Cl
c.热稳定性:H2Se<HCl<H2S d.酸性:HeSeO4<HbrO4<HClO4
(1)硒在元素周期表中的位置如图所示:
Se
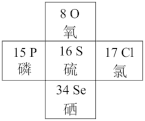
①Se在元素周期表中位置表示为
②从原子结构角度解释硫与硒元素性质相似与不同的原因:同一主族
(2)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
ⅰ.将含硒阳极泥与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ⅱ.用水吸收ⅰ中混合气体,可得Se固体
①请写出C与浓H2SO4反应的化学方程式
②焙烧过程产生的烟气中含有少量SeO2的,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为
③ 写出步骤ⅱ中的化学方程式
(3)下列说法合理的是
a.SeO2既有氧化性又有还原性 b.原子半径由大到小顺序:Se>Br>Cl
c.热稳定性:H2Se<HCl<H2S d.酸性:HeSeO4<HbrO4<HClO4
您最近一年使用:0次
2020-10-12更新
|
369次组卷
|
3卷引用:北京市人大附中2021届高三10月月考化学试题
北京市人大附中2021届高三10月月考化学试题北京市第一七一中学2021届高三上学期10月月考化学试题(已下线)第8单元 原子结构 元素周期律(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷
3 . 元素在周期表中的位置反映了元素的原子结构和元素的性质。如图是元素周期表的一部分。回答下列问题:
(1)N在元素周期表中的位置为第__________ 周期__________ 族。根据元素周期律,预测酸性强弱:
______ (填“>”或“<”) 。
。
(2)S的最高化合价和最低化合价的代数和为_______ ,Se与 的反应比S与
的反应比S与 的反应
的反应______ (填“难”或“易”)。
(3) 具有较强的氧化性,
具有较强的氧化性, 具有较强的还原性,将
具有较强的还原性,将 气体通入溴水后,溶液中主要存在的离子是
气体通入溴水后,溶液中主要存在的离子是________ (填离子符号)。
(4)下列说法错误的是___________ (填序号)。
①C、N、O、F的原子半径随着原子序数的增大而减小
②Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
③由元素周期律可直接推断出酸性:
④HF、HCl、HBr、HI的稳定性逐渐减弱
| C | N | O | F | ||
| Si | P | S | Cl | ||
| Ge | As | Se | Br | ||
| Sn | Sb | Te | I | ||
| Pb | Bi | Po | At |

 。
。(2)S的最高化合价和最低化合价的代数和为
 的反应比S与
的反应比S与 的反应
的反应(3)
 具有较强的氧化性,
具有较强的氧化性, 具有较强的还原性,将
具有较强的还原性,将 气体通入溴水后,溶液中主要存在的离子是
气体通入溴水后,溶液中主要存在的离子是(4)下列说法错误的是
①C、N、O、F的原子半径随着原子序数的增大而减小
②Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
③由元素周期律可直接推断出酸性:

④HF、HCl、HBr、HI的稳定性逐渐减弱
您最近一年使用:0次
2020-09-23更新
|
502次组卷
|
3卷引用:鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律第3节 元素周期表的应用 教材帮
解题方法
4 . 下表是元素周期表的一部分。
(1)表中原子半径最小的元素符号是____ ;
(2)表中氧化性最强的单质的化学式为____ ;
(3)表中最高价氧化物的水化物中碱性最强的物质的化学式是__ ,酸性最强的物质的化学式是_______ ;
(4)④⑤⑥三种元素中,离子半径大小的顺序为____ >____ >____ (填离子符号);
(5)③⑦⑧三种元素的气态氢化物的稳定性强弱顺序为__ >__ >___ (填化学式);
(6)元素②的氢化物与元素⑧的氢化物反应的化学方程式为________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
(1)表中原子半径最小的元素符号是
(2)表中氧化性最强的单质的化学式为
(3)表中最高价氧化物的水化物中碱性最强的物质的化学式是
(4)④⑤⑥三种元素中,离子半径大小的顺序为
(5)③⑦⑧三种元素的气态氢化物的稳定性强弱顺序为
(6)元素②的氢化物与元素⑧的氢化物反应的化学方程式为
您最近一年使用:0次
5 . 如图是元素周期表的一部分,表中的①~⑩中元素,填空回答:
用元素符号 或化学式 回答下列问题:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为______________ 。
(2)氧化性最强的单质是_____________ 。
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是_____________ ,碱性最强的是_____________ ,呈两性的氢氧化物是_____________ 。
(4)写出①②③⑦对应的氢化物的稳定性由强到弱的是_____________ ,
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
用
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为
(2)氧化性最强的单质是
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是
(4)写出①②③⑦对应的氢化物的稳定性由强到弱的是
您最近一年使用:0次
6 . (1)元素周期表有______ 个横行、________________ 个周期,每一周期中元素原子的_________ 相同,从左到右原子半径依次___________________ (填“增大”或“减小”)、核对外层电子的引力逐渐________ (填“增强”或“减弱”) 、元素失电子能力逐渐________ (填“增强”或“减弱”)、元素的非金属性________ (填“增强”或“减弱”)、阴离子的还原性_________ (填“增强”或“减弱”)、最高价氧化物对应水化物酸性________ (填“增强”或“减弱”)、气态氢化物的稳定性________ (填“增强”或“减弱”);
(2)元素周期表有____ 纵列、_______________ 个族,第ⅥA族处在第_______ 列,同一主族从上到下,元素的金属性依次_________ (填“增强”或“减弱”)、元素失电子的能力________ (填“增强”或“减弱”)、阳离子的氧化性________ (填“增强”或“减弱”)、最高价氧化物对应水化物酸性________ (填“增强”或“减弱”)。
(2)元素周期表有
您最近一年使用:0次
2019-05-28更新
|
163次组卷
|
3卷引用:【市级联考】山东省威海市2018-2019学年高一下学期期中考试化学试题
7 . 下图是中学教材中元素周期表的一部分,其中标出A~R 15种元素,试根据它们回答下列问题(填具体元素符号 或化学式 ):
(1)化学性质最不活泼的是____ ,原子半径最小的是(除稀有气体元素)___ 属于过渡元素的是____ (填A~R中的代号)。
(2)最高价氧化物对应的水化物中酸性最强的是_____ ,单质中氧化性最强的是________ ,第三周期元素形成的简单离子中半径最小的是______ 。
(3)F与K形成的化合物溶于水发生电离,所破坏的化学键为______ 。
(4)Q在元素周期表中的位置是_____ ,B、C可形成化合物B2C,该化合物的核外电子总数为_____ 。
(5)P的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物的离子方程式:____________ 。
(6)元素E与元素F相比,金属性较强的是________ (用元素符号表示),下列表述中能证明这一事实的是______ (填序号)。
a.与酸反应时,每个F原子比每个E原子失电子数多
b.E的氢化物比F的氢化物稳定
c.E和F的单质与水反应E较剧烈
d.最高价氧化物对应水化物碱性E比F强
| A | B | C | D | ||||||||||||||
| E | F | G | H | I | J | K | L | ||||||||||
| R | |||||||||||||||||
| P | Q |
(2)最高价氧化物对应的水化物中酸性最强的是
(3)F与K形成的化合物溶于水发生电离,所破坏的化学键为
(4)Q在元素周期表中的位置是
(5)P的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物的离子方程式:
(6)元素E与元素F相比,金属性较强的是
a.与酸反应时,每个F原子比每个E原子失电子数多
b.E的氢化物比F的氢化物稳定
c.E和F的单质与水反应E较剧烈
d.最高价氧化物对应水化物碱性E比F强
您最近一年使用:0次
8 . 下表是元素周期表的一部分,列出11种元素在周期表中的位置,填写下列空白
(1)这11种元素中化学性质最不活泼的是___ ,金属性最强的是____ .(写元素符号)
(2)第三周期元素中,原子半径最大的元素是(稀有气体元素除外)____ ,离子半径最小的是____ ,单质氧化性最强的元素是____ .(写元素符号)
(3)J的简单离子的结构示意图__ .
(4)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)_____________________ .
(5)比较G、H两元素的最高价氧化物对应水化物的酸性____ >_____ .比较C、G两元素的气态氢化物稳定性____ >_____ .(写化学式)
(6)C和D的单质在点燃条件下生成化合物的电子式为__ ,它属于____ (离子或共价)化合物.
(7)用电子式表示A和G所形成的简单化合物的形成过程__ .
| 族周期 | IA | IIA | IIIA | IV A | V A | VI A | VII A | O |
| 一 | A | |||||||
| 二 | B | C | ||||||
| 三 | D | E | F | G | H | I | ||
| 四 | K | J | ||||||
(1)这11种元素中化学性质最不活泼的是
(2)第三周期元素中,原子半径最大的元素是(稀有气体元素除外)
(3)J的简单离子的结构示意图
(4)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)
(5)比较G、H两元素的最高价氧化物对应水化物的酸性
(6)C和D的单质在点燃条件下生成化合物的电子式为
(7)用电子式表示A和G所形成的简单化合物的形成过程
您最近一年使用:0次
名校
9 . 门捷列夫在研究周期表时预言了包括“类铝”、“类硅”在内的11种元素。
(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
①已知主族元素锗的最高化合价为+4价,其最高价氧化物的水化物为两性氢氧化物。试比较元素的非金属性Si___ Ge(用“>”或“<”表示)。
②若锗位于Si的下一周期,写出“锗”在周期表中的位置_____ 。根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是_______ .
③硅和锗单质分别与 反应时,反应较难进行的是
反应时,反应较难进行的是_______ (填“硅”或“锗”)。
(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试写出镓原子的结构示意图____ 。冶炼金属镓通常采用的方法是_____ .
②已知Ga(OH)3难溶于水,为判断Ga(OH)3是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液、________ 和________ .
(3)某同学阅读课外资料,看到了下列有关锗、锡、铅三种元素的性质描述:
①锗、锡在空气中不反应,铅在空气中表面形成一层氧化铅;
②锗与盐酸不反应,锡与盐酸反应,铅与盐酸反应但生成PbCl2微溶而使反应终止:
该同学查找三种元素在周期表的位置如图所示:
根据以上信息推测,下列描述正确的是______ (填标号)。
a.锗、锡、铅的+4价的氢氧化物的碱性强弱顺序是:Ge(OH)4<Sn(OH)4<Pb(OH)4
b.锗、锡、铅的金属性依次减弱;
c. 锗、锡、铅的原子半径依次增大。
(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
①已知主族元素锗的最高化合价为+4价,其最高价氧化物的水化物为两性氢氧化物。试比较元素的非金属性Si
②若锗位于Si的下一周期,写出“锗”在周期表中的位置
③硅和锗单质分别与
 反应时,反应较难进行的是
反应时,反应较难进行的是(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试写出镓原子的结构示意图
②已知Ga(OH)3难溶于水,为判断Ga(OH)3是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液、
(3)某同学阅读课外资料,看到了下列有关锗、锡、铅三种元素的性质描述:
①锗、锡在空气中不反应,铅在空气中表面形成一层氧化铅;
②锗与盐酸不反应,锡与盐酸反应,铅与盐酸反应但生成PbCl2微溶而使反应终止:
该同学查找三种元素在周期表的位置如图所示:
IV | |
4 | Ge |
5 | Sn |
6 | Pb |
a.锗、锡、铅的+4价的氢氧化物的碱性强弱顺序是:Ge(OH)4<Sn(OH)4<Pb(OH)4
b.锗、锡、铅的金属性依次减弱;
c. 锗、锡、铅的原子半径依次增大。
您最近一年使用:0次
10 . 硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)硅元素在自然界中通常以石英石( )和硅酸盐的形式存在。请写出
)和硅酸盐的形式存在。请写出 与氢氧化钠溶液反应的化学方程式
与氢氧化钠溶液反应的化学方程式___________ 。
(2)高纯硅单质可由石英砂(主要成分是 )制得,制备高纯硅的主要工艺流程如图所示:
)制得,制备高纯硅的主要工艺流程如图所示:___________ 。
ⅱ.流程①焦炭体现了___________ (填“氧化性”或“还原性”)。
(3)氮化硅是一种新型陶瓷材料,可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得 ,请用单线桥表示该反应电子转移的方向与数目
,请用单线桥表示该反应电子转移的方向与数目___________ 。
(4)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,写出水玻璃和盐酸反应的离子方程式___________ 。
(5)关于硅及其相关化合物的叙述正确的是___________。
(1)硅元素在自然界中通常以石英石(
 )和硅酸盐的形式存在。请写出
)和硅酸盐的形式存在。请写出 与氢氧化钠溶液反应的化学方程式
与氢氧化钠溶液反应的化学方程式(2)高纯硅单质可由石英砂(主要成分是
 )制得,制备高纯硅的主要工艺流程如图所示:
)制得,制备高纯硅的主要工艺流程如图所示: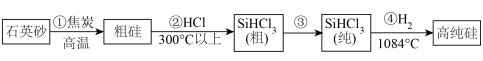
ⅱ.流程①焦炭体现了
(3)氮化硅是一种新型陶瓷材料,可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得
 ,请用单线桥表示该反应电子转移的方向与数目
,请用单线桥表示该反应电子转移的方向与数目(4)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,写出水玻璃和盐酸反应的离子方程式
(5)关于硅及其相关化合物的叙述正确的是___________。
A.已知 与 与 在同一主族,由于 在同一主族,由于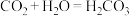 ,用类比法得知 ,用类比法得知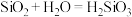 |
B.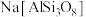 用氧化物形式表示为 用氧化物形式表示为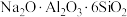 |
| C.硅元素在金属元素与非金属元素的分界线处,因此单质硅具有弱导电性,一般可用于作为半导体材料 |
| D.高温熔融纯碱时可选用石英玻璃坩埚 |
您最近一年使用:0次



