名校
1 . 下表列出了①~⑨九种元素在周期表中的位置:
请按要求 回答下列问题。
(1)元素③的名称是__ ,元素⑨的元素符号是____ ,元素④形成的单质具有____ (填“氧化性”或“还原性”)。
(2)元素⑦⑧⑨的气态氢化物的稳定性由弱到强的顺序:____ (用化学式表示)。
(3)写出一条能说明元素⑤的金属性比元素⑥强的事实:_____ 。
(4)写出元素⑤形成的单质与水反应的离子方程式:_____ 。
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素③的名称是
(2)元素⑦⑧⑨的气态氢化物的稳定性由弱到强的顺序:
(3)写出一条能说明元素⑤的金属性比元素⑥强的事实:
(4)写出元素⑤形成的单质与水反应的离子方程式:
您最近一年使用:0次
名校
解题方法
2 . 1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一。元素周期表与元素周期律在化学学习研究中有很重要的作用。
(1)下表是元素周期表的一部分
i.元素④的过氧化物的电子式为______ ,其最高价氧化物对应的水化物含有的化学键类型为______ ,⑩元素最高价氧化物对应的水化物的化学式是______ 。
ii.元素①、②、③的简单氢化物的稳定性最强的是______ (用化学式表示,下同),②、⑧简单氢化物熔点高的是______ ,④、⑤最高价氧化物的水化物碱性更强的是______ ,④、⑤、⑧、⑨的简单离子半径由大到小的顺序______ 。
(2)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。
i.铷在元素周期表中的位置______ 。
ii.关于铷的下列说法中不正确的是______ (填序号)。
a.与水反应比钠更剧烈
b.Rb2O在空气中易吸收水和二氧化碳
c.Rb2O2与水能剧烈反应并释放出O2
d.单质具有很强的氧化性
e.RbOH的碱性比同浓度的NaOH弱
(1)下表是元素周期表的一部分
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 四 | ⑩ |
i.元素④的过氧化物的电子式为
ii.元素①、②、③的简单氢化物的稳定性最强的是
(2)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。
i.铷在元素周期表中的位置
ii.关于铷的下列说法中不正确的是
a.与水反应比钠更剧烈
b.Rb2O在空气中易吸收水和二氧化碳
c.Rb2O2与水能剧烈反应并释放出O2
d.单质具有很强的氧化性
e.RbOH的碱性比同浓度的NaOH弱
您最近一年使用:0次
2021-01-07更新
|
1365次组卷
|
3卷引用:辽宁省五校联考2020-2021学年高一上学期期末考试化学试题
3 . 下面是元素周期表的一部分,表中的每个字母表示一种短周期元素,请用对应的化学符号回答下列问题:

(1)D在元素周期表中的位置是____ 。
(2)E元素所形成的气态氢化物的电离方程式____ 。
(3)B、C两元素的单质较活泼的是___ 。(填元素符号)
(4)F是形成化合物最多的一种元素,它有多种单质请写出其中的两种:___ 、___ 。
(5)C是大自然赐予人类的宝物。将少量C单质置于足量氢氧化钠溶液中,可以观察到的现象为__ 。它其中的一个用途是和氧化铁反应制得难熔金属铁,该反应的化学方程式为__ C表现出的性质是___ (氧化性/还原性),反应时可观察到的实验现象有___ (填字母)。
A.产生红棕色烟雾 B.发出耀眼的光芒 C有熔融物生成
(6)C元素的最高价氧化物对应的水化物的化学式为___ ,该物质___ (填“能”或“不能”)溶于氨水,___ (填“能”或“不能”)溶于氢氧化钠溶液,若能写出发生反应的离子方程式___ 。
(7)G元素的非金属性比H元素的非金属性___ (选填“强”、“弱”),能说明这一事实的化学方程式是___ (任写一个)。

(1)D在元素周期表中的位置是
(2)E元素所形成的气态氢化物的电离方程式
(3)B、C两元素的单质较活泼的是
(4)F是形成化合物最多的一种元素,它有多种单质请写出其中的两种:
(5)C是大自然赐予人类的宝物。将少量C单质置于足量氢氧化钠溶液中,可以观察到的现象为
A.产生红棕色烟雾 B.发出耀眼的光芒 C有熔融物生成
(6)C元素的最高价氧化物对应的水化物的化学式为
(7)G元素的非金属性比H元素的非金属性
您最近一年使用:0次
名校
解题方法
4 . (1)写出表示含有8个质子、10个中子的原子的化学符号______________ ;
(2)元素周期表中位于第8纵行的铁元素属于______ 族。所含元素超过18种的周期是第_________ 周期。
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是__________ 。S的最高化合价和最低化合价的代数和为_________ ,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se(与S同主族)与H2反应的程度比S与H2反应程度_______ (填“更大”“更小”或“相同”)。
(4)相同质量的14C18O2与SO2的核外电子数之比为_____________ (化成最简整数比)
(5)A+、B+、C-、D、E5种微粒(分子或离子),它们都含有10个电子,已知它们有如下转化关系:A++C-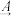 D+E↑其离子方程式为
D+E↑其离子方程式为_______________________ 。
Ⅱ.在遭遇冰雪灾害时,常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子电子层结构相同,且1molXY2含有54mol电子。该融雪剂的化学式是________ 。
(2)元素周期表中位于第8纵行的铁元素属于
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
(4)相同质量的14C18O2与SO2的核外电子数之比为
(5)A+、B+、C-、D、E5种微粒(分子或离子),它们都含有10个电子,已知它们有如下转化关系:A++C-
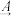 D+E↑其离子方程式为
D+E↑其离子方程式为Ⅱ.在遭遇冰雪灾害时,常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子电子层结构相同,且1molXY2含有54mol电子。该融雪剂的化学式是
您最近一年使用:0次
名校
5 . 下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式 回答,(5)~(7)小题按题目要求回答。
(1)表中元素,化学性质最不活泼的是____ ,只有负价而无正价的是____ ,氧化性最强的单质是____ ,还原性最强的单质是_____ 。
(2)A分别与D、E、F、G、H形成的化合物中,最稳定的________ 。
(3)在B、C、E、F、G、H中,原子半径最大的是________ 。
(4)A和D组成化合物的电子式________ 。
(5)画出F的原子结构示意图_____ 。
(6)用电子式表示B和H组成化合物的形成过程:________ 。
(7)写出B的最高价氧化物的水化物和C的最高价氧化物的水化物反应的离子方程式:________ 。
| 族 周期 | I A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是
(2)A分别与D、E、F、G、H形成的化合物中,最稳定的
(3)在B、C、E、F、G、H中,原子半径最大的是
(4)A和D组成化合物的电子式
(5)画出F的原子结构示意图
(6)用电子式表示B和H组成化合物的形成过程:
(7)写出B的最高价氧化物的水化物和C的最高价氧化物的水化物反应的离子方程式:
您最近一年使用:0次
2019高三·浙江·专题练习
6 . 如表所示是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
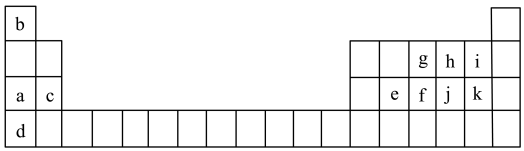
请你根据表中所给元素,回答下列问题:
(1)在所给短周期元素中____ 的原子半径与_____ 的原子半径之比最小 (填元素符号)。
(2)表中金属性最强的元素与氧气反应生成化合物的化学式是________ (填两种即可),i和j氢化物比较,稳定性强的是________ (填写氢化物化学式)。
(3)海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,其单质能做消毒杀菌剂的原因是____________________________________ (用化学方程式表示)。
(4)写出均由a、b、h、j四种元素所形成的两种化合物的水溶液相互反应的离子方程式:_____________ 。
(5)常温下某液态化合物只含上述元素的两种,分子中原子个数比1∶1,请你仅用一个化学方程式表示该液态化合物既有氧化性又有还原性:____________________________ 。

请你根据表中所给元素,回答下列问题:
(1)在所给短周期元素中
(2)表中金属性最强的元素与氧气反应生成化合物的化学式是
(3)海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,其单质能做消毒杀菌剂的原因是
(4)写出均由a、b、h、j四种元素所形成的两种化合物的水溶液相互反应的离子方程式:
(5)常温下某液态化合物只含上述元素的两种,分子中原子个数比1∶1,请你仅用一个化学方程式表示该液态化合物既有氧化性又有还原性:
您最近一年使用:0次
名校
7 . 下图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题:
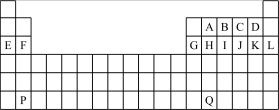
(1)在上表所列出的短周期元素中
①性质最不活泼的是____________ ;②原子半径最大的是(除稀有气体元素)__________ 。
③形成的气态氢化物最稳定的是______________________________ ;
④最高价氧化物对应的水化物中酸性最强的是____________ 碱性最强的是_____________ 。
⑤形成的阴离子还原性最弱的是_____________ ,阳离子半径最小的是_____________ 。
(2)①B的气态氢化物与最高价氧化物对应的水化物发生反应的化学方程式为________________ ;
②A单质与J的最高价氧化物对应的水化物反应的方程式________________________________ 。
(3)设P的原子序数为Z,则F的原子序数为______________ ,Q的原子序数为________________ 。

(1)在上表所列出的短周期元素中
①性质最不活泼的是
③形成的气态氢化物最稳定的是
④最高价氧化物对应的水化物中酸性最强的是
⑤形成的阴离子还原性最弱的是
(2)①B的气态氢化物与最高价氧化物对应的水化物发生反应的化学方程式为
②A单质与J的最高价氧化物对应的水化物反应的方程式
(3)设P的原子序数为Z,则F的原子序数为
您最近一年使用:0次
解题方法
8 . 如表列出了①~⑦七种元素在周期表中的位置:
请按要求回答下列问题:
(1)元素③的原子结构示意图是___________ ,以上元素的最高价氧化物形成的水化物酸性最强的是___________ (填分子式)。
(2)②、③、⑥三种元素的原子形成的简单离子半径由大到小的顺序排列为___________ (用离子符号表示);②、③两种元素的最高价氧化物对应的水化物碱性由弱到强的顺序是___________ (用化学式表示)。
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为___________ 。
(4)②和⑦按原子个数比1∶1形成离子化合物的电子式___________ 。
(5)设计一个实验比较②与③的金属性强弱___________ 。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 二 | ① | ⑦ | ||||||
| 三 | ② | ③ | ④ | ⑤ | ⑥ |
请按要求回答下列问题:
(1)元素③的原子结构示意图是
(2)②、③、⑥三种元素的原子形成的简单离子半径由大到小的顺序排列为
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为
(4)②和⑦按原子个数比1∶1形成离子化合物的电子式
(5)设计一个实验比较②与③的金属性强弱
您最近一年使用:0次
名校
解题方法
9 . 2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
(1)元素①~⑧中,金属性最强的是________ (填元素符号)。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是_________ ,其氢化物的电子式是_________ 。
(3)比较元素②、③的最高价氧化物对应水化物的酸性:______ >______ (填化学式)。说明你判断的理由:_________ 。
(4)主族元素砷(As)的部分信息如图所示。

①砷(As)在周期表中的位置是______ 。
②下列说法正确的是_______ (填序号)。
a.砷元素的最高化合价为+4
b.推测砷有多种氧化物
c.③的气态氢化物的还原性大于砷的气态氢化物的还原性
(5)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。已知:常温下浓盐酸与高锰酸钾反应生成氯气。
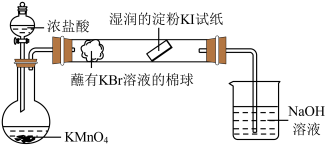
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br >I,并说明理由_________ 。
| IA | 0 | |||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ||||||||
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是
(3)比较元素②、③的最高价氧化物对应水化物的酸性:
(4)主族元素砷(As)的部分信息如图所示。

①砷(As)在周期表中的位置是
②下列说法正确的是
a.砷元素的最高化合价为+4
b.推测砷有多种氧化物
c.③的气态氢化物的还原性大于砷的气态氢化物的还原性
(5)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。已知:常温下浓盐酸与高锰酸钾反应生成氯气。

打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br >I,并说明理由
您最近一年使用:0次
解题方法
10 . 图是元素周期表的一部分,回答下列有关问题:
(1)写出⑫的元素符号:_______ ,其原子序数为_______ 。
(2)在这些元素中,非金属性最强的元素是_______ (用元素符号填答)。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质反应的化学方程式_______ 。
(4)在④⑤⑦⑧形成的四个简单离子中,离子 半径由大到小的顺序是(用离子符号和“>”填答)_______
(5)设计一种简单实验确认④与⑤中,哪个金属性更强(只要写出实验方案即可),写出实验方案并预测结论:_______ ;
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(1)写出⑫的元素符号:
(2)在这些元素中,非金属性最强的元素是
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质反应的化学方程式
(4)在④⑤⑦⑧形成的四个简单离子中,
(5)设计一种简单实验确认④与⑤中,哪个金属性更强(只要写出实验方案即可),写出实验方案并预测结论:
您最近一年使用:0次



