1 . 2019年是元素周期表诞生150周年,元素周期表在学习、研究和生产实践中有很重要的作用。①~⑦七种元素在元素周期表中的位置如下:
请回答下列问题:
(1)①、⑦两种元素组成的化合物中含有的化学键是__________ (填“共价”或“离子”)键。
(2)②、③的原子半径大小关系是:②________ ③(填“>”、“<”或“=”)。
(3)①~⑦七种元素中金属性最强的元素是____________ (填元素符号)
(4)⑤和⑥两种元素的最高价氧化物对应的水化物之间反应的离子方程式为____________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
请回答下列问题:
(1)①、⑦两种元素组成的化合物中含有的化学键是
(2)②、③的原子半径大小关系是:②
(3)①~⑦七种元素中金属性最强的元素是
(4)⑤和⑥两种元素的最高价氧化物对应的水化物之间反应的离子方程式为
您最近一年使用:0次
名校
2 . 2019年是化学元素周期表问世150周年,联合国宣布此年为“国际化学元素周期表年”。元素周期表在学习、研究中有很重要的作用,下表是元素周期表的一部分。
(1)e的元素符号是___ 。
(2)f、g的最高价氧化物对应的水化物中,酸性较强的物质的化学式是___ 。
(3)c的金属性强于d的金属性,用原子结构解释原因:___ ,失电子能力c大于d。
(4)下列对于a及其化合物的推断中,正确的是___ (填序号)。
①a的最高正价和最低负价绝对值相等
②a的氢化物的稳定性强于f的氢化物的稳定性
③单质a比单质b难与氢气反应
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g |
(1)e的元素符号是
(2)f、g的最高价氧化物对应的水化物中,酸性较强的物质的化学式是
(3)c的金属性强于d的金属性,用原子结构解释原因:
(4)下列对于a及其化合物的推断中,正确的是
①a的最高正价和最低负价绝对值相等
②a的氢化物的稳定性强于f的氢化物的稳定性
③单质a比单质b难与氢气反应
您最近一年使用:0次
2020-06-03更新
|
291次组卷
|
3卷引用:北京市海淀区2018-2019学年高一学业水平合格性考试适应练习化学试题
名校
解题方法
3 . 下表为元素周期表的一部分,请回答下列问题:
(1)元素③在元素周期表中的位置是_____________________ 。
(2)元素④和⑤的最高价氧化物对应水化物酸性较强的是____________ (填化学式),元素①和④中,原子半径较大的是__________ (填元素符号)。
(3)元素②的氢氧化物能溶于元素①的氢氧化物所形成的的溶液中,离子方程式为:______________________________ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | |||||||
| 3 | ① | ② | ④ | ⑤ | ||||
(1)元素③在元素周期表中的位置是
(2)元素④和⑤的最高价氧化物对应水化物酸性较强的是
(3)元素②的氢氧化物能溶于元素①的氢氧化物所形成的的溶液中,离子方程式为:
您最近一年使用:0次
名校
解题方法
4 . 下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题;
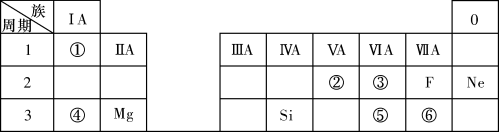
(1)④表示的元素是___ (填元素符号);
(2)②、③两种元素相比较,原子半径较大的是___ (填元素符号);
(3)写出①与⑥两种元素所形成化合物的化学式___ ;
(4)③和⑤两种元素的非金属性强弱顺序是③____ ⑤(填“<”或“>”)。

(1)④表示的元素是
(2)②、③两种元素相比较,原子半径较大的是
(3)写出①与⑥两种元素所形成化合物的化学式
(4)③和⑤两种元素的非金属性强弱顺序是③
您最近一年使用:0次
2020-05-13更新
|
656次组卷
|
3卷引用:湖南省2019-2020学年高二学业水平考试信息模拟(五) 化学
2014高二·湖南·学业考试
5 . 下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
(1)①的元素符号是__________
(2)②和⑥两种元素的原子半径大小关系:_________ (填“>”或“<”);
(3)③和⑤两种元素的金属性强弱关系:________ (填“>”或“<”);
(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式:__________ 。
| ⅠA | 0 | ||||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
| 2 | B | ① | ② | Ne | |||||
| 3 | ③ | ④ | ⑤ | Si | ⑥ | ||||
(1)①的元素符号是
(2)②和⑥两种元素的原子半径大小关系:
(3)③和⑤两种元素的金属性强弱关系:
(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式:
您最近一年使用:0次
2013高二·湖南·学业考试
名校
6 . 下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题。
(1)①元素符号是_______ ;
(2)②的原子序数是______ ;
(3)①和⑤两种元素的非金属性强弱关系:①___ ⑤(填“>”或“<”);
(4)下列化学用语正确的是______ (填字母代号):
A. ④和⑥形成化合物的化学式:NaCl
| 族 周期 | IA | 0 | |||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
| 2 | ① | ② | Ne | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | |||||
(2)②的原子序数是
(3)①和⑤两种元素的非金属性强弱关系:①
(4)下列化学用语正确的是
A. ④和⑥形成化合物的化学式:NaCl
B. ⑤的原子结构示意图:
C.③和⑥形成化合物的电子式:
您最近一年使用:0次
解题方法
7 . 下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:

(1)④的原子序数是________ ;
(2)⑤的原子结构示意图是____________ ;
(3)②和③两种元素的非金属性强弱关系是:②______ ③(填“>”、“<”或“=”);
(4)①和⑥两种元素组成的化合物中含有的化学键是_____ (填“共价”或“离子”)键。

(1)④的原子序数是
(2)⑤的原子结构示意图是
(3)②和③两种元素的非金属性强弱关系是:②
(4)①和⑥两种元素组成的化合物中含有的化学键是
您最近一年使用:0次
2020-03-09更新
|
426次组卷
|
2卷引用:2016年湖南省普通高中学业水平考试化学试题
名校
解题方法
8 . 2019年是元素周期表诞生150周年,元素周期表在学习、研究和生产实践中有很重要的作用。①~⑥六种元素在元素周期表中的位置如下:
请回答下列问题:
(1)⑥的元素符号为___________ 。
(2)由①③④形成的化合物是一种强碱,其化学式____________ 。
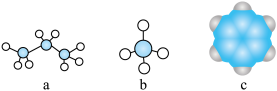
(3)由①②形成的最简单化合物的分子模型为_____________ (填序号)
(4)⑤和⑥两种元素的最高价氧化物对应的水化物之间反应的离子方程式为________________________________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ |
请回答下列问题:
(1)⑥的元素符号为
(2)由①③④形成的化合物是一种强碱,其化学式
(3)由①②形成的最简单化合物的分子模型为

(4)⑤和⑥两种元素的最高价氧化物对应的水化物之间反应的离子方程式为
您最近一年使用:0次
2020-03-09更新
|
379次组卷
|
2卷引用:2019年12月河北省高中学业水平合格性考试(2018级)化学试题
名校
9 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
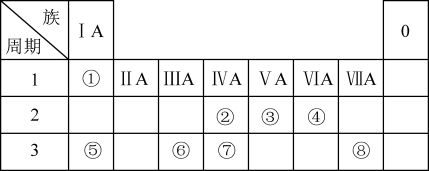
(1)地壳中含量居于第二位的元素在周期表中的位置是________________ 。
除稀有气体外,原子半径最大的元素是______ ,它的原子结构示意图是________ 。
(2)②的最高价氧化物的分子式为________ ;
⑦的最高价氧化物对应水化物的分子式为________ ;
最高价氧化物对应的水化物中酸性最强的是________ 。
(3)①④⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:________________________________ 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是________ 。
A.最高正化合价为+6
B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(5)已知X为第ⅡA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,则Y的原子序数b与a所有可能的关系式为________________ 。

(1)地壳中含量居于第二位的元素在周期表中的位置是
除稀有气体外,原子半径最大的元素是
(2)②的最高价氧化物的分子式为
⑦的最高价氧化物对应水化物的分子式为
最高价氧化物对应的水化物中酸性最强的是
(3)①④⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是
A.最高正化合价为+6
B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(5)已知X为第ⅡA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,则Y的原子序数b与a所有可能的关系式为
您最近一年使用:0次
名校
10 . 如表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
(1)金属性最强的元素是_______ ;
(2)F的原子结构示意图是________ ;
(3)地壳中含量最多的元素是_______ ;
(4)Ne原子的最外层电子数是_______ ;
(5)N与O原子半径较大的是_______ ;
(6)H2S与HCl热稳定性较弱的是______ ;
(7)Na2O与MgO难与水反应的是______ ;
(8)Mg(OH)2与Al(OH)3能与强碱反应的是______ ;
(9)用于制造光导纤维的物质是______ (填“Si”或“SiO2”);
(10)次氯酸(HClO)具有杀菌漂白作用,其中Cl元素的化合价为____ ,HClO不稳定,易分解生成HCl和O2,写出其在光照条件下分解的化学方程式:____ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | N | O | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(1)金属性最强的元素是
(2)F的原子结构示意图是
(3)地壳中含量最多的元素是
(4)Ne原子的最外层电子数是
(5)N与O原子半径较大的是
(6)H2S与HCl热稳定性较弱的是
(7)Na2O与MgO难与水反应的是
(8)Mg(OH)2与Al(OH)3能与强碱反应的是
(9)用于制造光导纤维的物质是
(10)次氯酸(HClO)具有杀菌漂白作用,其中Cl元素的化合价为
您最近一年使用:0次
2019-10-04更新
|
505次组卷
|
4卷引用:2019年6月福建省普通高中学业水平合格性考试化学试题
2019年6月福建省普通高中学业水平合格性考试化学试题(已下线)专题08 原子结构与元素周期表(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学福建省平潭县新世纪学校2020-2021学年高二上学期第一次月考化学试题(学考)福建省龙海市第二中学2020-2021学年高二上学期期中考试化学试题



