解题方法
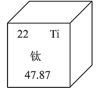
1 . 元素周期表中钛的数据如图所示,47.87的含义是___________ ;Ti在元素周期表中的位置是___________ ;基态钛原子的价电子排布式为___________ (填选项)。
您最近一年使用:0次
2 . 金属铜被广泛应用于电气、电子等领域。因原料和工艺不同,铜的冶炼主要有火法冶炼与湿法冶炼两种技术路线。
(1)铜元素位于元素周期表的
(2)基态Cu原子的核外电子排布式_______ 。
(1)铜元素位于元素周期表的
| A.s区 | B.p区 | C.ds区 | D.f区 |
您最近一年使用:0次
3 . 元素周期表中,铍(Be)与铝处于对角线的位置,它们的性质相似。试回答:
(1)Be元素在元素周期表中的位置:___________ ,有关Be性质的推断不正确的是___________ (填序号)。
a.Be是一种轻金属,能与冷水反应
b.氧化铍具有高熔点,能耐酸碱
c.常温时, 溶液的
溶液的
(2)已知: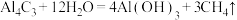 ,写出
,写出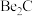 与NaOH溶液反应的离子方程式(铍酸根离子为
与NaOH溶液反应的离子方程式(铍酸根离子为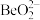 ):
):___________
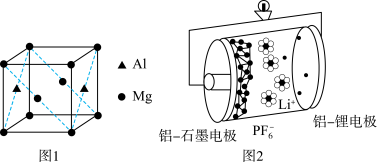
(3)基态铝原子的价电子排布式为___________ ,镁铝合金经过高温淬火获得一种储钠材料,用___________ 法测定其晶胞结构如图1所示,图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为___________ ,该立方晶胞的晶胞的密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶胞中镁铝之间的最近距离为
,则该晶胞中镁铝之间的最近距离为___________ pm。(列出计算式,可不化简)。
(4)铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为: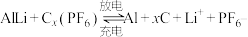 ,电池结构如图2所示。放电时,正极反应式为
,电池结构如图2所示。放电时,正极反应式为___________ ,充电时,应将铝-石墨电极与外接电源的___________ 极相连。
(1)Be元素在元素周期表中的位置:
a.Be是一种轻金属,能与冷水反应
b.氧化铍具有高熔点,能耐酸碱
c.常温时,
 溶液的
溶液的
(2)已知:
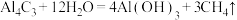 ,写出
,写出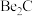 与NaOH溶液反应的离子方程式(铍酸根离子为
与NaOH溶液反应的离子方程式(铍酸根离子为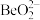 ):
):(3)基态铝原子的价电子排布式为
 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶胞中镁铝之间的最近距离为
,则该晶胞中镁铝之间的最近距离为
(4)铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为:
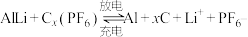 ,电池结构如图2所示。放电时,正极反应式为
,电池结构如图2所示。放电时,正极反应式为
您最近一年使用:0次
4 . 全球“青年化学家元素周期表”中多种元素由我国科学家代言,如氮、硫、钪(Sc)等。完成下列填空。
(1)钪(Sc)的原子结构示意图为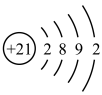 ,钪原子核外最外层电子排布式为
,钪原子核外最外层电子排布式为___________ ;Sc与第II主族相邻,Sc位于元素周期表的第___________ 族;钪的最高价态可能是___________ 。
(2)下列比较正确的是___________(选填选项)。
(3)工业上以N2为原料,以 、
、 为产品,实现了“向空气要氮肥”的目标。
为产品,实现了“向空气要氮肥”的目标。
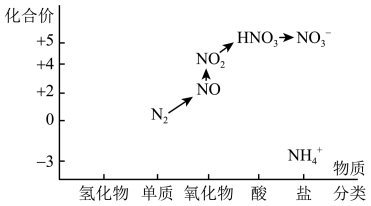
①在如下价、类二维图中用“→”和途径中间产物的化学式,画出了由N2转化为 路径。
路径。
②工业上常以氨为原料制硝酸。写出氨催化氧化的化学方程式。___________
(4)硫酸铵[(NH4)2SO4],也称肥田粉,是我国生产和施用最早的氮肥之一、写出硫酸铵使用时的注意事项及对环境的影响(各一条),并说明理由。
①___________ 。
②___________ 。
(1)钪(Sc)的原子结构示意图为
 ,钪原子核外最外层电子排布式为
,钪原子核外最外层电子排布式为(2)下列比较正确的是___________(选填选项)。
A.原子半径: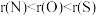 | B.热稳定性: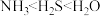 |
C.溶解性: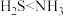 | D.微粒种类:氢硫酸<氨水 |
 、
、 为产品,实现了“向空气要氮肥”的目标。
为产品,实现了“向空气要氮肥”的目标。①在如下价、类二维图中用“→”和途径中间产物的化学式,画出了由N2转化为
 路径。
路径。
②工业上常以氨为原料制硝酸。写出氨催化氧化的化学方程式。
(4)硫酸铵[(NH4)2SO4],也称肥田粉,是我国生产和施用最早的氮肥之一、写出硫酸铵使用时的注意事项及对环境的影响(各一条),并说明理由。
①
②
您最近一年使用:0次
5 . 面对新冠肺炎病毒可以采用的消毒剂常见的有“84”消毒液,医用酒精它们的有效成分分别是NaClO、 ,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
(1)以上涉及元素包含
(2) 是
是 分子中的氢原子的类型有
分子中的氢原子的类型有
(3)NaClO的电子式
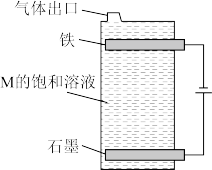
(4)①M的化学式
您最近一年使用:0次
6 . 硫是人类认识最早的元素之一,含硫物质在现代生产和生活中发挥着重要作用。
(l)我国化学家姜雪峰因其在绿色有机硫化学领域的杰出贡献被遴选为“全球青年化学家元素周期表硫元素代表”。
①硫元素在元素周期表中的位置是____ 。
②乙硫醇(CH3CH2SH)是一种含硫有机物,其分子中S-H的极性小于CH3CH2OH分子中O-H的极性,请从原子结构角度解释其原因:____ 。
(2)自然界的硫循环过程如下图所示。
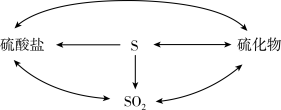
①上图所涉及的含硫物质中,能使品红溶液褪色的是____ 。
②降解石油(主要成分为CxHy)的过程中,在细菌催化作用下,石油与硫酸盐反应转化为碳酸氢盐,硫酸盐做____ (填“氧化剂”或“还原剂”)。
③煤炭中的硫化物主要为FeS2(S为-1价)。在潮湿的环境中,FeS2可在氧化亚铁硫杆菌(T.f)的作用下被空气氧化为Fe2(SO4)3,该反应的化学方程式为____ 。
(l)我国化学家姜雪峰因其在绿色有机硫化学领域的杰出贡献被遴选为“全球青年化学家元素周期表硫元素代表”。
①硫元素在元素周期表中的位置是
②乙硫醇(CH3CH2SH)是一种含硫有机物,其分子中S-H的极性小于CH3CH2OH分子中O-H的极性,请从原子结构角度解释其原因:
(2)自然界的硫循环过程如下图所示。

①上图所涉及的含硫物质中,能使品红溶液褪色的是
②降解石油(主要成分为CxHy)的过程中,在细菌催化作用下,石油与硫酸盐反应转化为碳酸氢盐,硫酸盐做
③煤炭中的硫化物主要为FeS2(S为-1价)。在潮湿的环境中,FeS2可在氧化亚铁硫杆菌(T.f)的作用下被空气氧化为Fe2(SO4)3,该反应的化学方程式为
您最近一年使用:0次
2011·上海·零模
名校
7 . (1)原子核内无中子的元素可放在元素周期表的_____ 族,又根据最高正化合价和负化合价的绝对值相等可放在_____ 族,该元素还可放在元素周期表的_____ 族。它和氧元素可形成的化合物为________________ 。
(2)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”。

则A、B两幅图中能表示“热冰”的示意图为_____ 。使水结成“热冰”采用“弱电场”的条件,说明水分子是 _______ 分子。
(3)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子(H2O+),由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与H2S的水溶液反应的离子方程式__________________________________________ ;该反应破坏的化学键是__________ 。
(2)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”。

则A、B两幅图中能表示“热冰”的示意图为
(3)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子(H2O+),由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与H2S的水溶液反应的离子方程式
您最近一年使用:0次
2012·上海闵行·三模
8 . 碳族元素的单质及其化合物是一类重要物质。请回答下列问题:
(1)碳族元素位于元素周期表的___ ,从原子结构角度分析,它们的共同点是___ 。
(2)元素周期表中每一种元素都有具体信息,如图是碳元素的相关信息,其中“2s22p2”表示的是___ 。“12.01”是指___ (选填答案编号)

a.12C的相对原子质量 b.碳的摩尔质量
c.碳元素的相对原子质量 d.碳的质量数
(3)合成氮化碳是一种硬度比金刚石还大的晶体,氮化碳的晶体类型为__ ,该晶体中微粒间的作用力是___ 。
(4)SiH4是___ (极性或非极性)分子,与CH4相比,其化学稳定性SiH4___ CH4(选填“<”、“>”)。
(1)碳族元素位于元素周期表的
(2)元素周期表中每一种元素都有具体信息,如图是碳元素的相关信息,其中“2s22p2”表示的是

a.12C的相对原子质量 b.碳的摩尔质量
c.碳元素的相对原子质量 d.碳的质量数
(3)合成氮化碳是一种硬度比金刚石还大的晶体,氮化碳的晶体类型为
(4)SiH4是
您最近一年使用:0次
9 . 以氮化镓(GaN)、碳化硅、金刚石等为代表的第三代半导体材料具有高发光效率、抗腐蚀、化学稳定性好、高强度等特性,是目前最先进的半导体材料。完成下列填空:
(1)组成上述三种半导体材料的各种元素中,原子半径最小的元素在周期表中的位置是_______ 。原子序数最小的元素原子的核外电子排布式是___________ 。
(2)镓元素的相对原子质量为69.72,自然界中的镓共有两种稳定的同位素,其中69Ga的原子个数百分含量为60.1%,则另一种镓的同位素可表示为______ 。
(3)镓、铝为同族元素,性质相似。下表是两种两性氢氧化物的电离常数。
①写出氢氧化镓的电离方程式:______________ 。
②将一块镓铝合金完全溶于烧碱溶液,再往反应后的溶液中缓缓通入CO2,最先析出的氢氧化物是___________ 。
(4)碳化硅单晶是目前技术最成熟的第三代半导体材料。下列能说明碳的非金属性强于硅的反应(或反应组)是_____ (选填编号)
a.SiO32- + 2CO2 + 2H2O → H2SiO3 + 2HCO3—
b.SiO2 + 2C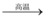 Si + 2CO↑
Si + 2CO↑
c.SiH4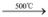 Si + 2H2;CH4
Si + 2H2;CH4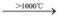 C + 2H2
C + 2H2
d.Si + O2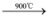 SiO2;C + O2
SiO2;C + O2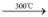 CO2
CO2
(1)组成上述三种半导体材料的各种元素中,原子半径最小的元素在周期表中的位置是
(2)镓元素的相对原子质量为69.72,自然界中的镓共有两种稳定的同位素,其中69Ga的原子个数百分含量为60.1%,则另一种镓的同位素可表示为
(3)镓、铝为同族元素,性质相似。下表是两种两性氢氧化物的电离常数。
| 两性氢氧化物 | Al(OH)3 | Ga(OH)3 |
| 酸式电离常数Kia | 2×10-11 | 1×10-7 |
| 碱式电离常数Kib | 1.3×10-33 | 1.4×10-34 |
①写出氢氧化镓的电离方程式:
②将一块镓铝合金完全溶于烧碱溶液,再往反应后的溶液中缓缓通入CO2,最先析出的氢氧化物是
(4)碳化硅单晶是目前技术最成熟的第三代半导体材料。下列能说明碳的非金属性强于硅的反应(或反应组)是
a.SiO32- + 2CO2 + 2H2O → H2SiO3 + 2HCO3—
b.SiO2 + 2C
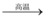 Si + 2CO↑
Si + 2CO↑c.SiH4
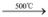 Si + 2H2;CH4
Si + 2H2;CH4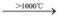 C + 2H2
C + 2H2d.Si + O2
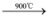 SiO2;C + O2
SiO2;C + O2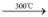 CO2
CO2
您最近一年使用:0次
10 . 硅是重要的半导体材料,构成现代电子工业的基础。硅及其化合物在工业中应用广泛,在国防和航天工业中亦有许多用途。
(1)硅原子中最外层电子排布式为___ ,该层电子的电子云有___ 种不同的伸展方向。
(2)温石棉矿是一种硅酸盐类矿物,化学式写作氧化物形式为6MgO•4SiO2•4H2O,其中原子半径最大的元素在周期表中的位置是___ 。SiO2存在与金刚石结构类似的晶体,其中硅氧原子之间以___ 相结合。
a.离子键 b.极性键 c.非极性键 d.范德华力
(3)甲硅烷(SiH4)是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,10gSiH4自燃放出热量446kJ,请写出其燃烧的热化学方程式:___ ;
(4)SiH4的热稳定性不如CH4,其原因是___ 。
工业上硅铁可以用于冶镁。以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合,置于密闭设备中于1200℃发生反应:2(CaO•MgO)(s)+Si(s)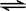 Ca2SiO4(l)+2Mg(g)
Ca2SiO4(l)+2Mg(g)
(5)常温下镁的还原性强于硅。上述方法能够获得镁的原因是:___ 。
(6)若上述反应在容积为aL的密闭容器中发生,一定能说明反应已达平衡的是___ (选填编号)。
a.反应物不再转化为生成物
b.炉内Ca2SiO4与CaO•MgO的质量比保持不变
c.反应放出的总热量不再改变
d.单位时间内,n(CaO•MgO)消耗:n(Ca2SiO4)生成=2:1
若bg煅白经tmin反应后转化率达70%,该时段内Mg的生成速率是___ 。
(1)硅原子中最外层电子排布式为
(2)温石棉矿是一种硅酸盐类矿物,化学式写作氧化物形式为6MgO•4SiO2•4H2O,其中原子半径最大的元素在周期表中的位置是
a.离子键 b.极性键 c.非极性键 d.范德华力
(3)甲硅烷(SiH4)是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,10gSiH4自燃放出热量446kJ,请写出其燃烧的热化学方程式:
(4)SiH4的热稳定性不如CH4,其原因是
工业上硅铁可以用于冶镁。以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合,置于密闭设备中于1200℃发生反应:2(CaO•MgO)(s)+Si(s)
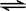 Ca2SiO4(l)+2Mg(g)
Ca2SiO4(l)+2Mg(g)(5)常温下镁的还原性强于硅。上述方法能够获得镁的原因是:
(6)若上述反应在容积为aL的密闭容器中发生,一定能说明反应已达平衡的是
a.反应物不再转化为生成物
b.炉内Ca2SiO4与CaO•MgO的质量比保持不变
c.反应放出的总热量不再改变
d.单位时间内,n(CaO•MgO)消耗:n(Ca2SiO4)生成=2:1
若bg煅白经tmin反应后转化率达70%,该时段内Mg的生成速率是
您最近一年使用:0次



