13-14高三·四川成都·阶段练习
名校
1 . 二氧化氯是黄绿色的气体,可用于水体消毒与废水处理.一种制备方法为:
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是______ .
(2)该反应每产生0.2mol ClO2,需要消耗草酸晶体(H2C2O4•2H2O)_____ g.
(3)上述反应物中属于第三周期的元素的原子半径大小顺序是______ ,其中原子半径最大的元素最外层电子云形状为______ .
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与_______ 相同.(写一种)
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:__________ .
(6)上述反应产物NaCl中含有______ 键,工业上用电解熔融的氯化钠制备金属钠,氯气在_____ (写电极名称)产生.
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是
(2)该反应每产生0.2mol ClO2,需要消耗草酸晶体(H2C2O4•2H2O)
(3)上述反应物中属于第三周期的元素的原子半径大小顺序是
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:
(6)上述反应产物NaCl中含有
您最近一年使用:0次
2017-09-07更新
|
228次组卷
|
3卷引用:上海市虹口区2014届高三二模化学试题
名校
2 . 硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼在元素周期表中的位置为____________ ,硼元素有两种天然同位素10B和11B,硼元素的近似相对原子质量为10.8,则两种同位素原子的原子个数之比为_____________ 。
(2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式__________________________ 。
(3)硼酸(H3BO3)是一种白色片状晶体,微溶于水,对人体的受伤组织有着和缓的防腐消毒作用。硼酸是一元弱酸,室温时0.1mol/L硼酸的pH为5,计算硼酸的电离常数数K=____________ 。
氟硼酸(HBF4)是一种强酸,仅以离子状态存在于水中,请写出BF4-的电子式____________ 。
(4)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构____________ (填“相同”或“不相同”)。
②B2H6可由BF3与NaBH4在一定条件下反应制得,写出该反应的化学方程式_____________ 。
③B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为____________ L。
(1)硼在元素周期表中的位置为
(2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式
(3)硼酸(H3BO3)是一种白色片状晶体,微溶于水,对人体的受伤组织有着和缓的防腐消毒作用。硼酸是一元弱酸,室温时0.1mol/L硼酸的pH为5,计算硼酸的电离常数数K=
氟硼酸(HBF4)是一种强酸,仅以离子状态存在于水中,请写出BF4-的电子式
(4)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构
②B2H6可由BF3与NaBH4在一定条件下反应制得,写出该反应的化学方程式
③B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为
您最近一年使用:0次
2017-05-07更新
|
803次组卷
|
3卷引用:黑龙江省哈尔滨师范大学附属中学2017届高三第三次模拟考试化学试题
3 . 在工业上,通过含锌矿石制取应用广泛的锌及其化合物。
(1)Zn在元素周期表中位于_____ 区,其基态原子价电子排布式为________ 。
(2)[Zn(CN)4]2-常用于电镀工业中,其中配位原子基态时核外电子的轨道表示式为_____ ,与CN-互为等电子体的粒子有_____ 、________ (写出两种)。
(3)[Zn(CN)4]2-在水溶液中与甲醛(HCHO)溶液反应可制得HOCH2CN。甲醛分子的立体构型为________ .中心原子杂化方式为________ ;HOCH2CN中元素电负性由大到小的顺序_______ ,1 mol HOCH2CN分子中,含有σ键的数为_________ 。
(4)ZnS和HgS晶体在岩浆中先晶出的是________ ,其原因是___________ 。
(5)ZnO的一种晶体结构与金刚石类似,4 个锌原子占据金刚石中晶胞内四个碳原子的位置,则该氧化物的密度为______ g/cm3(设晶胞参数为apm,NA表示阿伏伽德罗常数)
(1)Zn在元素周期表中位于
(2)[Zn(CN)4]2-常用于电镀工业中,其中配位原子基态时核外电子的轨道表示式为
(3)[Zn(CN)4]2-在水溶液中与甲醛(HCHO)溶液反应可制得HOCH2CN。甲醛分子的立体构型为
(4)ZnS和HgS晶体在岩浆中先晶出的是
(5)ZnO的一种晶体结构与金刚石类似,4 个锌原子占据金刚石中晶胞内四个碳原子的位置,则该氧化物的密度为
您最近一年使用:0次
2017-05-03更新
|
334次组卷
|
2卷引用:2017届湖北省华中师范大学(新高考联盟)高三2月教学质量测评理综化学试卷
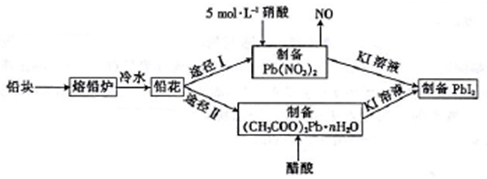
4 . 铅及并化合物在工业生产中具有非常广泛的用途,根据以下流程回答相关问题。
(1)铅是碳的同族元素,且比碳多4个电子层,则铅位于元素周期表第___ 周期__ 族。
(2)反位条件的控制在工业生产中有着极其重要的作用。把铅块制成铅花的目的是_______ 。途径I中不用14 mol·L-1的浓硝酸制备硝酸铅的原因是______________________ 。
(3)写出(CH3COO)2Pb溶液[(CH3COO)2Pb 为弱电解质]与KI溶液反应的离子方程式:_________ 。
(4)取75.8 g (CH3COO)2Pb • nH2O样品在N2气氛中加热,测得剩余固体质量随温度的变化如图所示(样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb • nH2O中n=______ 。
②150~200℃间分解产物为PbO和一种有机物M,M能与水反应生成乙酸,则该温度区间内分解反应的化学方程式为________________________________ 。
(5)T℃时,取一定量的PbI2固体,用蒸馏水配制成饱和溶液。准确移取25.00mL PbI2饱和溶液,分次加入阳离子交换树脂RH(发生反应:2RH+Pb2+==R2Pb+2H+)中,用250 mL洁净的锥形瓶接受流出液,用蒸馏水淋洗树脂至流出液呈中性。将洗涤液一并盛放到锥形瓶中,加入酚酞,用0.0025 mol·L-1的NaOH溶液滴定,重复上述操作2次,当达到滴定终点时,平均消耗氢氧化钠溶液20.00 mL。则T℃时PbI2的Ksp=_______________________ 。
(1)铅是碳的同族元素,且比碳多4个电子层,则铅位于元素周期表第
(2)反位条件的控制在工业生产中有着极其重要的作用。把铅块制成铅花的目的是
(3)写出(CH3COO)2Pb溶液[(CH3COO)2Pb 为弱电解质]与KI溶液反应的离子方程式:
(4)取75.8 g (CH3COO)2Pb • nH2O样品在N2气氛中加热,测得剩余固体质量随温度的变化如图所示(样品在75℃时已完全失去结晶水)。
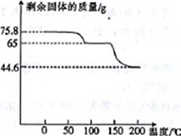
①(CH3COO)2Pb • nH2O中n=
②150~200℃间分解产物为PbO和一种有机物M,M能与水反应生成乙酸,则该温度区间内分解反应的化学方程式为
(5)T℃时,取一定量的PbI2固体,用蒸馏水配制成饱和溶液。准确移取25.00mL PbI2饱和溶液,分次加入阳离子交换树脂RH(发生反应:2RH+Pb2+==R2Pb+2H+)中,用250 mL洁净的锥形瓶接受流出液,用蒸馏水淋洗树脂至流出液呈中性。将洗涤液一并盛放到锥形瓶中,加入酚酞,用0.0025 mol·L-1的NaOH溶液滴定,重复上述操作2次,当达到滴定终点时,平均消耗氢氧化钠溶液20.00 mL。则T℃时PbI2的Ksp=
您最近一年使用:0次
2017-04-20更新
|
459次组卷
|
3卷引用:2017届湖南省郴州市高三第四次质量检测理科综合化学试卷
5 . Na2S 常用作皮革脱毛剂,工业上用反应 Na2SO4 +2C Na2S+2CO2↑ 进行制取。
Na2S+2CO2↑ 进行制取。
完成下列填空:
(1)硫元素在周期表中的位置为______________ 。上述反应中涉及的各元素中原子半径最小的是
__________ (填元素符号)。写出硫化钠的电子式:___________ 。
(2)用上述反应中涉及的元素,写出一个含有非极性键的化合物的化学式。_____________
(3)写出一个能比较 S 和 O 非金属性强弱的化学事实。________________________________
(4)在 2L 的容器内发生上述反应,2 小时内共生成 78 g 硫化钠,则这段时间内用二氧化碳表示的平均反应速率为______________ mol/(L·h) 。
(5)将硫化钠溶液滴入氯化铝溶液中,产生白色沉淀,同时有臭鸡蛋气味的气体生成,用平衡移动原理解
释上述现象。______________________________
 Na2S+2CO2↑ 进行制取。
Na2S+2CO2↑ 进行制取。完成下列填空:
(1)硫元素在周期表中的位置为
(2)用上述反应中涉及的元素,写出一个含有非极性键的化合物的化学式。
(3)写出一个能比较 S 和 O 非金属性强弱的化学事实。
(4)在 2L 的容器内发生上述反应,2 小时内共生成 78 g 硫化钠,则这段时间内用二氧化碳表示的平均反应速率为
(5)将硫化钠溶液滴入氯化铝溶液中,产生白色沉淀,同时有臭鸡蛋气味的气体生成,用平衡移动原理解
释上述现象。
您最近一年使用:0次
6 . 下表为元素周期表的一部分。
回答下列问题
(1)表中元素原子半径最大的是(写元素符号)__________ ,Z原子核外电子能量最高的电子亚层是__________ 。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式解释产生该现象的原因:_________________ ;在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因______________________________________________________ 。
(4)硫酸工业生产中接触室内发生的反应方程式为______________________________________ ;
在实际生产中,操作温度选定400—500℃、压强通常采用常压的原因分别是__________________________________________________________________________________________________ 。
碳 | 氮 | Y | |
X | 硫 | Z |
(1)表中元素原子半径最大的是(写元素符号)
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式解释产生该现象的原因:
(4)硫酸工业生产中接触室内发生的反应方程式为
在实际生产中,操作温度选定400—500℃、压强通常采用常压的原因分别是
您最近一年使用:0次
2017-04-11更新
|
285次组卷
|
3卷引用:上海市控江中学2018届高三上学期第一次统一考试化学试题
7 . 下图是元素周期表的一部分。
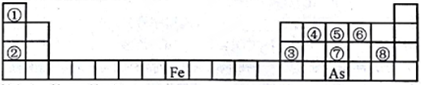
I.用化学用语回答下列问题:
(1)②、⑥、⑧的离子半径由大到小的顺序为_________ (用离子符号表示)。
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_______ 。(用化学式表示)
(3)As的原子结构示意图为_______ ;其氢化物的化学式为_______ 。
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_________ ,当消耗1mol还原剂时,电子转移了______ mol。
Ⅱ.A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去),若常温下A为红棕色气体,B为强酸,X为常见金属单质。
(5)A与水反应的化学方程式为_______________ 。
(6)工业上常用热还原法冶炼X,写出其化学方程式___________ 。
(7)某温度下(>100℃)若m克X与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式_______________ 。

I.用化学用语回答下列问题:
(1)②、⑥、⑧的离子半径由大到小的顺序为
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
(3)As的原子结构示意图为
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为
Ⅱ.A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去),若常温下A为红棕色气体,B为强酸,X为常见金属单质。
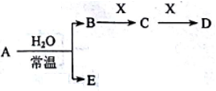
(5)A与水反应的化学方程式为
(6)工业上常用热还原法冶炼X,写出其化学方程式
(7)某温度下(>100℃)若m克X与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式
您最近一年使用:0次
8 . 铜是人类最早发现的金属,也是人类广泛使用的一种金属。铜及其化合物在工业、工程技术和工艺上有着广泛的应用。
(1)早期发现的天然准晶颗粒由Cu、Fe、Al三种金属元素组成。Fe元素位于元素周期表的____ 区。基态Al原子的L层电子排布图为___________ 。
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到,同时可得到乙酸。乙醛中碳原子的杂化轨道类型为_________ ,1mol乙酸分子中含有的σ键的数目为____________ 。
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。一价铜离子的电子排布式为____ 。碳、硼、氮元素的电负性由大到小的顺序是_____ 。(用元素符号表示)
(4)在络离子[Cu(NH3)4]2+中NH3的VSEPR模型为_________ 。
(5)铜银合金晶体具有面心立方最密堆积结构。在晶胞中,Cu原子位于面心,Ag原子位于顶点,若该晶胞边长为r pm,则合金的密度为____ g·cm-3(设阿伏伽德罗常数的值为NA)。
(1)早期发现的天然准晶颗粒由Cu、Fe、Al三种金属元素组成。Fe元素位于元素周期表的
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到,同时可得到乙酸。乙醛中碳原子的杂化轨道类型为
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。一价铜离子的电子排布式为
(4)在络离子[Cu(NH3)4]2+中NH3的VSEPR模型为
(5)铜银合金晶体具有面心立方最密堆积结构。在晶胞中,Cu原子位于面心,Ag原子位于顶点,若该晶胞边长为r pm,则合金的密度为
您最近一年使用:0次
解题方法
9 . C、N、O、S、Mg、Fe等是中学化学中的常见元素。按要求回答下列问题:
(1)N元素在元素周期表中的位置是______________ 。
(2) H2S的沸点比H2O的沸点低的主要原因是__________________ 。
(3)已知:2 SO2(g) +O2(g)- 2 SO3(g) △H=-196.6 kJ·mol-l
2 SO3(g) △H=-196.6 kJ·mol-l
2 NO(g) +O2(g) 2 NO2(g) AH="-113.0" kJ·mol-l
2 NO2(g) AH="-113.0" kJ·mol-l
则反应NO2(g) +SO2(g) SO3(g)+NO(g)的△H=
SO3(g)+NO(g)的△H=___________ kJ·mol-l
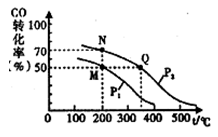
(4)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2 H2(g) CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为
CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为_______ ;Pl_______ P2(填“>、<或=”);平衡常数KM=__________ 。
(5) Mg和Fe组成的合金是目前已发现的储氢密度最(高的储氢材料之一,其晶胞结构如图甲(白球代表Mg,黑球代表Fe)。则该合金的化学式为____________ 。若该合金用M表示,某种储氢镍电池(MH - Ni电池)的结构如图乙所示。其电池反应为:MH+NiOOH Ni( OH)2 +M。下列有关说法不正确的是
Ni( OH)2 +M。下列有关说法不正确的是________ 。
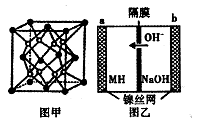
A.放电时正极反应为:NiOOH+H2O+e-= Ni(OH)2 +OH-
B.放电时电子由b极到a极
C.充电时负极反应为:MH+ OH- - e-= H20+M
D.M的储氢密度越大,电池的比能量越高
(1)N元素在元素周期表中的位置是
(2) H2S的沸点比H2O的沸点低的主要原因是
(3)已知:2 SO2(g) +O2(g)-
 2 SO3(g) △H=-196.6 kJ·mol-l
2 SO3(g) △H=-196.6 kJ·mol-l2 NO(g) +O2(g)
 2 NO2(g) AH="-113.0" kJ·mol-l
2 NO2(g) AH="-113.0" kJ·mol-l则反应NO2(g) +SO2(g)
 SO3(g)+NO(g)的△H=
SO3(g)+NO(g)的△H=(4)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2 H2(g)
 CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为
CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为
(5) Mg和Fe组成的合金是目前已发现的储氢密度最(高的储氢材料之一,其晶胞结构如图甲(白球代表Mg,黑球代表Fe)。则该合金的化学式为
 Ni( OH)2 +M。下列有关说法不正确的是
Ni( OH)2 +M。下列有关说法不正确的是
A.放电时正极反应为:NiOOH+H2O+e-= Ni(OH)2 +OH-
B.放电时电子由b极到a极
C.充电时负极反应为:MH+ OH- - e-= H20+M
D.M的储氢密度越大,电池的比能量越高
您最近一年使用:0次
13-14高三上·上海虹口·期末
10 . 下表中所列的字母分别代表某一化学元素。完成下列填空:
(1)h的最外层有____ 种运动状态的电子。a、b、c三种元素形成的化合物电子式为________ 。
(2)d单质溶于i的最高价氧化物对应水化物的溶液时发生反应的离子方程式为____________ 。
(3) 元素e与f元素相比,非金属性较强的是__________ (写元素符号),下列表述中能证明这一事实的是__________ (选填序号)。
a. e的阴离子还原性强于f的阴离子 b. f的氢化物酸性强于e的氢化物
c. e单质的熔点高于f单质 d. e和f形成的化合物中,e显正价,f显负价
(4)元素X(非a~i元素)是所在周期原子半径最大的非金属元素,它的气态氢化物为三角锥形极性分子,写出X在周期表中的位置_______________________________ 。
| a | |||||||||||||||||
| b | |||||||||||||||||
| c | d | e | f | ||||||||||||||
| g | |||||||||||||||||
| h | |||||||||||||||||
| i | |||||||||||||||||
(1)h的最外层有
(2)d单质溶于i的最高价氧化物对应水化物的溶液时发生反应的离子方程式为
(3) 元素e与f元素相比,非金属性较强的是
a. e的阴离子还原性强于f的阴离子 b. f的氢化物酸性强于e的氢化物
c. e单质的熔点高于f单质 d. e和f形成的化合物中,e显正价,f显负价
(4)元素X(非a~i元素)是所在周期原子半径最大的非金属元素,它的气态氢化物为三角锥形极性分子,写出X在周期表中的位置
您最近一年使用:0次



