23-24高二下·全国·课后作业
1 . 1869年俄国科学家门捷列夫绘制出了第一张元素周期表,成为化学史上的里程碑之一,且大大地促进了化学学科的快速发展。下表是现代元素周期表的一部分,请据表回答下列问题:
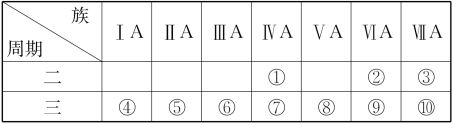
(1)元素③的名称是___________ ,金属性最强的元素是___________ (填元素符号)。
(2)①②⑤三种元素原子半径由大到小的顺序为___________ (填序号)。
(3)元素⑦的单质的一种用途是___________ (填写“制造玻璃”或“制造计算机芯片”)。
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是___________ (填化学式)。

(1)元素③的名称是
(2)①②⑤三种元素原子半径由大到小的顺序为
(3)元素⑦的单质的一种用途是
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是
您最近一年使用:0次
22-23高二下·上海浦东新·期末
2 . 元素周期表是元素周期律的具体表现形式,是学习和研究化学的重要工具,下图是元素周期表的一部分。

(1)氧元素在周期表中的位置是第_______ 周期_______ 族,氧原子的电子式为_______ 。
(2)某元素的结构示意图为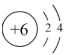 ,请在上图相应位置填入该元素的元素符号
,请在上图相应位置填入该元素的元素符号_______ 。
(3)元素性质呈现周期性变化的根本原因是_______。

(1)氧元素在周期表中的位置是第
(2)某元素的结构示意图为
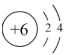 ,请在上图相应位置填入该元素的元素符号
,请在上图相应位置填入该元素的元素符号(3)元素性质呈现周期性变化的根本原因是_______。
| A.元素相对原子质量的递增 |
| B.元素原子半径呈现周期性变化 |
| C.元素原子核外电子排布呈现周期性变化 |
| D.元素金属性和非金属性呈现周期性变化 |
您最近一年使用:0次
解题方法
3 . 表中是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)写出元素符号和名称。
①_____ ,②_____ ,⑧_____ ,⑨_____ 。
(2)写出下列反应的化学方程式。
⑦的单质跟④的氢氧化物溶液反应:_____ 。
⑤的氧化物跟⑥的最高价氧化物的水化物反应:_____ 。
⑥的单质在③的单质中燃烧:_____ 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
①
(2)写出下列反应的化学方程式。
⑦的单质跟④的氢氧化物溶液反应:
⑤的氧化物跟⑥的最高价氧化物的水化物反应:
⑥的单质在③的单质中燃烧:
您最近一年使用:0次
4 . 已知铷是37号元素。根据相关知识回答下列问题:
(1)请推测铷(Rb)在元素周期表的第___________ 周期第___________ 族。
(2)关于铷的结构和性质判断正确的是___________(填字母,下同)。
①与水反应比钠剧烈 ②它的原子半径比钠小
③它的氧化物暴露在空气中易吸收CO2 ④它的阳离子最外层电子数和镁相同
⑤它是还原剂
(3)氢化铷与水反应可放出氢气,则下列叙述正确的是___________。
(4)现有铷和另一种碱金属形成的合金50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L,这种碱金属可能是________。
(1)请推测铷(Rb)在元素周期表的第
(2)关于铷的结构和性质判断正确的是___________(填字母,下同)。
①与水反应比钠剧烈 ②它的原子半径比钠小
③它的氧化物暴露在空气中易吸收CO2 ④它的阳离子最外层电子数和镁相同
⑤它是还原剂
| A.①③④ | B.①③⑤ | C.②③⑤ | D.②④ |
| A.氢化铷溶于水显酸性 |
| B.氢化铷与水反应时被还原为氢气 |
| C.氢化铷是离子化合物,其中氢离子最外层有2个电子 |
| D.氢化铷与水反应时,生成1mol H2将转移2mol e- |
| A.Li | B.Na | C.K | D.Cs |
您最近一年使用:0次
5 . 元素周期律是对元素性质的规律性总结,元素周期表是这种规律的呈现形式。利用元素周期律可以推测一些未知元素可能的性质。根据你所学的周期律,回答下列问题:
(1)元素周期表有几个周期,几个主族。正确选项是
(2) 被誉为21世纪明星金属,其最外层电子数为___________(填序号)。
被誉为21世纪明星金属,其最外层电子数为___________(填序号)。
(3)元素周期表中,第三电子层有一个未成对电子的元素有___________种(填序号)。
(1)元素周期表有几个周期,几个主族。正确选项是
| A.6,7 | B.7,7 | C.7,18 | D.7,14 |
 被誉为21世纪明星金属,其最外层电子数为___________(填序号)。
被誉为21世纪明星金属,其最外层电子数为___________(填序号)。| A.1个 | B.2个 | C.3个 | D.5个 |
| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
6 . 分析下列图表,回答问题。
(1)N、Al、Si、Ge四种元素中,某种元素的电离能数据如下:
则该元素是_______ (填写元素符号)。
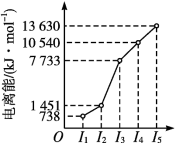
(2)短周期某主族元素M的电离能情况如图所示。则M元素位于周期表的第_______ 族。
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价层电子排布式:_______ ,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_______ 。
(1)N、Al、Si、Ge四种元素中,某种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | …… |
| In/( kJ∙mol−1) | 578 | 1 817 | 2 745 | 11 575 | …… |
(2)短周期某主族元素M的电离能情况如图所示。则M元素位于周期表的第

(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| I1 | 717 | 759 | |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
您最近一年使用:0次
2022高二上·四川·学业考试
7 . 下表列出了①~④四种元素在周期表中的位置.
回答下列问题:
(1)①的元素符号为_____________ 。
(2)②的基态原子电子排布式为__________________________ 。
(3)③和④中原子半径较大的是_____________ (填元素符号)。
(4)如图是③原子中s电子和p电子的电子云轮廓图。s电子的电子云形状为_____________ 形;每个p能级都有_____________ 个相互垂直的电子云。

| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | |||||||
| 3 | ② | ③ | ||||||
| 4 | ④ |
回答下列问题:
(1)①的元素符号为
(2)②的基态原子电子排布式为
(3)③和④中原子半径较大的是
(4)如图是③原子中s电子和p电子的电子云轮廓图。s电子的电子云形状为

您最近一年使用:0次
解题方法
8 . 原子结构与元素周期表存在着内在联系。根据已学知识,请你回答下列问题:
(1)指出31号元素镓(Ga)在元素周期表中的位置:_______ 周期_______ 族。
(2)X原子在第二电子层上只有一个空轨道,则X是_______ ;其轨道表示式为_______ 。
(3)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为:_______ 。
(4)写出原子序数最小的Ⅷ族元素原子的核外电子排布式:_______ 。
(5)写出3p轨道上有2个未成对电子的元素符号:_______ 。
(6)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为3d54s1,该元素的名称为:_______ 。
(1)指出31号元素镓(Ga)在元素周期表中的位置:
(2)X原子在第二电子层上只有一个空轨道,则X是
(3)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为:
(4)写出原子序数最小的Ⅷ族元素原子的核外电子排布式:
(5)写出3p轨道上有2个未成对电子的元素符号:
(6)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为3d54s1,该元素的名称为:
您最近一年使用:0次
2022-12-20更新
|
289次组卷
|
2卷引用:1.2.2核外电子排布与元素周期表(课后)-鲁科版选择性必修2
22-23高一上·全国·课时练习
9 . 原子结构特点(F→I)
(1)相似性:最外层电子数均为_______ 。
(2)递变性:电子层数逐渐_______ ,原子半径逐渐_______ 。
(1)相似性:最外层电子数均为
(2)递变性:电子层数逐渐
您最近一年使用:0次
22-23高一上·全国·课时练习
10 . 元素周期表和元素周期律的应用
(1)根据同周期、同主族元素性质的递变规律判断元素性质的_______________ 。
(2)应用于_______________ 元素的相互推断。
(3)预测新元素
为新元素的发现及预测它们的_______________ 提供线索。
(4)寻找新物质
①在金属与非金属分界线附近寻找_______________ 。
②研究_______________ 附近元素,制造新农药。
③在_______________ 中寻找催化剂和耐高温、耐腐蚀的合金材料。
(1)根据同周期、同主族元素性质的递变规律判断元素性质的
(2)应用于
(3)预测新元素
为新元素的发现及预测它们的
(4)寻找新物质
①在金属与非金属分界线附近寻找
②研究
③在
您最近一年使用:0次



