1 . 门捷列夫曾预测镓、钪、锗元素的存在及其性质,三种元素后来被发现,且性质与预测相吻合;莫塞莱也曾预测锝、钷、铪、铼等元素的存在,这些元素几十年后也分别被发现。到目前为止,元素周期表的第七周期已经被填满。你认为周期表是否还能拓展?请你设想一下,如果发现119号元素,它应该位于周期表的什么位置,可能具有什么性质?你对元素周期表有什么新的认识?_____
您最近一年使用:0次
2 . 在元素周期表中,氧、硫、硒、碲4种元素属于第ⅥA族元素(又称氧族元素),请回答下列问题。
(1)查阅资料,填写下表中的空白_______ 。
(2)根据上表中的数据,找出氧、硫、硒、碲的熔点、沸点和密度的变化规律_____ 。
(3)若要研究氧、硫、硒、碲4种元素非金属性强弱的变化规律,你认为可从哪些方面入手_____ ?
(1)查阅资料,填写下表中的空白
| 元素名称 | 元素符号 | 核电荷数 | 原子结构示意图 | 单质 | 氢化物 | 氧化物的化学式 | 氧化物的水化物的化学式 | ||||
| 熔点 ℃ | 沸点 ℃ | 密度 (g·cm-3) | 化学式 | 化和条件 | 稳定性变化规律 | ||||||
| 氧 | O | 8 |  | 点燃 | — | — | |||||
| 硫 | S | 16 | 加热 |   | |||||||
| 硒 | Se | 34 | 217 | 684.9 | 4.81 | 加热 | |||||
| 碲 | Te | 52 | 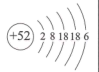 | 452 | 1390 | 6.25 | 不直接化合 | ||||
(3)若要研究氧、硫、硒、碲4种元素非金属性强弱的变化规律,你认为可从哪些方面入手
您最近一年使用:0次
3 . 门捷列夫在他的第一张周期表上留下的空位中的元素“类铝”于1875年由法国化学家布瓦博德朗发现,并命名为镓,而布瓦博德朗当时并未受到门捷列夫预言的启发。门捷列夫在得知这一发现后指出:他相信镓和“类铝”是同一种物质,并认为镓的密度应该是5.9-6.0g/cm3,而不是布瓦博德朗发表的4.7g/cm3。当时布瓦博德朗认为只有他本人才拥有镓,门捷列夫怎么会知道这种金属的密度呢?他没有固执己见,重新提纯了镓,最后测得的密度果然是5.94g/cm3。这一发现使他大为惊讶,他在一篇论文中写道:“我以为没有必要再来说明门捷列夫这一理论的巨大意义了。”
(1)阅读上述资料,你得到什么启示?写一篇小论文与同学交流_________ 。
(2)请你查阅资料,了解门捷列夫还预言了哪些新元素,以及当时这些新元素是如何被确认的,撰写研究报告,并与同学交流____________ 。
(1)阅读上述资料,你得到什么启示?写一篇小论文与同学交流
(2)请你查阅资料,了解门捷列夫还预言了哪些新元素,以及当时这些新元素是如何被确认的,撰写研究报告,并与同学交流
您最近一年使用:0次
4 . 2006年,科学家以钙离子撞击锎(Cf)靶,产生了一种超重元素——  (Og),其反应可表示为:
(Og),其反应可表示为: 。请判断
。请判断 在周期表中的位置
在周期表中的位置_________ ,并推测其可能与哪类元素性质相似_________ 。
 (Og),其反应可表示为:
(Og),其反应可表示为: 。请判断
。请判断 在周期表中的位置
在周期表中的位置
您最近一年使用:0次
5 . 根据元素周期表中1~20号元素的性质和递变规律,填写下列空白。
(1)属于金属元素的有_____ 种,属于稀有气体元素的有_____ (填元素符号,下同)。
(2)第三周期中,原子半径最大的元素是(稀有气体元素除外)_____ 。
(3)推测 、N的非金属性强弱:
、N的非金属性强弱:_____ 大于_____ 。
(4)第三周期中金属性最强的元素与氧气反应,生成的化合物有_____ (写出两种化合物的化学式)。
(1)属于金属元素的有
(2)第三周期中,原子半径最大的元素是(稀有气体元素除外)
(3)推测
 、N的非金属性强弱:
、N的非金属性强弱:(4)第三周期中金属性最强的元素与氧气反应,生成的化合物有
您最近一年使用:0次
20-21高一·全国·课时练习
6 . X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期?(填“是”或“否”)_______ ,理由是_______ ;
(2)Y是_______ ,Z是_______ ,W是_______ 。(填元素符号)
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1.写出该化合物的名称及化学式_______ 。
①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期?(填“是”或“否”)
(2)Y是
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1.写出该化合物的名称及化学式
您最近一年使用:0次
20-21高二上·上海·课时练习
解题方法
7 . 在表中用实线画出周期表的外框,写明族序数和周期序数,并在相应的空格内写出1~20号元素的元素符号,用虚线画出过渡元素外框___ 。


您最近一年使用:0次
20-21高二上·上海·课时练习
8 . 下表是元素周期表的一部分:
(1)最高价氧化物对应的水化物中,碱性最强的是_______ ,酸性最强的是_______ 。
(2)f、g和h的气态氢化物的稳定性由强到弱的顺序是_______ 。
(3)研究发现,在元素周期表中左上方与右下方相邻元素也存在某些性质的相似性,这一规律通常称对角线规则或对角线相似,则与c呈对角线相似的元素是铍,元素符号是“Be”,如:Be与Al一样,也能与NaOH溶液反应,反应的化学方程式是:Be+2NaOH→Na2BeO2+H2↑。请根据以上信息,结合已学知识,尝试写出Be的最高价氧化物对应水化物与NaOH溶液反应的离子方程式:_______ 。
| 周期/族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | a | |||||||
| 2 | d | e | h | |||||
| 3 | b | c | f | g |
(1)最高价氧化物对应的水化物中,碱性最强的是
(2)f、g和h的气态氢化物的稳定性由强到弱的顺序是
(3)研究发现,在元素周期表中左上方与右下方相邻元素也存在某些性质的相似性,这一规律通常称对角线规则或对角线相似,则与c呈对角线相似的元素是铍,元素符号是“Be”,如:Be与Al一样,也能与NaOH溶液反应,反应的化学方程式是:Be+2NaOH→Na2BeO2+H2↑。请根据以上信息,结合已学知识,尝试写出Be的最高价氧化物对应水化物与NaOH溶液反应的离子方程式:
您最近一年使用:0次
名校
9 . 已知A、B两种元素,A的原子序数为x,A和B所在周期的元素种类数目分别为m和n。
(1)如果A和B同在IA族,当B在A的上一周期时,B的原子序数为___________ ,当B在A的下一周期时,B的原子序数为___________ ;
(2)如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为___________ ;当B在A的下一周期时,B的原子序数为___________ 。
(1)如果A和B同在IA族,当B在A的上一周期时,B的原子序数为
(2)如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为
您最近一年使用:0次
2021-09-02更新
|
662次组卷
|
4卷引用:4.1.2 元素周期表 核素-2021-2022学年高一化学课后培优练(人教版2019必修第一册)
(已下线)4.1.2 元素周期表 核素-2021-2022学年高一化学课后培优练(人教版2019必修第一册)云南省曲靖市罗平县第二中学2019-2020学年高一下学期期中考试化学试题(已下线)5.1.2 元素周期表(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)海南省琼海市嘉积中学2023-2024学年高一上学期期末考试化学试题B卷
10 . 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,并回答下列问题:
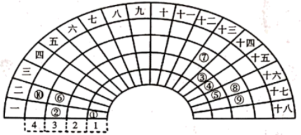
(1)元素②的名称为___________ ;元素⑩在常见周期表中的位置是___________ 。
(2)元素③、④、⑤形成的简单氢化物,稳定性最强的是___________ (填化学式,下同);元素④、⑧、⑨的最高价氧化物对应的水化物,酸性最强的是___________ 。
(3)元素⑥、⑦、⑧对应的简单离子的半径由大到小的顺序为___________ (用离子符号表示)。
(4)元素①、⑤和元素①、⑧均能形成18电子的化合物,这两种化合物发生反应的化学方程式为___________ 。
(5)请设计简单实验,比较元素②、⑦的金属性强弱。

(1)元素②的名称为
(2)元素③、④、⑤形成的简单氢化物,稳定性最强的是
(3)元素⑥、⑦、⑧对应的简单离子的半径由大到小的顺序为
(4)元素①、⑤和元素①、⑧均能形成18电子的化合物,这两种化合物发生反应的化学方程式为
(5)请设计简单实验,比较元素②、⑦的金属性强弱。
| 实验步骤 | 实验现象 | 实验结论 |
| 金属性:②>⑦ |
您最近一年使用:0次



