解题方法
1 . 下表是元素周期表的一部分,按要求完成各小题。
(1)元素①的原子结构示意图为_______ ,元素④的原子的电子式为_______ 。
(2)元素②的最简单氢化物的化学式为_______ , 该物质与O2完全燃烧时的化学反应方程式为_______ 。
(3)上述6种元素对应的化合物中,最高价氧化物对应水化物碱性最强的是_______ (填化学式),最高价氧化物对应水化物具有两性的是_______ (填化学式),两者发生反应的离子方程式为_______ 。
| ① | He | ||||||
| ② | ③ | Ne | |||||
| ④ | ⑤ | ⑥ | Ar |
(2)元素②的最简单氢化物的化学式为
(3)上述6种元素对应的化合物中,最高价氧化物对应水化物碱性最强的是
您最近一年使用:0次
2 . 下表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
(1)得电子能力最强的原子是___________ ;
(2)化学性质最不活泼的单质是___________ ﹔
(3)F与Cl相比,原子半径较大的是___________ ;
(4) 与
与 相比,热稳定性较强的是
相比,热稳定性较强的是___________ ﹔
(5)原子最外层电子数与最内层电子数相等的元素是___________ ﹔
(6)某阴离子的结构示意图为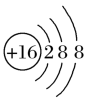 ,其离子符号是
,其离子符号是___________ ;
(7) 与
与 中,能与
中,能与 溶液反应的是
溶液反应的是___________ ﹔
(8)第三周期元素中能与冷水剧烈反应的金属单质是___________ ,写出该反应的化学方程式:___________ ;
(9)碳的一种氢化物结构式为 ,其分子式是
,其分子式是___________ ,其中碳元素与氢元素的质量比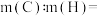
___________ ;(相对原子质量:C-12,H-1)
(10)下列各项性质的比较,符合相关性质递变规律的是___________(填标号 )。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | Ne | |||
| 3 | Na | Mg | Al | S | Cl |
(1)得电子能力最强的原子是
(2)化学性质最不活泼的单质是
(3)F与Cl相比,原子半径较大的是
(4)
 与
与 相比,热稳定性较强的是
相比,热稳定性较强的是(5)原子最外层电子数与最内层电子数相等的元素是
(6)某阴离子的结构示意图为
 ,其离子符号是
,其离子符号是(7)
 与
与 中,能与
中,能与 溶液反应的是
溶液反应的是(8)第三周期元素中能与冷水剧烈反应的金属单质是
(9)碳的一种氢化物结构式为
 ,其分子式是
,其分子式是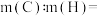
(10)下列各项性质的比较,符合相关性质递变规律的是___________(填
A.还原性: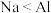 | B.非金属性: |
C.酸性: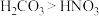 | D.碱性: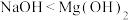 |
您最近一年使用:0次
3 . 氨硼烷(NH3BH3)含氢量高、热稳定性适中、释氢条件相对温和,是目前最具有潜力的固体储氢材料之一 。
(1)N在元素周期表中的位置是第___________ 周期、第VA族。
(2)写出N的最高价氧化物对应的水化物的化学式:___________ 。
(3)N的非金属性强于B的,用原子结构解释原因: N和B在同一周期,原子核外电子层数相同,___________ ,原子半径N小于B,得电子能力N强于B。
(4)在元素周期表中,砷(As)位于第4周期,与N同主族。下列关于 As的推断中,正确的是___________ (填字母)。
a.原子的最外层电子数为5
b.元素的非金属性: As>N
c.原子半径: As>N
(1)N在元素周期表中的位置是第
(2)写出N的最高价氧化物对应的水化物的化学式:
(3)N的非金属性强于B的,用原子结构解释原因: N和B在同一周期,原子核外电子层数相同,
(4)在元素周期表中,砷(As)位于第4周期,与N同主族。下列关于 As的推断中,正确的是
a.原子的最外层电子数为5
b.元素的非金属性: As>N
c.原子半径: As>N
您最近一年使用:0次
2021-12-25更新
|
328次组卷
|
2卷引用:2021年北京第二次普通高中学业水平合格性考试化学试题
名校
解题方法
4 . 下表为元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
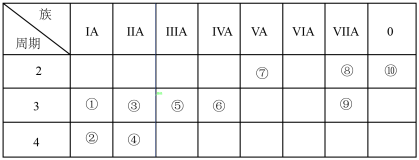
(1)③的原子结构示意图是___________ 。
(2)①~⑨中非金属性最强的元素是___________ (填化学式)。
(3)①和⑨两种元素组成的化合物中含有的化学键是___________ (填“共价键”或“离子键”)。
(4)①、⑤的最高价氧化物对应的水化物相互反应的离子方程式为___________ 。

(1)③的原子结构示意图是
(2)①~⑨中非金属性最强的元素是
(3)①和⑨两种元素组成的化合物中含有的化学键是
(4)①、⑤的最高价氧化物对应的水化物相互反应的离子方程式为
您最近一年使用:0次
解题方法
5 . 2020年有科学家通过观察金星的酸性云层,分析出金星存在磷化氢( )气体,从而推测金星可能存在生命的迹象。
)气体,从而推测金星可能存在生命的迹象。
(1)P在元素周期表中的位置是___________ 。
(2) 中P原子与H原子之间的相互作用是
中P原子与H原子之间的相互作用是___________ (填“离子键”或“共价键”)。
(3)非金属性S强于P,从原子结构解释原因,___________ ,得电子能力S大于P。
(4)下列关于N、P元素及化合物的说法正确的是___________ (填序号)。
①磷元素的最高正化合价为
②气态氢化物的稳定性: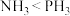
③磷的最高价氧化物对应的水化物属于酸
 )气体,从而推测金星可能存在生命的迹象。
)气体,从而推测金星可能存在生命的迹象。(1)P在元素周期表中的位置是
(2)
 中P原子与H原子之间的相互作用是
中P原子与H原子之间的相互作用是(3)非金属性S强于P,从原子结构解释原因,
(4)下列关于N、P元素及化合物的说法正确的是
①磷元素的最高正化合价为

②气态氢化物的稳定性:
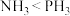
③磷的最高价氧化物对应的水化物属于酸
您最近一年使用:0次
6 . 元素周期表的建立是化学发展史上重要的里程碑之一,它揭示了元素之间的内在联系。如图是元素周期表的短周期示意图,相应方格中每个序号代表处于该位置的一种元素。
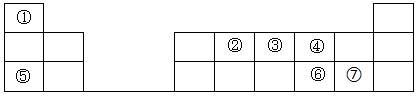
请回答下列问题:
(1)元素①的名称为___ 。
(2)元素③的最高价氧化物的水化物为___ (填化学式)
(3)⑥和⑦两种元素的气态氢化物中稳定性较强的是___ (填化学式)。
(4)②和④两种元素形成的常见气态化合物中化学键类型为___ 。
(5)⑤和⑦两种元素形成的化合物的电子式为___ 。

请回答下列问题:
(1)元素①的名称为
(2)元素③的最高价氧化物的水化物为
(3)⑥和⑦两种元素的气态氢化物中稳定性较强的是
(4)②和④两种元素形成的常见气态化合物中化学键类型为
(5)⑤和⑦两种元素形成的化合物的电子式为
您最近一年使用:0次
7 . 下表是元素周期表的一部分,请根据表中的信息回答下列问题:
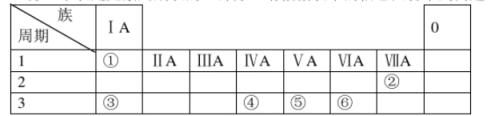
(1)元素①→⑥中金属性最强的是___________ (填元素符号)
(2)④⑤⑥三种元素分别对应的最高价氧化物的水化物酸性由强到弱的顺序是_______ (填化学式)
(3)比较②③的原子半径:②___________ ③(填>或<)
(4)元素周期律中某些区域的一些元素可用于制造半导体材料,这些元素常常位于周期表中______ 的分界线附近

(1)元素①→⑥中金属性最强的是
(2)④⑤⑥三种元素分别对应的最高价氧化物的水化物酸性由强到弱的顺序是
(3)比较②③的原子半径:②
(4)元素周期律中某些区域的一些元素可用于制造半导体材料,这些元素常常位于周期表中
您最近一年使用:0次
2021-05-25更新
|
434次组卷
|
2卷引用:山西省2020年普通高中学业水平考试化学试题
8 . 根据表格中关于四种元素的相关信息,按要求回答下列问题:
(1)完成表中空白:①_______ ②_______ ③_______ ④_______
(2)丁元素的最高价氧化物对应水化物的化学式为_______ ,其与丙元素的最高价氧化物对应水化物反应的离子方程式为_______ 。
(3)乙与丁两元素形成化合物的电子式为_______ 。
(4)甲元素的氢化物中最简单的是_______ (填化学式),该氢化物光照时可与氯气发生取代反应生成一氯代物,其化学方程式为_______ 。
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子序数 | 11 | ③ | ||
| 元素符号 | ① | Cl | ||
| 原子结构示意图 | ② | |||
| 位置 | 第二周期第ⅣA族 | 第三周期第ⅢA族 | ④ |
(1)完成表中空白:①
(2)丁元素的最高价氧化物对应水化物的化学式为
(3)乙与丁两元素形成化合物的电子式为
(4)甲元素的氢化物中最简单的是
您最近一年使用:0次
9 . 下表是元素周期表的一部分,根据表中给出10种元素(其中X、Y分别代表某种化学元素),按要求作答。
(1)X、Y两种元素符号分别是___________ 和___________ ;
(2)最外层电子数为4的原子,其元素符号是___________ ;
(3)某阴离子结构示意图为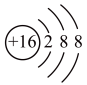 ,该离子符号是
,该离子符号是___________ ;
(4)C与N原子半径较小的是___________ ;
(5)保存在煤油中的金属是___________ ;
(6)化学性质最不活泼的单质是___________ ;
(7)HF与HCl热稳定性较强的是___________ ;
(8) 与
与 酸性较强的是
酸性较强的是___________ ;NaOH与 碱性较弱的是
碱性较弱的是___________ ;
(9)写出Y元素组成的单质与氧气反应的化学方程式:___________ 。
周期 族 | IA | IIA | ⅢA | IVA | VA | ⅥA | ⅦA | O |
| 2 | C | N | X | F | Ne | |||
| 3 | Na | Mg | Y | S | Cl |
(1)X、Y两种元素符号分别是
(2)最外层电子数为4的原子,其元素符号是
(3)某阴离子结构示意图为
 ,该离子符号是
,该离子符号是(4)C与N原子半径较小的是
(5)保存在煤油中的金属是
(6)化学性质最不活泼的单质是
(7)HF与HCl热稳定性较强的是
(8)
 与
与 酸性较强的是
酸性较强的是 碱性较弱的是
碱性较弱的是(9)写出Y元素组成的单质与氧气反应的化学方程式:
您最近一年使用:0次
解题方法
10 . 联合国大会将2019年定为“化学元素周期表国际年”,显示了元素周期表的重要性。下表列出了a-j 10种元素在周期表中的位置:
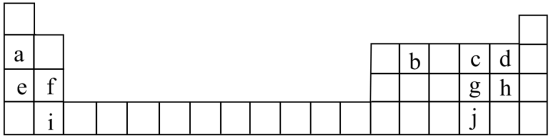
(1)元泰a的原于结构示意图为__________ 。
(2)元素b可以形成多种单质,写出其中的两种____________________ (填名称)。
(3)元素a~j中非金属性最强的是___________ (填元素符号)。
(4)若e单质着火,可用于灭火的物质是___________ (填字母)
A 自来水 B CO2. C 干沙子 D 湿抹布
(5)元素h和i形成的化合物中化学键的类型是___________ 键。h单质与NaOH溶液反应的离子方程式为____________ 。
(6)3位科学家因在基于a的电池研究方面的成就获得了2019年诺贝尔化学奖。基于e的电池也日益受到重视。下列关于a和e的说法正确的有___________ (填字母)。
A a的金属性比e弱 B 自然界中,e的储量比a高
B a的原子半径比e大 D 基于a的电池质量轻、易携带

(1)元泰a的原于结构示意图为
(2)元素b可以形成多种单质,写出其中的两种
(3)元素a~j中非金属性最强的是
(4)若e单质着火,可用于灭火的物质是
A 自来水 B CO2. C 干沙子 D 湿抹布
(5)元素h和i形成的化合物中化学键的类型是
(6)3位科学家因在基于a的电池研究方面的成就获得了2019年诺贝尔化学奖。基于e的电池也日益受到重视。下列关于a和e的说法正确的有
A a的金属性比e弱 B 自然界中,e的储量比a高
B a的原子半径比e大 D 基于a的电池质量轻、易携带
您最近一年使用:0次
2020-12-04更新
|
552次组卷
|
2卷引用:2020年7月广东省普通高中学业水平合格性考试化学试卷



