名校
解题方法
1 . 关于元素周期表的说法正确的是
| A.最外层电子数为2的原子都属于IIA族 | B.有3个短周期 |
| C.主族都有非金属元素 | D.IA族全部是金属元素 |
您最近一年使用:0次
2 . 2020年12月17日,我国“嫦娥五号”返回器携月壤成功着陆。根据已经发表的研究成果可知,月壤中存在天然的铁、金、银、铅、锌、铜、锑、铼等矿物颗粒。
(1)写出铜的基态原子的电子排布式___________ 。
(2)Fe在周期表中位于第___________ 周期第___________ 族,属于___________ 区。
(3)基态Fe原子有___________ 个未成对电子,Fe3+的电子排布式为___________ 。
(4)基态Al3+核外共有___________ 种不同运动状态的电子。
(5)采取的月壤中未发现钒(V)元素,其价层电子的轨道表示式为___________ 。钒(V)的某种氧化物的晶胞结构如图(1)所示。该晶体的化学式为___________ 。
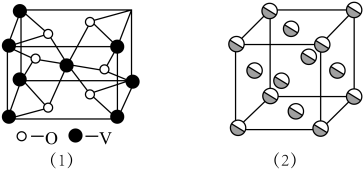
(6)金晶体的晶胞结构如图(2)所示。设金原子的直径为dcm,用NA表示阿伏加德罗常数,M表示金的摩尔质量,金的密度为___________ g/cm3(用d、M、NA表示)。
(1)写出铜的基态原子的电子排布式
(2)Fe在周期表中位于第
(3)基态Fe原子有
(4)基态Al3+核外共有
(5)采取的月壤中未发现钒(V)元素,其价层电子的轨道表示式为

(6)金晶体的晶胞结构如图(2)所示。设金原子的直径为dcm,用NA表示阿伏加德罗常数,M表示金的摩尔质量,金的密度为
您最近一年使用:0次
2023-07-12更新
|
97次组卷
|
2卷引用:甘肃省兰州市等5地2022-2023学年高二下学期期末化学试题
名校
解题方法
3 . 元素X、Y、Z在周期表中的相对位置如下所示,已知Y元素原子的外围电子排布为ns(n-1)np(n+1),则下列说法不正确的是
| X | ||
| Y | ||
| Z |
| A.X元素所在周期中所含非金属元素最多 |
| B.Y元素在周期表的第3周期第ⅥA族 |
| C.Z的电负性比X和Y都弱 |
| D.Z元素原子的核外电子排布简式为:[Ar]4s24p3 |
您最近一年使用:0次
名校
解题方法
4 . 下列说法正确的是
A. 和 和 中C、O、N杂化方式均相同 中C、O、N杂化方式均相同 |
B. 和 和 分子都是含极性键的极性分子 分子都是含极性键的极性分子 |
| C.最外层电子数为2的元素都分布在s区 |
| D.石墨晶体层内是共价键,层与层间是范德华力,所以石墨是一种过渡晶体 |
您最近一年使用:0次
解题方法
5 . 铁是一种重要的元素,在成人体中的含量达44~5g,铁的配合物在有机合成、催化等领域中发挥重要作用。
Ⅰ.Fe³⁺的配合物在溶液中呈现不同的颜色,如 呈淡紫色(稀溶液时为无色),
呈淡紫色(稀溶液时为无色),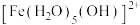 、
、 呈黄色。在黄色
呈黄色。在黄色 溶液中,加入稀
溶液中,加入稀 至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L
至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L NaCl溶液,溶液又变为黄色。
NaCl溶液,溶液又变为黄色。
(1)铁元素位于元素周期表的第___________ 周期第___________ 族。
(2) 中,中心离子为
中,中心离子为___________ ,配位原子是___________ ,配位数为___________ 。
(3)加入NaCl溶液后,溶液又变为黄色的原因:___________ (用离子方程式表示)。
Ⅱ. 不易被人体吸收,维生素C可帮助人体将
不易被人体吸收,维生素C可帮助人体将 转变为易吸收的
转变为易吸收的 。
。
(4)维生素C的分子结构如下图所示,分子中碳原子的杂化方式有___________ ;推测维生素C在水中的溶解性:___________ (填“难溶于水”或“易溶于水”)。
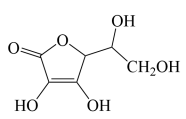
(5)根据维生素C的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。 (若不需要“可反应的试剂”,可对应填写“没有”)
②___________ 、___________ ;
③___________ 、___________ 、___________ 。
Ⅰ.Fe³⁺的配合物在溶液中呈现不同的颜色,如
 呈淡紫色(稀溶液时为无色),
呈淡紫色(稀溶液时为无色),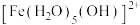 、
、 呈黄色。在黄色
呈黄色。在黄色 溶液中,加入稀
溶液中,加入稀 至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L
至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L NaCl溶液,溶液又变为黄色。
NaCl溶液,溶液又变为黄色。(1)铁元素位于元素周期表的第
(2)
 中,中心离子为
中,中心离子为(3)加入NaCl溶液后,溶液又变为黄色的原因:
Ⅱ.
 不易被人体吸收,维生素C可帮助人体将
不易被人体吸收,维生素C可帮助人体将 转变为易吸收的
转变为易吸收的 。
。(4)维生素C的分子结构如下图所示,分子中碳原子的杂化方式有

(5)根据维生素C的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。 (若不需要“可反应的试剂”,可对应填写“没有”)
| 序号 | 结构特征 | 可反应的试剂 | 反应类型 |
| ① | 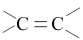 |  | 加成反应 |
| ② | 氧化反应 | ||
| ③ |
③
您最近一年使用:0次
解题方法
6 . 西汉长信宫灯通高48厘米,通体鎏金,是河北博物院收藏的珍贵文物。鎏金又称火法镀金,其工艺是将黄金溶于汞中形成的金汞齐均匀地涂到干净的金属器物表面,加热使汞挥发,黄金与金属表面固结,形成光亮的金黄色镀层。已知铜和金是第ⅠB族元素,汞是第ⅡB族元素。下列说法错误的是
| A.铜、金、汞均为ds区元素 |
| B.常温下的金汞齐是金属晶体 |
| C.应将宫灯保存在干燥的环境中 |
D.铜腐蚀后生成的 属于盐 属于盐 |
您最近一年使用:0次
解题方法
7 . 化学用语是化学科目中的基础性语言,下列化学用语的使用正确的是
A.丙炔的结构简式: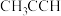 | B.葡萄糖的某种环状结构: |
| C.Cr位于元素周期表的ds区 | D. 分子的球棍模型: 分子的球棍模型: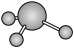 |
您最近一年使用:0次
2023-06-02更新
|
83次组卷
|
4卷引用:河南省驻马店市2022-2023学年高二下学期5月月考化学试题
名校
8 . 元素周期表和周期律体现了对元素的科学分类方法,以及结构决定性质的化学观念,下列说法正确的是
| A.门捷列夫编制的第一张元素周期表是按原子序数递增的顺序编排的 |
| B.在金属与非金属分界线附近可以寻找优良催化剂和耐高温的合金材料 |
| C.某元素的原子最外层只有一个电子,它跟卤素原子结合时,所形成的化学键一定是离子键 |
| D.化学键是相邻离子或原子间的一种强作用力,既包括静电吸引力,又包括静电排斥力 |
您最近一年使用:0次
9 . 人类赖以生存的大千世界是由众多物质组成的,而数量如此庞大的物质却仅由百余种化学元素组成。我们要探索元素性质的递变规律,理解原子是如何通过相互作用构建物质。
(1)下列说法不正确的是__________
(2)下列说法正确的是___________
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4,Ni(CO)4呈正四面体形,Ni(CO)4易溶于下列物质中的__________
(4)氯原子最外层电子的原子轨道有___________ 种不同的伸展方向。
(5)写出与氯同周期,有3个未成对电子的基态原子的价电子轨道表示式为:___________ 。
(6)元素周期表中与氧元素相邻,且第一电离能比氧大的元素是___________ (填元素符号),它们与氧元素电负性由大到小的顺序为___________ 。
(7)根据价层电子对互斥理论判断下列问题:H2S中心原子的杂化方式为___________ 杂化,VSEPR构型为___________ ,分子的立体构型为___________ 。
(8)海洋元素中的氯、溴、碘统称为海水中的卤素资源,它们的化学性质既有相似性,也体现其递变性,用原子结构理论解释原因___________ 。
(1)下列说法不正确的是__________
A. 键是原子轨道以“肩并肩”方式相互重叠而形成的 键是原子轨道以“肩并肩”方式相互重叠而形成的 |
B.2个原子形成的多重共价键中,只能有一个是 键,而 键,而 键可以是一个或多个 键可以是一个或多个 |
C.s电子与s电子间形成的键是 键,p电子与p电子间形成的键是 键,p电子与p电子间形成的键是 键 键 |
| D.共价键一定有原子轨道的重叠 |
| A.氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少 |
| B.最外层电子数为ns2的元素都在元素周期表第2列 |
C.处于最低能量的原子叫做基态原子,1s22s22p →1s22s22p →1s22s22p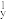 过程中形成的是发射光谱 过程中形成的是发射光谱 |
| D.已知某元素+3价基态离子的核外电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期ⅥB族位置,属于d区 |
| A.水 | B.CCl4 | C.苯 | D.NiSO4溶液 |
(5)写出与氯同周期,有3个未成对电子的基态原子的价电子轨道表示式为:
(6)元素周期表中与氧元素相邻,且第一电离能比氧大的元素是
(7)根据价层电子对互斥理论判断下列问题:H2S中心原子的杂化方式为
(8)海洋元素中的氯、溴、碘统称为海水中的卤素资源,它们的化学性质既有相似性,也体现其递变性,用原子结构理论解释原因
您最近一年使用:0次
10 . 化学与生活密切相关。下列叙述正确的是
| A.冬奥场馆建筑应用了新材料碲化镉发电玻璃,碲和镉均属于过渡元素 |
| B.“天宫课堂”实验:常温下乙酸钠过饱和溶液结晶成温热“冰球”的过程属于吸热反应 |
| C.食品包装袋中常用的干燥剂有生石灰、还原铁粉、硅胶等 |
| D.干冰可用在舞台上制造“云雾” |
您最近一年使用:0次



