1 . 下表是元素周期表中主族的一部分,其中c是地壳中含量最多的元素,回答下列问题:__________ , 的结构式为
的结构式为___________ 。
(2)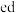 为
为__________ (填“离子”或“共价”)化合物,能证明该结论的实验依据为___________ .
(3)用电子式表示物质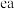 的形成过程
的形成过程__________________ ,该物质能与 反应生成
反应生成 ,反应中
,反应中 作
作________ 剂。
(4) 最高价氧化物水化物的碱性由强到弱的顺序为
最高价氧化物水化物的碱性由强到弱的顺序为_________ (用化学式表示)。
(5)若 均为上述元素形成的10电子微粒,相互之间能发生离子反应:
均为上述元素形成的10电子微粒,相互之间能发生离子反应: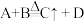 ,写出该反应的离子方程式
,写出该反应的离子方程式____________________ 。
(6)下列有关说法正确的是__________ 。
A.a和e最外层电子数相同,均为碱金属元素 B.考古时利用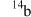 测定一些文物的年代
测定一些文物的年代
C.科学家常在 等元素区域寻找新型农药
等元素区域寻找新型农药
D.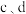 形成阴离子时,c原子得到的电子更多,所以非金属性
形成阴离子时,c原子得到的电子更多,所以非金属性
 的结构式为
的结构式为(2)
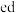 为
为(3)用电子式表示物质
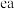 的形成过程
的形成过程 反应生成
反应生成 ,反应中
,反应中 作
作(4)
 最高价氧化物水化物的碱性由强到弱的顺序为
最高价氧化物水化物的碱性由强到弱的顺序为(5)若
 均为上述元素形成的10电子微粒,相互之间能发生离子反应:
均为上述元素形成的10电子微粒,相互之间能发生离子反应: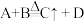 ,写出该反应的离子方程式
,写出该反应的离子方程式(6)下列有关说法正确的是
A.a和e最外层电子数相同,均为碱金属元素 B.考古时利用
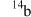 测定一些文物的年代
测定一些文物的年代C.科学家常在
 等元素区域寻找新型农药
等元素区域寻找新型农药D.
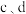 形成阴离子时,c原子得到的电子更多,所以非金属性
形成阴离子时,c原子得到的电子更多,所以非金属性
您最近一年使用:0次
名校
解题方法
2 . 完成下列问题
(1)S和Cl元素的非金属性更强的是___________ ,能证明该结论的实验事实___________ 。
(2)从结构角度解释S和Cl元素非金属性强弱的原因:___________ 。
(1)S和Cl元素的非金属性更强的是
(2)从结构角度解释S和Cl元素非金属性强弱的原因:
您最近一年使用:0次
名校
3 . 下列叙述正确的是
①A和B都是元素周期表的主族金属元素,A在B的左下方,则A肯定比B的金属性强②1molA能从酸中置换出1.5molH2,1molB能从酸中置换出1molH2,可以证明A比B的金属性强③Fe(OH)2比Mg(OH)2碱性弱,则可以得到Fe比Mg的金属性弱④H2S比HBr的酸性弱,证明Br比S的非金属性强⑤Na2S+Br2=2NaBr+S,足以证明非金属性Br>S⑥单质A比单质B的熔沸点高,可以证明A比B的非金属性弱
①A和B都是元素周期表的主族金属元素,A在B的左下方,则A肯定比B的金属性强②1molA能从酸中置换出1.5molH2,1molB能从酸中置换出1molH2,可以证明A比B的金属性强③Fe(OH)2比Mg(OH)2碱性弱,则可以得到Fe比Mg的金属性弱④H2S比HBr的酸性弱,证明Br比S的非金属性强⑤Na2S+Br2=2NaBr+S,足以证明非金属性Br>S⑥单质A比单质B的熔沸点高,可以证明A比B的非金属性弱
| A.①②④⑥ | B.①⑤ | C.②③⑤ | D.②③④⑥ |
您最近一年使用:0次
名校
4 . 根据实验操作和现象,能达到实验目的的是
| 选项 | 实验操作和现象 | 实验目的 |
| A | 将乙烯和甲烷混合气体通入盛有酸性高锰酸钾溶液的洗气瓶中,溶液紫色变浅 | 除去甲烷中的乙烯 |
| B | 分别向MgCl2溶液和AlCl3溶液中滴加NaOH溶液至过量。MgCl2溶液产生白色沉淀,沉淀不溶解;AlCl3溶液产生的白色沉淀溶解。 | 证明金属性Mg>Al |
| C | 向亚硫酸钠溶液中滴加足量盐酸,将反应产生的气体通入品红溶液,品红溶液褪色 | 证明氯的得电子能力比硫强 |
| D | 向KI溶液中先滴加少量溴水,然后加入四氯化碳,充分振荡静置,溶液分层,上层呈紫红色,下层近乎无色。 | 证明氧化性:Br2>I2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 针对表中10种元素及由这些元素形成的单质和化合物,完成以下问题。
(1)最活泼的金属元素是_______ (填元素符号),酸性最强的最高价氧化物对应水化物是______ (填化学式)。
(2)用电子式表示⑤和⑨两种元素组成的化合物的形成过程___________ 。
(3)③④⑤⑧的简单离子半径由大到小的顺序为___________ (填离子符号)。
(4)非金属性①_____ ⑧(填“>”或“<”),请设计实验证明_________ (用化学方程式表示)。
(5)写出元素⑥的单质与元素④最高价氧化物对应水化物反应的化学方程式___________ 。
(6)能够比较元素⑧与⑨的非金属性强弱的依据是___________ (填序号)。
a.氢化物酸性:⑧弱于⑨ b.⑨单质能与⑧氢化物成应得到⑧单质
c.单质与 反应:⑨比⑧容易 d.含氧酸的酸性; ⑨强于⑧
反应:⑨比⑧容易 d.含氧酸的酸性; ⑨强于⑧
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
(1)最活泼的金属元素是
(2)用电子式表示⑤和⑨两种元素组成的化合物的形成过程
(3)③④⑤⑧的简单离子半径由大到小的顺序为
(4)非金属性①
(5)写出元素⑥的单质与元素④最高价氧化物对应水化物反应的化学方程式
(6)能够比较元素⑧与⑨的非金属性强弱的依据是
a.氢化物酸性:⑧弱于⑨ b.⑨单质能与⑧氢化物成应得到⑧单质
c.单质与
 反应:⑨比⑧容易 d.含氧酸的酸性; ⑨强于⑧
反应:⑨比⑧容易 d.含氧酸的酸性; ⑨强于⑧
您最近一年使用:0次
名校
6 . 元素周期表的表达形式有多种,但都能表示出元素的周期性变化规律,请回答下列问题:
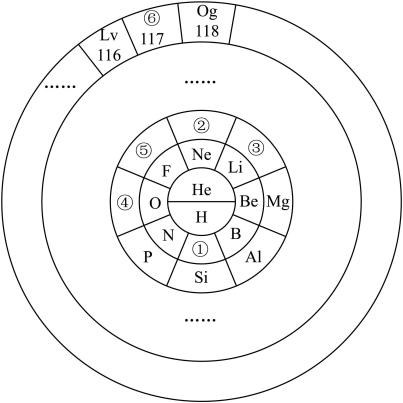
(1)①与④元素形成的化合物属于___________ 晶体。
(2)写出③的最高价氧化物对应水化物和Al的最高价氧化物的水化物相互反应的离子方程式:__________ 。
(3)②号元素为___________ (填元素符号)。请写出1个与②核外电子数相同的简单离子组成的化合物的化学式:___________ 。其中存在的化学键属于___________ 键,该物质在熔融状态下___________ 导电(填“能”或“不能”)。
(4)⑤的单质具有较强的氧化性,能与大多数金属发生反应,请写出⑤的单质与过量的铁粉反应的化学方程式:___________ ,将反应所得混合物溶于水,得到浅绿色的溶液,请写出相关的离子方程式:___________ 。
(5)其中非金属性④___________ ⑤(填“>”或“<”),请用一个化学方程式证明___________ 。
(6)⑥(原子序数117)的单质是一种具有放射性的卤族元素,它在元素周期表中的位置为___________ ,根据元素的周期性规律,以下推测正确的是________
A.单质在常温下为气体 B.气态氢化物的稳定性较好
C.离子具有强还原性 D.半径大于⑤

(1)①与④元素形成的化合物属于
(2)写出③的最高价氧化物对应水化物和Al的最高价氧化物的水化物相互反应的离子方程式:
(3)②号元素为
(4)⑤的单质具有较强的氧化性,能与大多数金属发生反应,请写出⑤的单质与过量的铁粉反应的化学方程式:
(5)其中非金属性④
(6)⑥(原子序数117)的单质是一种具有放射性的卤族元素,它在元素周期表中的位置为
A.单质在常温下为气体 B.气态氢化物的稳定性较好
C.离子具有强还原性 D.半径大于⑤
您最近一年使用:0次
名校
解题方法
7 . 如表为元素周期表的一部分,请参照元素在表中①-⑩的位置,用相应的化学用语回答下列问题:
(1)形成化合物种类最多的元素在周期表中的位置是_______ 。
(2)元素⑦的简单离子结构示意图为______ 。
(3)元素④、⑤、⑨形成的简单氢化物稳定性由弱到强的顺序为______ (用化学式作答,下同)。元素③、⑧、⑩形成的最高价氧化物对应的水化物的酸性由强到弱的顺序为______ 。
(4)10种元素中,金属性最强的是______ (填序号),该元素与④形成的含有非极性共价键的化合物的电子式为______ 。
(5)元素②的单质和元素⑨的最高价氧化物对应的水化物反应的化学方程式为______ 。某同学为检验气体产物设计了如图的实验装置,据此回答问题:
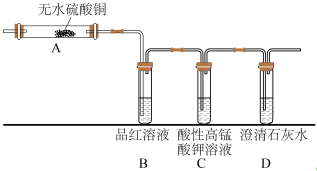
①B中的实验现象是______ ,证明产物中有______ 。
②装置C的作用是______ ,发生的化学反应方程式为______ 。
(6)下列事实能说明⑩元素原子得电子能力比⑨元素原子强的是______ (填序号)。
①氢化物的溶解度:⑩>⑨
②氢化物的酸性:⑩>⑨
③氢化物的稳定性:⑩>⑨
④氢化物的还原性:⑩<⑨
⑤最高价氧化物对应的水化物的酸性:⑩>⑨
⑥单质的氧化性:⑩>⑨
⑦对应阴离子的还原性:⑩<⑨
⑧单质⑩通入⑨的氢化物水溶液中可生成单质⑨
⑨在周期表中⑩处于⑨同周期的右侧
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(2)元素⑦的简单离子结构示意图为
(3)元素④、⑤、⑨形成的简单氢化物稳定性由弱到强的顺序为
(4)10种元素中,金属性最强的是
(5)元素②的单质和元素⑨的最高价氧化物对应的水化物反应的化学方程式为

①B中的实验现象是
②装置C的作用是
(6)下列事实能说明⑩元素原子得电子能力比⑨元素原子强的是
①氢化物的溶解度:⑩>⑨
②氢化物的酸性:⑩>⑨
③氢化物的稳定性:⑩>⑨
④氢化物的还原性:⑩<⑨
⑤最高价氧化物对应的水化物的酸性:⑩>⑨
⑥单质的氧化性:⑩>⑨
⑦对应阴离子的还原性:⑩<⑨
⑧单质⑩通入⑨的氢化物水溶液中可生成单质⑨
⑨在周期表中⑩处于⑨同周期的右侧
您最近一年使用:0次
8 . 如图是元素周期表的一部分,回答下列问题。
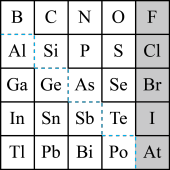
(1)元素 在元素周期表中的位置为
在元素周期表中的位置为_______ (写明周期数和族序数)。
(2) 的最高正价为
的最高正价为_______ , 的最高价氧化物为
的最高价氧化物为_______ (填化学式)。
(3)根据元素周期律推断:
①阴影部分元素最容易与氢气化合的是_______ (填元素符号)。
②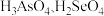 的酸性强弱:
的酸性强弱:
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③氢化物的还原性:
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找_______(填序号)。
(5)① 常用作溶剂,其电子式为
常用作溶剂,其电子式为_______ 。
②镓( )的化合物氮化镓(
)的化合物氮化镓( )和砷化镓(
)和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是_______ (填序号)。
A.原子半径: B.N的非金属性比O强
B.N的非金属性比O强
C. 的金属性比
的金属性比 弱 D.
弱 D. 和
和 的氧化物可能是两性氧化物
的氧化物可能是两性氧化物
(6)用如图装置证明酸性: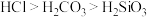 ,则溶液b为
,则溶液b为_______ 。下列事实可用于比较元素C与 非金属性相对强弱的是
非金属性相对强弱的是_______ (填序号)。
A.最高正化合价
B. 的氢化物比C的简单氢化物稳定
的氢化物比C的简单氢化物稳定
C. 的氢化物比C的简单氢化物沸点高
的氢化物比C的简单氢化物沸点高
D.最高价氧化物对应的水化物的酸性: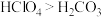

(1)元素
 在元素周期表中的位置为
在元素周期表中的位置为(2)
 的最高正价为
的最高正价为 的最高价氧化物为
的最高价氧化物为(3)根据元素周期律推断:
①阴影部分元素最容易与氢气化合的是
②
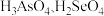 的酸性强弱:
的酸性强弱:
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③氢化物的还原性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)可在图中分界线(虚线部分)附近寻找_______(填序号)。
| A.农药 | B.合金材料 | C.半导体材料 | D.优良的催化剂 |
 常用作溶剂,其电子式为
常用作溶剂,其电子式为②镓(
 )的化合物氮化镓(
)的化合物氮化镓( )和砷化镓(
)和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是A.原子半径:
 B.N的非金属性比O强
B.N的非金属性比O强C.
 的金属性比
的金属性比 弱 D.
弱 D. 和
和 的氧化物可能是两性氧化物
的氧化物可能是两性氧化物(6)用如图装置证明酸性:
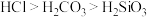 ,则溶液b为
,则溶液b为 非金属性相对强弱的是
非金属性相对强弱的是
A.最高正化合价

B.
 的氢化物比C的简单氢化物稳定
的氢化物比C的简单氢化物稳定C.
 的氢化物比C的简单氢化物沸点高
的氢化物比C的简单氢化物沸点高D.最高价氧化物对应的水化物的酸性:
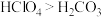
您最近一年使用:0次
名校
解题方法
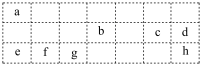
9 . 下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。

回答下列问题:
(1)由c、d、e三元素形成的化合物中含有的化学键类型为_______ 。
(2)元素e、f的最高价氧化物对应水化物之间能发生反应,其离子方程式为_______ 。
(3)下列能证明非金属性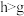 的是
的是_______ 。
a.简单气态氢化物的沸点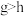
b.简单气态氢化物水溶液的酸性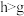
c.单质分别与铜反应,h得到铜的高价态化合物,g得到铜的低价态化合物
d.简单气态氢化物还原性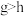
(4)元素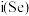 是人体必需的微量元素,h和i的最高价氧化物对应水化物的酸性由强到弱的顺序
是人体必需的微量元素,h和i的最高价氧化物对应水化物的酸性由强到弱的顺序_______ (用化学式表示)。 与足量e的最高价氧化物的水化物反应的化学方程式为
与足量e的最高价氧化物的水化物反应的化学方程式为_______ 。
(5) 可与c的简单气态氢化物反应得到单质
可与c的简单气态氢化物反应得到单质 ,反应的化学方程式是
,反应的化学方程式是_______ 。

回答下列问题:
(1)由c、d、e三元素形成的化合物中含有的化学键类型为
(2)元素e、f的最高价氧化物对应水化物之间能发生反应,其离子方程式为
(3)下列能证明非金属性
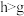 的是
的是a.简单气态氢化物的沸点
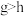
b.简单气态氢化物水溶液的酸性
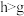
c.单质分别与铜反应,h得到铜的高价态化合物,g得到铜的低价态化合物
d.简单气态氢化物还原性
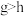
(4)元素
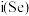 是人体必需的微量元素,h和i的最高价氧化物对应水化物的酸性由强到弱的顺序
是人体必需的微量元素,h和i的最高价氧化物对应水化物的酸性由强到弱的顺序 与足量e的最高价氧化物的水化物反应的化学方程式为
与足量e的最高价氧化物的水化物反应的化学方程式为(5)
 可与c的简单气态氢化物反应得到单质
可与c的简单气态氢化物反应得到单质 ,反应的化学方程式是
,反应的化学方程式是
您最近一年使用:0次
2022-04-28更新
|
270次组卷
|
5卷引用:山东省菏泽市2021-2022学年高一下学期期中考试化学试题(A)
解题方法
10 . X、Y、Z、W、T是原子序数依次增大的五种短周期元素,其中X元素的一种原子中没有中子,Y的一种单质是自然界中最坚硬的物质,Z原子的最外层电子比次外层电子多3个,W与Y同主族,T单质与NaOH溶液反应的产物能杀菌消毒。
(1)X与Y形成的最简单化合物的结构式为___________ 。
(2)Z的最高价氧化对应水化物的稀溶液与铜反应的离子方程式为___________ 。
(3)T单质与NaOH溶液反应的产物中,有杀菌消毒作用的物质为___________ (填化学式)。
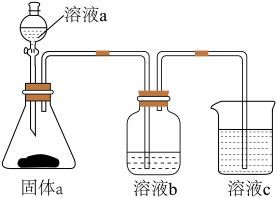
(4)利用下图装置可以验证Y、Z、W三种元素性质的递变规律。则:
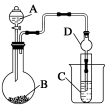
仪器A的名称为___________ ,干燥管D的作用是___________ 。若要证明非金属性:Z>Y>W,则A中应加___________ ,B中应加Na2CO3,C中应加___________ ,观察到C中溶液的现象为___________ 。
(1)X与Y形成的最简单化合物的结构式为
(2)Z的最高价氧化对应水化物的稀溶液与铜反应的离子方程式为
(3)T单质与NaOH溶液反应的产物中,有杀菌消毒作用的物质为
(4)利用下图装置可以验证Y、Z、W三种元素性质的递变规律。则:

仪器A的名称为
您最近一年使用:0次



