名校
解题方法
1 . I.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。
(1)In在周期表中的位置是___ 。
(2)In的最高价氧化物的水化物的碱性___ Ba(OH)2的碱性(填“>”或“<”)。
(3) In的中子数与电子数的差值为
In的中子数与电子数的差值为___ 。
II.A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
C.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(4)C-的电子式:___ 。
(5)A+、B2-、F3+离子半径由大到小的顺序为___ (用离子符号表示)。
(6)电子式表示A2B的形成过程___ 。
(7)含F3+的溶液中通入过量D,反应的离子方程式是___ 。
(8)A单质与E反应的离子方程式为___ ,生成的化合物中化学键的类型是___ 。
III.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(9)Se原子结构示意图可表示为___ 。
(10)下列说法合理的是___ 。
a.SeO2既有氧化性又有还原性
b.浓硒酸可能具有强氧化性、脱水性
c.热稳定性:H2Se<HCl<H2S
d.酸性:H2SeO4<HBrO4<HClO4
(1)In在周期表中的位置是
(2)In的最高价氧化物的水化物的碱性
(3)
 In的中子数与电子数的差值为
In的中子数与电子数的差值为II.A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
C.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(4)C-的电子式:
(5)A+、B2-、F3+离子半径由大到小的顺序为
(6)电子式表示A2B的形成过程
(7)含F3+的溶液中通入过量D,反应的离子方程式是
(8)A单质与E反应的离子方程式为
III.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(9)Se原子结构示意图可表示为
(10)下列说法合理的是
a.SeO2既有氧化性又有还原性
b.浓硒酸可能具有强氧化性、脱水性
c.热稳定性:H2Se<HCl<H2S
d.酸性:H2SeO4<HBrO4<HClO4
您最近一年使用:0次
名校
2 . 下图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍。请回答下列问题:
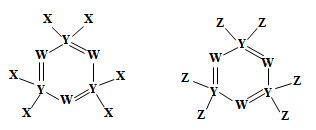
(1)元素Y在周期表中的位置为___________ ,元素Z的最高价氧化物的水化物的化学式为_____ 。
(2)元素W、X、Y、Z的简单阴离子半径由大到小的顺序为_____ 。
(3)Z、W和氢三种元素形成的同时含有离子键和共价键化合物的电子式为_____ 。
(4)研究Y、Z非金属性强弱的方案中不可行的是___________(填序号)。
(5)许多含元素Z的化合物均可作为杀菌消毒剂,将ZO2通入到NaOH和H2O2混合溶液中,可制备NaZO2。
查阅资料:NaZO2晶体易溶于水,难溶于乙醇。NaZO2饱和溶液在温度低于38 ℃时析出NaZO2·3H2O晶体,高于38 ℃时析出NaZO2晶体,高于60 ℃时NaZO2分解成NaZO3和NaZ。
①写出由ZO2制备NaZO2的离子方程式_____ 。
②从上述NaZO2溶液获得干燥的NaZO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后,___________ ,___________ ,低于60℃干燥,得到NaZO2晶体 (补全实验步骤)。

(1)元素Y在周期表中的位置为
(2)元素W、X、Y、Z的简单阴离子半径由大到小的顺序为
(3)Z、W和氢三种元素形成的同时含有离子键和共价键化合物的电子式为
(4)研究Y、Z非金属性强弱的方案中不可行的是___________(填序号)。
| A.比较其简单氢化物的沸点 | B.比较其单质与氢气反应的难易程度 |
| C.比较其简单阴离子的还原性 | D.比较其氧化物的水化物的酸性 |
查阅资料:NaZO2晶体易溶于水,难溶于乙醇。NaZO2饱和溶液在温度低于38 ℃时析出NaZO2·3H2O晶体,高于38 ℃时析出NaZO2晶体,高于60 ℃时NaZO2分解成NaZO3和NaZ。
①写出由ZO2制备NaZO2的离子方程式
②从上述NaZO2溶液获得干燥的NaZO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后,
您最近一年使用:0次
解题方法
3 . 已知短周期元素 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示:
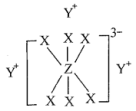
回答下列问题:
(1) 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是___________ ,写出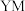 的电子式:
的电子式:___________ 。
(2) 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)在 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:___________ 。
(4)镓 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是___________ 。
a. 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族
b. 为新型无机非金属材料
为新型无机非金属材料
c. 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为___________ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
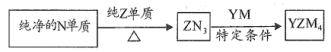
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
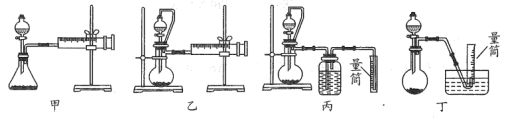
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品 ,若实验测得氢气的体积为
,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为___________ (用代数式表示)。
 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示: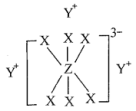
回答下列问题:
(1)
 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是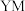 的电子式:
的电子式:(2)
 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):(3)在
 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓
 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓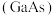 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。①下列有关说法正确的是
a.
 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族b.
 为新型无机非金属材料
为新型无机非金属材料c.
 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强d.酸性:

②废弃的含
 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品
 ,若实验测得氢气的体积为
,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为
您最近一年使用:0次
名校
4 . Na、Mg、S、Cl是第三周期的四种元素,下列判断错误的是( )
| A.碱性NaOH>Mg(OH)2 |
| B.原子半径r(Mg)<r(S) |
| C.离子半径r(Na+)>r(Mg2+) |
| D.氧化性Cl2>S |
您最近一年使用:0次
2019-01-30更新
|
496次组卷
|
4卷引用:【区级联考】上海市青浦区2019届高三上学期期末学业质量调研化学试题
【区级联考】上海市青浦区2019届高三上学期期末学业质量调研化学试题上海市青浦区2019届高三第一学期一模试卷化学试题(已下线)模块六 物质结构与元素周期律(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)【全国百强校】河北省辛集中学2018-2019学年高一下学期第一次阶段考试化学试题
5 . 短周期元素a、b、c、d、e 的原子序数依次增大,由它们形成的化合物X、Y、Z、W 在一定条件下的相互转化关系如图所示。已知X、Y、Z均含有d元素;X的焰色反应呈黄色;Y是两性氢氧化物;0.1mol·L-1W溶液的pH为1。下列说法正确的是

| A.e元素的含氧酸的酸性在同主族中最强 |
| B.b元素的单质和氢化物可能具有氧化性和漂白性 |
| C.c与e和a与e元素形成的化合物均属于电解质且化学键类型相同 |
| D.b、c、d元素的离子半径大小顺序是b |
您最近一年使用:0次
真题
解题方法
6 . 氮和氧是构建化合物的常见元素。
(1)某化合物的晶胞如图,其化学式是_______ ,晶体类型是_______ 。
(2)下列说法正确的是_______。
(3)① ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为_______ ;比较键角 中的
中的
_______  中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由_______ 。
②将 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
_______  (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式_______ 。
已知: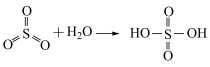
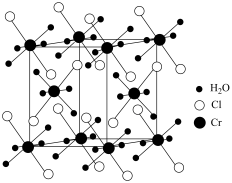
(1)某化合物的晶胞如图,其化学式是
(2)下列说法正确的是_______。
A.电负性: | B.离子半径: |
C.第一电离能: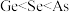 | D.基态 2+的简化电子排布式: 2+的简化电子排布式: |
(3)①
 ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为 中的
中的
 中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由②将
 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
 (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式
您最近一年使用:0次
名校
解题方法
7 . 日光灯中用到的某种荧光粉的主要成分为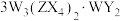 。已知:
。已知: 、
、 、
、 和
和 为原子序数依次增大的前20号元素,
为原子序数依次增大的前20号元素, 为金属元素,基态
为金属元素,基态 原子
原子 轨道上的电子数和
轨道上的电子数和 轨道上的电子数相等,基态
轨道上的电子数相等,基态 、
、 、
、 原子的未成对电子数之比为
原子的未成对电子数之比为 。下列说法正确的是
。下列说法正确的是
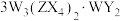 。已知:
。已知: 、
、 、
、 和
和 为原子序数依次增大的前20号元素,
为原子序数依次增大的前20号元素, 为金属元素,基态
为金属元素,基态 原子
原子 轨道上的电子数和
轨道上的电子数和 轨道上的电子数相等,基态
轨道上的电子数相等,基态 、
、 、
、 原子的未成对电子数之比为
原子的未成对电子数之比为 。下列说法正确的是
。下列说法正确的是A.原子半径: | B. 元素最高价化物对应的水化物具有强氧化性 元素最高价化物对应的水化物具有强氧化性 |
C.电负性: | D.能与水反应生成气体的单质只有 的单质 的单质 |
您最近一年使用:0次
8 . 短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们中的两种或三种形成的化合物,且A、B、C均含有Z元素。A的焰色试验呈黄色,水溶液呈碱性;B是两性氢氧化物;D是由W与Q形成的化合物,常温下 溶液的pH为1,在一定条件下它们之间的相互转化关系如图所示。下列说法正确的是
溶液的pH为1,在一定条件下它们之间的相互转化关系如图所示。下列说法正确的是
 溶液的pH为1,在一定条件下它们之间的相互转化关系如图所示。下列说法正确的是
溶液的pH为1,在一定条件下它们之间的相互转化关系如图所示。下列说法正确的是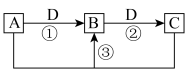
| A.X元素的单质可能含有极性键,氢化物可能含有非极性键 |
| B.X、Y、Z元素的离子半径大小是X<Y<Z |
| C.Y与Q和W与Q元素形成的化合物均属于电解质且化学键类型相同 |
| D.Q元素的含氧酸的酸性在同主族中最强 |
您最近一年使用:0次
名校
解题方法
9 . 某化合物(结构如图所示)可用作酿造酵母的培养剂、强化剂、膨松剂、发酵助剂。已知X、Y、Z、W为元素周期表中前20号元素且位于不同周期,原子序数依次增大,Y为地壳中含量最高的元素。下列有关说法正确的是


| A.单质的氧化性:Z>Y>X |
| B.同周期中第一电离能比Z小的元素只有4种 |
| C.简单离子半径:Z>Y>W |
| D.X与Z形成的最简单化合物的沸点比X与Y形成的最简单化合物的沸点高 |
您最近一年使用:0次
名校
解题方法
10 . 短周期元素X、Y、Z、W是同周期主族元素,W元素形成的某种单质具有强氧化性,可用于杀菌消毒。四种元素与锂组成的盐是一种新型的锂离子电池的电解质,结构如图所示(→表示配位键),下列说法正确的是


| A.原子半径:X>Y> Z> W |
| B.图中阴离子部分中四种元素均满足8电子稳定结构 |
| C.单质氧化性:W2> X2 |
| D.Y的最高价氧化物的水化物为强酸 |
您最近一年使用:0次



