1 . X、Y为第三周期元素、Y最高正价与最低负价的代数和为6,二者形成的一种化合物能以[XY4]+[XY6]-的形式存在。下列说法错误的是
| A.原子半径:X>Y | B.简单氢化物的还原性:X>Y |
| C.同周期元素形成的单质中Y氧化性最强 | D.同周期中第一电离能小于X的元素有4种 |
您最近一年使用:0次
2021-06-29更新
|
13009次组卷
|
35卷引用:天津市第四十七中学2022—2023学年高三上学期期末 阶段性学习检测化学试题
天津市第四十七中学2022—2023学年高三上学期期末 阶段性学习检测化学试题天津市第四十七中学2022-2023学年高三上学期期末考试化学试题2021年新高考山东化学高考真题(已下线)课时25 原子结构-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第36讲 原子结构与性质(精练)-2022年一轮复习讲练测(已下线)专题06 物质结构 元素周期律-备战2022年高考化学真题及地市好题专项集训【山东专用】江苏省如皋中学2021-2022学年高三上学期第一次阶段考试化学试题辽宁省渤海大学附属高级中学2021-2022学年高三上学期第二次月考化学试题辽宁省沈阳市第一二〇中学2021-2022学年高二上学期期中考试化学试题2021年湖北高考化学试题变式题11-192021年山东高考化学试题变式题1-10福建省福州第三中学2021-2022学年高三上学期第五次质量检测化学试题(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)浙江省温州新力量联盟2021-2022学年高二下学期期末联考化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)北京市清华大学附属中学2022-2023学年高三9月月考化学试题四川省遂宁市射洪中学2022-2023学年高二上学期第一次月考(10月)化学试题湖南省长沙市卓华高级中学2021-2022学年高二下学期期末考试化学试题四川省内江市第六中学2022-2023学年高二上学期期中考试化学试题四川省遂宁中学校2022-2023学年高二上学期期中考试化学试题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第五章 物质结构与性质 元素周期律 第27讲 元素周期表和元素周期律湖北省武汉市洪山高级中学2022-2023学年高二下学期2月考试化学试题安徽省安庆市第一中学2022-2023学年高二下学期第一次月考化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二下学期第一次验收考试化学试题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题1-5)(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
2 . 短周期元素a、b、c、d、e 的原子序数依次增大,由它们形成的化合物X、Y、Z、W 在一定条件下的相互转化关系如图所示。已知X、Y、Z均含有d元素;X的焰色反应呈黄色;Y是两性氢氧化物;0.1mol·L-1W溶液的pH为1。下列说法正确的是


| A.e元素的含氧酸的酸性在同主族中最强 |
| B.b元素的单质和氢化物可能具有氧化性和漂白性 |
| C.c与e和a与e元素形成的化合物均属于电解质且化学键类型相同 |
| D.b、c、d元素的离子半径大小顺序是 c>d>b |
您最近一年使用:0次
3 . 常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01mol·L-1)的pH和原子半径、原子序数的关系如图所示。下列说法错误的是
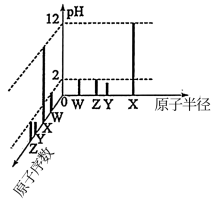

| A.非金属性:Z>W>Y>X |
| B.简单离子的半径:Y>Z>W>X |
| C.W的氢化物空间构型不一定是三角锥形 |
| D.Z的单质具有强氧化性和漂白性 |
您最近一年使用:0次
名校
解题方法
4 . 已知A、B、C、D、E是元素周期表中同一周期的五种元素,A和B的最高价氧化物对应水化物呈碱性,且碱性B>A,C和D的气态氢化物水溶液呈酸性,且酸性C>D;五种元素所形成的简单离子中,E的离子半径最小,则它们的原子序数由小到大的顺序是( )
| A.CDEAB | B.ECDAB | C.BAEDC | D.BADCE |
您最近一年使用:0次
解题方法
5 . X、Y、Z 为不同短周期非金属元素的气态单质。在一定条件下能发生如下反应:
Y+X → 甲(g),Y+Z → 乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
(1)X 的电子式是__________ 。
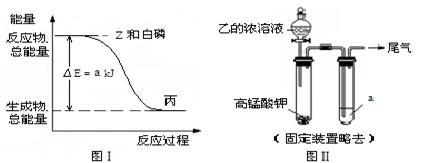
(2)白磷(P4)在 Z 气体中燃烧可生成液态丙分子,也可生成固态丁分子。已知丙分子中各原子最外层均是 8 电子结构,丙的结构式是__________ 。 白磷固体和 Z 气体反应,生成 1 mol 液态丙时,能量变化如图Ⅰ所示,写出该反应的热化学方程式: _____________________________ 。已知 1 mol 白磷固体和 Z 气体反应,生成固态丁时,放热 b kJ,则 1 mol 固态丁转化为液态丙时的反应热△H =____________________ 。
(3)某同学拟用图Ⅱ所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则 a____ 的水溶液。若仅将 a 换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是____________________ 。
(4)向一定浓度的 BaCl2溶液中通入 SO2气体,未见沉淀生成,若在通入 SO2气体的同时加入由 X、 Y、Z 中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是__________ 。
Y+X → 甲(g),Y+Z → 乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。

(1)X 的电子式是
(2)白磷(P4)在 Z 气体中燃烧可生成液态丙分子,也可生成固态丁分子。已知丙分子中各原子最外层均是 8 电子结构,丙的结构式是
(3)某同学拟用图Ⅱ所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则 a
(4)向一定浓度的 BaCl2溶液中通入 SO2气体,未见沉淀生成,若在通入 SO2气体的同时加入由 X、 Y、Z 中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是
您最近一年使用:0次
6 . I.A〜G七种元素中,除F外其他均为短周期主族元素,它们的原子结构或性质如下表所示:
请回答下列问题:
(1)A在元素周期表中的位置是_______ ;F的原子结构示意图是_____________ 。
(2)下列事实能证明C和E的非金属性强弱的是_____ 。(填序号)
①常温下,C的单质呈气态,E的单质呈固态②C的气态氢化物的温定性强于E的气态氢化物的温定性③C与E形成的化合物中,E呈正价④E的氢化物的沸点高于于C的氢化物的沸点
(3)由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是______ (填化学式),它与足量NaOH溶液在加热时反应的离子方程式为:_______ 。
(4)A的氢化物有多种,1 molA的某种氢化物分子中含有14mol电子,请写出该氢化物的电子式:______ 。已知在25℃、101kPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40kJ,写出该氢化物燃烧热:_________ 。
Ⅱ.甲、乙、丙,丁均为上述元素所形成的物质,甲是单质。它们之间有如下的反应关系:
(5)若乙为淡黄色固体,②③反应均用到同一种液态氢化物,丁物质常用于食品工业。乙所含化学键的类型是________ 。写出乙→丙的化学方程式:__________ 。
(6)若丁物成质具有两性,②③反应均要用强碱溶液,④反应是通入过量的—种引起温室效应的主要气体。写出丙→丁的离子方程式:__________ 。室温下,若由丁物质形成的水溶液中甲离子浓度为1.3×10-6mol·L-1,则该溶液的pH为______ 。
(丁的Ksp为1.3×10-33)
| 元素 | 原子结构或性质 |
| A | 其形成的一种同位素原子在考古中可推测化石的年代 |
| B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
| C | 地壳中含量最多的元素 |
| D | D原子的最外层电子数与其电子层数相同,是地壳中含量多的金属元素 |
| E | 其单质主要存在于火山口附近 |
| F | 生活中常见的金属,它的某种氧化物具有磁性 |
| G | G原子与D原子同周期,且原子半径是同周期元素中最大的 |
(1)A在元素周期表中的位置是
(2)下列事实能证明C和E的非金属性强弱的是
①常温下,C的单质呈气态,E的单质呈固态②C的气态氢化物的温定性强于E的气态氢化物的温定性③C与E形成的化合物中,E呈正价④E的氢化物的沸点高于于C的氢化物的沸点
(3)由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是
(4)A的氢化物有多种,1 molA的某种氢化物分子中含有14mol电子,请写出该氢化物的电子式:
Ⅱ.甲、乙、丙,丁均为上述元素所形成的物质,甲是单质。它们之间有如下的反应关系:
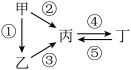
(5)若乙为淡黄色固体,②③反应均用到同一种液态氢化物,丁物质常用于食品工业。乙所含化学键的类型是
(6)若丁物成质具有两性,②③反应均要用强碱溶液,④反应是通入过量的—种引起温室效应的主要气体。写出丙→丁的离子方程式:
(丁的Ksp为1.3×10-33)
您最近一年使用:0次
名校
7 . 五种短周期元素A、B、C、D、E、F的原子序数依次增大.A和C同族,B和E同族,C离子和B离子具有相同的电子层结构,D的最外层电子数与电子层数相同.A和B、E、F均能形成共价化合物(由分子构成的化合物).A和B形成的化合物在水中呈碱性,C和F形成的化合物在水中呈中性.
回答下列问题:
(1)五种元素中,原子半径最大的是______ (填元素名称).最高价氧化物对应水化物酸性最强的元素为____ (填元素符号),其最高价氧化物对应水化物与NaOH反应的离子方程式为___________________________ .
(2)由A和B、E、F所形成的化合物中,热稳定性最差的是_________________ (用化学式表示).
(3)A和F形成的化合物与A和B形成的化合物反应,产物的化学式为________ .
(4)D元素最高价氧化物的化学式为_______ ,最高价氧化物对应水化物与氢氧化钠反应的离子方程式为___________________________ .
(5)单质F与水反应的离子方程式为___________________ ..
回答下列问题:
(1)五种元素中,原子半径最大的是
(2)由A和B、E、F所形成的化合物中,热稳定性最差的是
(3)A和F形成的化合物与A和B形成的化合物反应,产物的化学式为
(4)D元素最高价氧化物的化学式为
(5)单质F与水反应的离子方程式为
您最近一年使用:0次
2017-02-28更新
|
558次组卷
|
3卷引用:【校级联考】天津市静海区2019届高三上学期12月四校联考化学试题



