名校
1 . 随着原子序数的递增,8种短周期元素原子半径的相对大小、最高正化合价或最低负化合价如图所示。
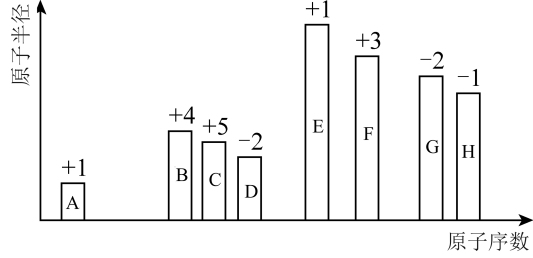
请用相应的化学用语回答下列问题:
(1)元素H在元素周期表中的位置是_______ 。
(2)元素D、G的简单氢化物中,还原性较强的是_______ (填化学式)。元素G、H的最高价氧化物的水化物中,酸性较强的是_______ (填化学式)。
(3)元素D、E、F、G形成的简单离子中,半径最小的离子为_______ (填离子符号)。
(4)化合物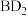 所含的化学键类型是
所含的化学键类型是_______ ,由A、D、H三种元素原子个数比为1∶1∶1形成的化合物的电子式为_______ 。
(5)用电子式表示元素E和H组成的化合物的形成过程:_______ 。
(6)元素F的氧化物与E的最高价氧化物的水化物反应的离子方程式为_______ 。

请用相应的化学用语回答下列问题:
(1)元素H在元素周期表中的位置是
(2)元素D、G的简单氢化物中,还原性较强的是
(3)元素D、E、F、G形成的简单离子中,半径最小的离子为
(4)化合物
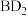 所含的化学键类型是
所含的化学键类型是(5)用电子式表示元素E和H组成的化合物的形成过程:
(6)元素F的氧化物与E的最高价氧化物的水化物反应的离子方程式为
您最近一年使用:0次
2022-01-19更新
|
365次组卷
|
3卷引用:辽宁省抚顺市六校协作体2021-2022学年高一上学期期末考试化学试题
名校
解题方法
2 . 某种单体的结构如图所示。R、W、X、Y、Z为原子序数依次增大的短周期元素,W、X、Y同周期,W的最外层电子数=Y的最外层电子数-内层电子数,基态Y原子价层有3个成单电子,Z的最高正价等于Y的原子序数。下列说法不正确的是
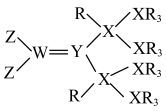

A. 呈正四面体 呈正四面体 |
B.该单体中W与Y之间存在 键, 键, 键电子对由Y提供 键电子对由Y提供 |
C.简单氢化物沸点 |
| D.五种元素的单质中,氧化性最强的是Z的单质 |
您最近一年使用:0次
3 . 已知W、X、Y、Z、R五种前4周期元素中,原子序数依次增大W<X<Y<Z<R,其结构或性质信息如下表。
请根据信息回答有关问题:
(1)画出W元素基态原子核外电子排布图___________________________ ;
(2)由W元素形成的有机物的种类繁多,其中相对分子质量为72的烃的结构有多种,请写沸点最低的一种烃的结构简式:_______________________ 。
(3)含有元素X的盐的焰色试验为_______ 色,许多金属元素形成的盐都可以发生焰色试验,其原因是_______ 。
(4)写出Y单质与X的最高价氧化物对应水化物反应的离子方程式___________________________ 。
在周期表中与Y元素的化学性质最相似的短周期主族元素是______ ,该元素基态原子核外共有_______ 种能量不同的电子。
(5)Z的含氧酸比较多,请写出其中氧化性最强的一种含氧酸的电子式_______ ,其中心原子的杂化方式是______ ,VSEPR模型为_______ 。
(6)写出R元素基态原子的价电子排布式为_______ 。
| 元素 | 结构或性质信息 |
| W | 原子L层上s电子数等于p电子数 |
| X | 同周期主族元素中电负性最小 |
| Y | 第三周期的主族元素中简单离子的半径最小 |
| Z | 单质在常温、常压下是气体,原子的M层上有1个未成对的p电子 |
| R | 前四周期中基态原子核外未成对电子数最多 |
(1)画出W元素基态原子核外电子排布图
(2)由W元素形成的有机物的种类繁多,其中相对分子质量为72的烃的结构有多种,请写沸点最低的一种烃的结构简式:
(3)含有元素X的盐的焰色试验为
(4)写出Y单质与X的最高价氧化物对应水化物反应的离子方程式
在周期表中与Y元素的化学性质最相似的短周期主族元素是
(5)Z的含氧酸比较多,请写出其中氧化性最强的一种含氧酸的电子式
(6)写出R元素基态原子的价电子排布式为
您最近一年使用:0次
4 . 五种短周期主族元素M、W、X、Y、Z的原子序数依次增大,M元素原子的最外层电子数是其电子层数的3倍;W是海水中的重要元素,原子结构示意图为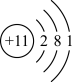 ;X的单质为金属,在空气中燃烧会发出耀眼的白光;Y是地壳中含量最高的金属元素;Z最高正价为+7。回答下列有关问题:
;X的单质为金属,在空气中燃烧会发出耀眼的白光;Y是地壳中含量最高的金属元素;Z最高正价为+7。回答下列有关问题:
(1)元素M在周期表中的位置是______ (指明周期与族),上述五种元素最高价氧化物对应的水化物中,酸性最强的酸是______ (填化学式)。
(2)W的单质着火时不能用水灭火,用化学反应方程式解释其原因____________ 。
(3)工业上可用X的单质与 加热还原出金属Ti,其反应方程式为
加热还原出金属Ti,其反应方程式为____________ 。
(4)门捷列夫曾预言过与Y同主族的“镓(Ga)”元素的存在,Ga与Y相邻。根据元素周期律推测,下列有关说法正确的是______(填字母代号)。
 ;X的单质为金属,在空气中燃烧会发出耀眼的白光;Y是地壳中含量最高的金属元素;Z最高正价为+7。回答下列有关问题:
;X的单质为金属,在空气中燃烧会发出耀眼的白光;Y是地壳中含量最高的金属元素;Z最高正价为+7。回答下列有关问题:(1)元素M在周期表中的位置是
(2)W的单质着火时不能用水灭火,用化学反应方程式解释其原因
(3)工业上可用X的单质与
 加热还原出金属Ti,其反应方程式为
加热还原出金属Ti,其反应方程式为(4)门捷列夫曾预言过与Y同主族的“镓(Ga)”元素的存在,Ga与Y相邻。根据元素周期律推测,下列有关说法正确的是______(填字母代号)。
| A.镓原子的最外层电子数为5 | B.镓的氧化物的化学式为 |
C.碱性强弱: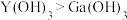 | D.单质Ga能与NaOH溶液反应产生 |
您最近一年使用:0次
解题方法
5 . 一种钠盐的结晶水合物全部由短周期元素构成,其阴离子的结构如图:
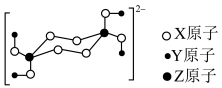
已知X无最高正化合价,三种元素中Y的原子半径最小,X和Z同周期,下列说法正确的是

已知X无最高正化合价,三种元素中Y的原子半径最小,X和Z同周期,下列说法正确的是
| A.X不存在同素异形体 |
| B.该阴离子结构中含有配位键 |
| C.X、Y、Z三种元素中电负性最大的是Z |
| D.该钠盐不具有强氧化性 |
您最近一年使用:0次
2023-09-06更新
|
150次组卷
|
2卷引用:河北省邯郸市2024届高三上学期第一次调研监测化学试题
名校
6 . A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A原子M层电子数是L层的一半,B是同周期第一电离能最小的元素,C在同周期中未成对电子数最多,E的外围电子排布式为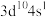 。回答下列问题:
。回答下列问题:
(1)A的基态原子中的电子有_______ 种不同的能量状态,B的基态原子中有_______ 种不同运动状态的电子。
(2)上述元素中最高价氧化物对应水化物酸性最弱的与碱性最强的物质发生反应的方程式是_______ 。
(3)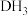 分子的
分子的 模型为
模型为_______ ,E元素在周期表的位置是_______ 。
(4)C与D的简单氢化物熔点相比后者的高,解释原因_______ ,A与碳形成的某晶体可用作打磨砂轮原料,1mol该晶体含有的共价键为_______ 个。
(5)C可形成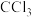 、
、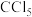 ,D只能形成
,D只能形成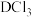 解释原因
解释原因_______ 。
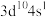 。回答下列问题:
。回答下列问题:(1)A的基态原子中的电子有
(2)上述元素中最高价氧化物对应水化物酸性最弱的与碱性最强的物质发生反应的方程式是
(3)
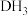 分子的
分子的 模型为
模型为(4)C与D的简单氢化物熔点相比后者的高,解释原因
(5)C可形成
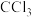 、
、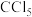 ,D只能形成
,D只能形成 解释原因
解释原因
您最近一年使用:0次
解题方法
7 . X、Y、Z、M、Q、R均为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误的是
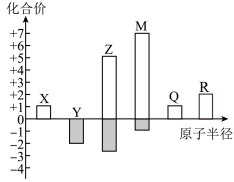
| A.X、Y、M组成的化合物中可能具有强氧化性 |
| B.X、Y、Z三种元素组成的化合物可能是酸、碱或盐 |
| C.简单离子半径:Q>M |
| D.化合物R(YX)2是强碱 |
您最近一年使用:0次
2023-04-27更新
|
234次组卷
|
3卷引用:山东省德州市2022-2023学年高一下学期4月期中考试化学试题
8 . 元素周期律是指导我们学习元素及其化合物知识的重要工具。已知氧族元素(不含Po)的部分知识如下表所示。
回答下列问题:
(1)硫元素在元素周期表中位置是_______ ,硒原子最外层电子数为_______ 。
(2)依据元素周期律和表中知识,预测单质硒的熔点范围_______ ℃<硒<_______ ℃,元素碲的主要化合价可能有_______ 。
(3)从物质类别和硫元素的价态分析,在一定条件下,SO2能与下列物质发生反应,在横线上写出反应产物中含硫物质的化学式:①NaOH溶液_______ ,②H2S_______ ,③Na2O2_______ 。
(4)已知硒最高价氧化物对应的硒酸是强酸,写出能证明硒酸比碳酸强的离子方程式:_______ 。
(5)氢硒酸(H2Se)有较强的还原性,因此露置在空气中长期保存易变质出现浑浊,可能发生反应的化学方程式为_______ 。
| 氧族元素 | 8O(氧) | 16S(硫) | 34Se(硒) | 52Te(碲) |
| 单质熔点/℃ | -218.4 | 113 | 450 | |
| 单质沸点/℃ | -183 | 444.6 | 685 | 1390 |
| 元素主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 |
(1)硫元素在元素周期表中位置是
(2)依据元素周期律和表中知识,预测单质硒的熔点范围
(3)从物质类别和硫元素的价态分析,在一定条件下,SO2能与下列物质发生反应,在横线上写出反应产物中含硫物质的化学式:①NaOH溶液
(4)已知硒最高价氧化物对应的硒酸是强酸,写出能证明硒酸比碳酸强的离子方程式:
(5)氢硒酸(H2Se)有较强的还原性,因此露置在空气中长期保存易变质出现浑浊,可能发生反应的化学方程式为
您最近一年使用:0次
名校
解题方法
9 . 锂电池具有高能量密度和长寿命的特点,应用广泛。某种新型锂离子电池的电解质结构如图所示,其中短周期元素X、Y、Z、W处在同一周期,W元素形成的某种单质具有强氧化性,可用于杀菌消毒。下列说法正确的是
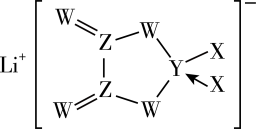
A.四种元素的原子半径: |
B.第一电离能: |
C.单质氧化性: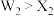 |
| D.阴离子中四种元素均满足8电子稳定结构 |
您最近一年使用:0次
2023-07-16更新
|
209次组卷
|
3卷引用:福建省莆田市2022-2023学年高二下学期期末考试化学试题
福建省莆田市2022-2023学年高二下学期期末考试化学试题江西省萍乡市安源中学2022-2023学年高二下学期期中考试化学试题(已下线)专题01 物质的结构与性质-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)
名校
解题方法
10 . 物质M是N−甲基−D−天冬氨酸受体的变构调控因子,其结构式如图所示。其中X、Y、Z、W、R为核电荷数依次增大的短周期主族元素。X的族序数与周期数相等,且与R同主族,Y形成的化合物种类最多。下列说法正确的是
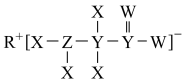
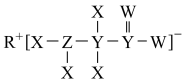
| A.原子半径:Y>Z>W>R |
| B.简单氢化物沸点:W>Z>Y |
| C.Z2X4中只含有极性共价键 |
| D.W、R形成的二元化合物均有强氧化性 |
您最近一年使用:0次
2023-03-12更新
|
666次组卷
|
3卷引用:四川省成都市蓉城名校联盟2023届高三下学期第二次联考理综化学试题
四川省成都市蓉城名校联盟2023届高三下学期第二次联考理综化学试题(已下线)河北省石家庄市2023届高中毕业年级教学质量检测(一模)变式题(选择题6-10)四川省内江市威远中学校2023-2024学年高三上学期第一次月考理综化学试题



