名校
1 . 有H、C、O、Na、Mg、Al、P、Cl、Ar等9种元素或它们的原子。如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:(1)原子核对核外电子的吸引力(2)形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量( ):
):
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_______ 。
(2)表中X可能为以上9种元素中的_______ (填写元素符号)元素。用元素符号表示X和地壳中含量占第一位的元素形成化合物的化学式_______ 。
(3)Y是周期表中_______ 族元素。
(4)以上9种元素中,_______ (填写字母)元素原子失去核外第一个电子需要的能量最多。
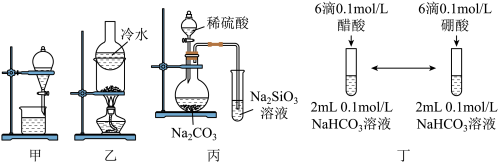
(5)下列实验装置符合题意且能达到相应实验目的的是_______。
 ):
):| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
(2)表中X可能为以上9种元素中的
(3)Y是周期表中
(4)以上9种元素中,
(5)下列实验装置符合题意且能达到相应实验目的的是_______。

A.装置甲利用 提取苯中溶解的 提取苯中溶解的 |
B.装置乙分离 和 和 固体 固体 |
| C.装置丙验证非金属性S>C>Si(已知硅酸不溶于水) |
| D.装置丁比较醋酸与硼酸酸性(已知酸性醋酸>碳酸) |
您最近半年使用:0次
名校
解题方法
2 . 四种短周期元素的核电荷数依次增大,它们相关信息如下表。
完成下列填空:
(1)W所形成的负离子的电子式为_______ ,该离子核外能量最高的电子位于_______ (填电子层符号)层。
(2)X用于测定文物年代的X核素的符号为_______ ;该核素核内中子数与质子数之差为_______ 。
(3)证明Y的气态氢化物极易溶于水的实验装置如所示。简述引发实验的操作。_______
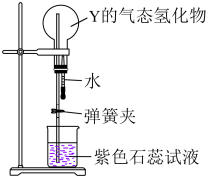
用相关化学方程式解释实验过程中紫色石蕊试液变色的原因:_______ 。
(4)Z在元素周期表中的位置是_______ ,比较X与Z原子半径的相对大小并说明理由。_______
(5)通过如下装置可以比较X、Y、Z三种元素的非金属性强弱。
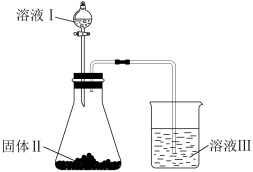
溶液Ⅰ的溶质是_______ (填化学式);进行实验时溶液Ⅲ中的现象是_______ 。有人认为上述装置存在缺陷,无法达到实验目的,请写出改进的措施。_______
| 元素代号 | W | X | Y | Z |
| 相关信息 | 原子得到1个电子后达到稀有气体稳定结构 | 某种核素常用于测定文物年代 | 气态氢化物极易溶于水 | 原子最外层电子是最内层电子的2倍 |
(1)W所形成的负离子的电子式为
(2)X用于测定文物年代的X核素的符号为
(3)证明Y的气态氢化物极易溶于水的实验装置如所示。简述引发实验的操作。

用相关化学方程式解释实验过程中紫色石蕊试液变色的原因:
(4)Z在元素周期表中的位置是
(5)通过如下装置可以比较X、Y、Z三种元素的非金属性强弱。

溶液Ⅰ的溶质是
您最近半年使用:0次
解题方法
3 . 短周期主族元素W、X、Y、Z的原子序数依次增大,元素W的一种单质是熔点高硬度大的宝石,Y的原子半径在所有短周期主族元素中最大。X和Z同主族,由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有刺激性气体产生。回答下列问题:
(1)Y元素位于周期表中的位置是_____________________ 。
(2)Z元素是______ ,由X和Z两种元素形成的化合物是______________ 。
(3)四种元素中的_______________ 元素是形成化合物最多的元素。
(4)某同学做同周期元素性质递变规律实验时,自己设计一套实验方案,并记录了有关实验现象如下表。
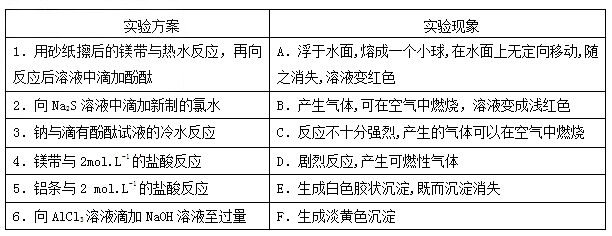
填写下列空格﹕
①实验目的:____________________________ 。
②与实验方案相对应的实验现象是:实验方案2对应的实验现象是___________ (填上表中的符号A.......F);实验方案3对应的实验现象是__________________________ 。
③得出规律:同周期元素从左到右_________________________________ 。
(1)Y元素位于周期表中的位置是
(2)Z元素是
(3)四种元素中的
(4)某同学做同周期元素性质递变规律实验时,自己设计一套实验方案,并记录了有关实验现象如下表。

填写下列空格﹕
①实验目的:
②与实验方案相对应的实验现象是:实验方案2对应的实验现象是
③得出规律:同周期元素从左到右
您最近半年使用:0次
20-21高一上·浙江绍兴·阶段练习
解题方法
4 . A、B、C、D、E为原子序数依次增大的短周期主族元素,A与E同主族,A与C组成的的一种化合物为最常见的温室气体,D+核外电子排布与C2-相同。试回答( 涉及的物质或微粒均用化学式表示):
提示:硝酸是一种易挥发的强酸。
(1)元素E在元素周期表中的位置是_______ ;
(2)与元素D的简单离子所含电子数和质子数都相同的微粒是_______ (写出一种即可);
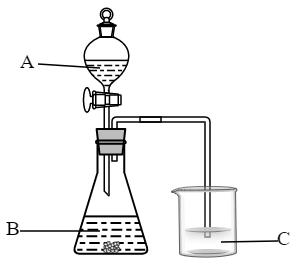
(3)A、B和E最高价氧化物对应的水化物中,酸性最强的是_______ ,若用如图装置验证这三种酸的酸性强弱,则烧杯C中可观察到有白色沉淀(H2SiO3)生成。该实验装置存在不足,影响到实验目的的达成,改进方法是_______ ;
(4)用电子式表示D2C的形成过程:_______ 。
提示:硝酸是一种易挥发的强酸。
(1)元素E在元素周期表中的位置是
(2)与元素D的简单离子所含电子数和质子数都相同的微粒是
(3)A、B和E最高价氧化物对应的水化物中,酸性最强的是

(4)用电子式表示D2C的形成过程:
您最近半年使用:0次
5 . A、B、C、D、E为原子序数依次增大的短周期主族元素,A与E同主族,A的一种同素异形体的分子结构与足球相似, 核外电子排布与
核外电子排布与 相同。试回答(涉及的物质均用化学式表示):
相同。试回答(涉及的物质均用化学式表示):
(1)元素E在元素周期表中的位置是______________ 。
(2)与元素D的简单离子所含电子数和质子数都相同的微粒是______________ (写一种即可)。
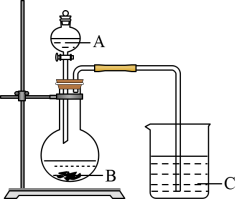
(3)A、B和E最高价氧化物对应的水化物中,酸性最弱的是______________ 。若用如图装置验证这三种酸的酸性强弱,则在装置A中应加入______________ ,烧杯C中可观察到有白色沉淀( )生成。该实验装置存在不足,影响到实验目的的达成,改进方法是
)生成。该实验装置存在不足,影响到实验目的的达成,改进方法是____________ 。
(4)用电子式表示 的形成过程:
的形成过程:______________ 。
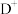 核外电子排布与
核外电子排布与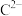 相同。试回答(涉及的物质均用化学式表示):
相同。试回答(涉及的物质均用化学式表示):(1)元素E在元素周期表中的位置是
(2)与元素D的简单离子所含电子数和质子数都相同的微粒是
(3)A、B和E最高价氧化物对应的水化物中,酸性最弱的是
 )生成。该实验装置存在不足,影响到实验目的的达成,改进方法是
)生成。该实验装置存在不足,影响到实验目的的达成,改进方法是
(4)用电子式表示
 的形成过程:
的形成过程:
您最近半年使用:0次
2020-09-02更新
|
141次组卷
|
2卷引用:苏教版(2020)高一必修第一册专题5第二单元 综合训练
名校
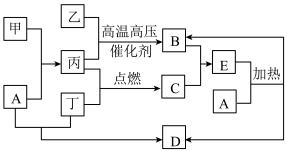
6 . 甲是日常生活中是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生大量的白烟,D是食盐的主要成分(部分反应物和生成物及溶剂水已略去)。___________ ;甲在元素周期表的位置为___________ 。
(2)A的电子式为___________ 。
(3)实验室常用加热固体混合物制备B,其化学方程式为___________ 。
(4)物质B的催化氧化是工业制硝酸的基础,其化学方程式___________ 。
(5)丙在丁中点燃,其现象为___________ 。
(6)检验E溶液中阳离子的方法是___________ 。
(2)A的电子式为
(3)实验室常用加热固体混合物制备B,其化学方程式为
(4)物质B的催化氧化是工业制硝酸的基础,其化学方程式
(5)丙在丁中点燃,其现象为
(6)检验E溶液中阳离子的方法是
您最近半年使用:0次
名校
解题方法
7 . X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,X元素可以组成M和N两种气态单质,常用反应:M+2I-+2H+=I2+N+H2O做M的鉴定反应,也可用带火星的木条检验M。
(1)写出实验室制取W2的离子方程式_______ 。
(2)某化学兴趣小组设计如图所示的实验装置(图中夹持和加热装置略去),分别探究YX2和W2的性质。
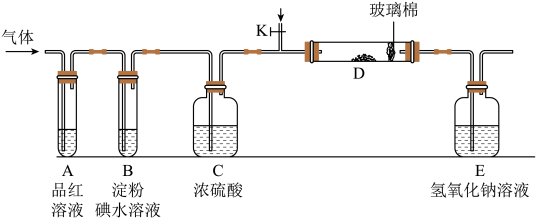
①若装置D中装的是铁粉,当通入W2时,灼热D时观察到_______ 现象。若装置D中装的是五氧化二钒(V2O5),当通入YX2时,打开K放入适量的氧气,灼热D装置,发生反应的化学方程式为_______ 。
②若装置B中装有5.0mL1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程为_______ 。
③某同学将足量的YX2通入一支装有BaCl2溶液的试管,未见沉淀生成,向该试管中加入适量_______ (填字母),可以看到白色沉淀产生。
A.氨水 B.稀盐酸 C.稀硝酸 D.CaCl2溶液
④物质Y2W2是有恶臭,毒性的液体,各原子满足8电子稳定结构,写出Y2W2的结构式_______ 。
(1)写出实验室制取W2的离子方程式
(2)某化学兴趣小组设计如图所示的实验装置(图中夹持和加热装置略去),分别探究YX2和W2的性质。

①若装置D中装的是铁粉,当通入W2时,灼热D时观察到
②若装置B中装有5.0mL1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程为
③某同学将足量的YX2通入一支装有BaCl2溶液的试管,未见沉淀生成,向该试管中加入适量
A.氨水 B.稀盐酸 C.稀硝酸 D.CaCl2溶液
④物质Y2W2是有恶臭,毒性的液体,各原子满足8电子稳定结构,写出Y2W2的结构式
您最近半年使用:0次
名校
8 . I.金属在生活中有着广泛的应用,人们甚至根据使用材料的种类,将人类漫长的历史分为了三个大的时代,分别是石器时代、青铜器时代,而后是铁器时代,直到19世纪早期,戴维组装了一个特别大的电池用于实验,先后发现了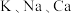 等许多金属。
等许多金属。
(1)造成上述人们利用金属先后顺序事实的最主要因素是_______。
(2)1827年维勒用金属钾还原熔融的无水氯化铝得到较纯的金属铝单质,但今天人们早已舍弃这种制备金属铝的方法,你认为可能的原因有_______ (写出一种合理原因即可)。写出现代工业上获得金属铝的化学反应方程式_______ 。
(3)已知铍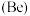 与铝的性质相似。则下列判断正确的是_______。
与铝的性质相似。则下列判断正确的是_______。
(4)钠是一种活泼的金属,将绿豆大的钠块投入如图所示的烧杯中,可能出现的现象_______。

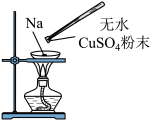
(5)在蒸发皿中放一小块钠,加热至熔化成小球时,用玻璃棒蘸取少量无水 粉末与其接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法错误的是_______。
粉末与其接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法错误的是_______。
(6)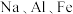 都是重要的金属元素。下列说法正确的是_______。
都是重要的金属元素。下列说法正确的是_______。
(7)类推的思维方法在化学学习中有时会产生错误结论,因此结论最终要经过实践的检验,才能决定其正确与否,下列几种关于金属的类推结论中,错误的是_______。
①钠与水反应生成 和
和 ;所有金属与水反应都生成碱和
;所有金属与水反应都生成碱和
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③ 与S直接化合时可得到
与S直接化合时可得到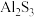 ;
; 与S直接化合时也可得到
与S直接化合时也可得到
④ 受热易分解,
受热易分解,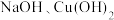 受热也易分解
受热也易分解
(8)单质A的燃烧热大。已知A为短周期元素,其气态原子逐个失去1~4个电子所需吸收能量如表所示。若该原子核外电子有三层,则该元素位于周期表_______ 族,写出A燃烧后形成的氧化物的电子式:_______ 。
Ⅱ.炼铁的主要原理之一是赤铁矿。它的主要成分在一定条件下有下列反应: 。在反应形成的固体混合物(
。在反应形成的固体混合物( 、
、 )中,元素铁和氧的质量比用
)中,元素铁和氧的质量比用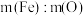 表示。
表示。
(9)根据上述反应,固体质量每减轻 ,将产生
,将产生
_______ L(S.T.P)。
(10)上述反应形成的固体混和物中,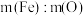 不可能是_______。
不可能是_______。
(11) 也是铁重要的氧化物之一,其在高温下与金属铝反应,也能获得单质铁,写出相关的化学反应方程式
也是铁重要的氧化物之一,其在高温下与金属铝反应,也能获得单质铁,写出相关的化学反应方程式_______ 。
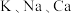 等许多金属。
等许多金属。(1)造成上述人们利用金属先后顺序事实的最主要因素是_______。
| A.地壳中金属元素的含量 | B.金属的延展性 |
| C.金属的导电性 | D.金属活泼性的差异 |
(3)已知铍
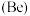 与铝的性质相似。则下列判断正确的是_______。
与铝的性质相似。则下列判断正确的是_______。| A.铍遇冷水剧烈反应 | B.氧化铍的化学式为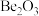 |
| C.氢氧化铍能与氢氧化钠溶液反应 | D. 能置换出 能置换出 中的镁单质 中的镁单质 |

| A.钠块在煤油、水两液体界面处反应,上下跳动,水层变红 |
| B.钠块只在煤油层中游动,并放出气体 |
| C.钠块只在水层中游动,钠块熔化,水层变红 |
| D.钠块在四氯化碳、水两液体界面处反应,熔化成小球并上下跳动,水层变红 |
 粉末与其接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法错误的是_______。
粉末与其接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法错误的是_______。
| A.钠受热易熔成小球说明其熔点低 |
B.钠与 粉末反应时放出大量热 粉末反应时放出大量热 |
C.一定条件下, 可与 可与 反应生成 反应生成 |
D.将无水 粉末改为 粉末改为 溶液,反应现象相同 溶液,反应现象相同 |
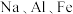 都是重要的金属元素。下列说法正确的是_______。
都是重要的金属元素。下列说法正确的是_______。| A.三者的最高价氧化物对应水化物均为碱性 | B.三者的氢氧化物都是白色固体 |
| C.三者的氯化物都可用化合反应制得 | D.三者的单质在空气中最终都生成氧化物 |
①钠与水反应生成
 和
和 ;所有金属与水反应都生成碱和
;所有金属与水反应都生成碱和
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③
 与S直接化合时可得到
与S直接化合时可得到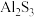 ;
; 与S直接化合时也可得到
与S直接化合时也可得到
④
 受热易分解,
受热易分解,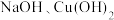 受热也易分解
受热也易分解| A.①② | B.③④ | C.①②③ | D.①②③④ |
 |  |  |  | …后续省略 | |
电离能( ) ) | 738 | 1451 | 7733 | 10540 | … |
Ⅱ.炼铁的主要原理之一是赤铁矿。它的主要成分在一定条件下有下列反应:
 。在反应形成的固体混合物(
。在反应形成的固体混合物( 、
、 )中,元素铁和氧的质量比用
)中,元素铁和氧的质量比用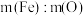 表示。
表示。(9)根据上述反应,固体质量每减轻
 ,将产生
,将产生
(10)上述反应形成的固体混和物中,
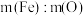 不可能是_______。
不可能是_______。| A.21∶9 | B.21∶7.5 | C.21∶5 | D.21∶8 |
 也是铁重要的氧化物之一,其在高温下与金属铝反应,也能获得单质铁,写出相关的化学反应方程式
也是铁重要的氧化物之一,其在高温下与金属铝反应,也能获得单质铁,写出相关的化学反应方程式
您最近半年使用:0次
名校
解题方法
9 . X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,X元素可以组成M和N两种气态单质,常用反应:M+2I-+2H+=I2+N+H2O做M的鉴定反应,也可用带火星的木条检验M。
(1)M与N的摩尔质量之比为_______ 。
(2)写出实验室制取W2的离子方程式_______ 。
(3)某化学兴趣小组设计下图所示的实验装置(图中夹持和加热装置略去),分别探究YX2和W2的性质。

①分别通入YX2和W2时,在装置A中观察到的现象是否相同?_______ 填“相同”或“不相同”)。若装置D中装的是铁粉,当通入W2时,观察到_______ 现象。若装置D中装的是五氧化二钒(V2O5),当通入YX2时,打开K放入适量的氧气,在D装置中发生反应的化学方程式为_______ 。
②若装置B中装有5.0 mL1.0×10-3 mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5 mol电子,该反应的化学方程为_______ 。
③某同学将足量的YX2通入一支装有BaCl2溶液的试管,未见沉淀生成,向该试管中加入适量(填字母)_______ ,可以看到白色沉淀产生。
A.氨水 B.稀盐酸 C.稀硝酸 D.CaCl2溶液
④物质Y2W2是有恶臭,毒性的液体,各原子满足8电子稳定结构,请判断Y2W2是_______ 化合物(填“离子”或“共价”)
(1)M与N的摩尔质量之比为
(2)写出实验室制取W2的离子方程式
(3)某化学兴趣小组设计下图所示的实验装置(图中夹持和加热装置略去),分别探究YX2和W2的性质。

①分别通入YX2和W2时,在装置A中观察到的现象是否相同?
②若装置B中装有5.0 mL1.0×10-3 mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5 mol电子,该反应的化学方程为
③某同学将足量的YX2通入一支装有BaCl2溶液的试管,未见沉淀生成,向该试管中加入适量(填字母)
A.氨水 B.稀盐酸 C.稀硝酸 D.CaCl2溶液
④物质Y2W2是有恶臭,毒性的液体,各原子满足8电子稳定结构,请判断Y2W2是
您最近半年使用:0次
10 . 某同学利用某一金属元素不同价态间的相互转化,设计如图转化关系(部分物质未写出)。
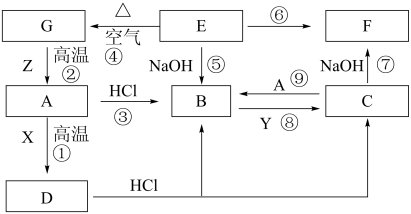
已知:①A是生活中应用最广泛的一种金属单质,A、B、C、D、E、F、G中均含有同一种元素;
②常温下,X是一种常见的液体,其分子是10e-分子;
③常温下,Y是一种黄绿色有毒气体,可用于自来水消毒;
④Z为地壳中含量最多的金属元素的单质。
请回答下列问题:
(1)A、B、F、X的化学式分别为A_______ , B_______ ,F_______ ,X_______ 。
(2)铸造工业上,液态A在注入模具前,必须将模具充分干燥,原因是_______ 。(用文字描述)
(3)上述反应中属于氧化还原反应的有_______ 个。
(4)由上述转化关系,分析实验室保存B的水溶液时通常加入少量A的目的是_______ ,若 B的水溶液因发生氧化还原反应而变质,加入KSCN溶液后,可观察到的现象为_______ 。
(5)选用下列装置_______ (填标号)能较长时间观察到E的颜色,不选用的装置中可观察到沉淀颜色变化情况为_______ 。


已知:①A是生活中应用最广泛的一种金属单质,A、B、C、D、E、F、G中均含有同一种元素;
②常温下,X是一种常见的液体,其分子是10e-分子;
③常温下,Y是一种黄绿色有毒气体,可用于自来水消毒;
④Z为地壳中含量最多的金属元素的单质。
请回答下列问题:
(1)A、B、F、X的化学式分别为A
(2)铸造工业上,液态A在注入模具前,必须将模具充分干燥,原因是
(3)上述反应中属于氧化还原反应的有
(4)由上述转化关系,分析实验室保存B的水溶液时通常加入少量A的目的是
(5)选用下列装置

您最近半年使用:0次



