1 . 无机盐A由4种常见的元素组成,为探究A的组成,设计并完成如下实验:
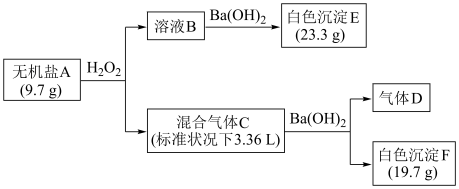
已知:D为单质,在标准状况下的密度为1.25 g/L;溶液B显酸性。
(1)混合气体C含两种气体,其中气体D的结构式为___________ ,另一种气体的电子式为___________ 。
(2)白色沉淀F可溶于盐酸,反应的离子方程式为___________ 。
(3)加入足量H2O2反应后,检验溶液B中主要阴离子的实验操作是___________ 。
(4)写出无机盐A所含的金属元素在周期表中的位置___________ 。
(5)写出A与H2O2反应的离子方程式___________ 。

已知:D为单质,在标准状况下的密度为1.25 g/L;溶液B显酸性。
(1)混合气体C含两种气体,其中气体D的结构式为
(2)白色沉淀F可溶于盐酸,反应的离子方程式为
(3)加入足量H2O2反应后,检验溶液B中主要阴离子的实验操作是
(4)写出无机盐A所含的金属元素在周期表中的位置
(5)写出A与H2O2反应的离子方程式
您最近一年使用:0次
2021-10-10更新
|
147次组卷
|
2卷引用:湖南省名校联合体2022届高三10月联考化学试题
18-19高二上·上海·期末
名校
2 . 下表为元素周期表的局部X、Y、Z、W均为短周期元素,其原子序数之和为47:
(1)X、Y、Z、W的元素符号依次为_______ 、________ 、_______ 、__________ (以下所有问题均用元素符号回答);
(2)X和Y的化合物中的两种微粒均达到了8电子稳定结构,该化合物的电子式为_____ ;将该化合物的固体溶于足量W的气态氢化物水溶液中,生成两种盐该反应的离子方程式为______________ ,生成的两种盐的电子式为__________ 、_____________ ;
(3)Z的氧化物为_________ (填酸性、碱性、两性、不成盐)氧化物,Y、Z、W的最高价氧化物对应的水化物两两之间反应的化学方程式为:
__________________________________ ;
___________________________ ;
________________________ .
| X | |||||
| Y | Z | W |
(2)X和Y的化合物中的两种微粒均达到了8电子稳定结构,该化合物的电子式为
(3)Z的氧化物为



您最近一年使用:0次
名校
3 . 已知a、b、d、e、 f、g、 h为原子序数依次增大的六种短周期主族元素, 非金属元素a最外层电子数与其周期数相同,b原子的最外层电子数是其所在周期数的2倍。d的一种单质可杀菌消毒,g的最高正价与最低负价代数和为4, f的最高价氧化物可分别与e和h的最高价氧化物的水化物反应,a单质在h单质中燃烧,产物溶于水得到一种强酸甲。请用化学用语回答下列问题:
(1)f在元素周期表中的位置___ 画出与h同族的第四周期元素的原子结构示意图____________ 。
(2)d、e、f、h的简单离子的半径由大到小的顺序_________ 。
(3)下列说法正确的是 。
(4)设计一个简单的实验证明d和g的非金属性强弱: _________ (用化学方程式表示)。
(5)为降低水源中NO 对人体的危害,可在强碱性条件下用f的单质将溶液中的NO
对人体的危害,可在强碱性条件下用f的单质将溶液中的NO 还原为N2,该反应的离子方程式为
还原为N2,该反应的离子方程式为______________ 。
(6)将e和f单质各1mol投入足量水中,充分反应后,所得溶液体积为500mL,则该过程可得标况下气体体积_______ L。最终获得溶液的物质的量浓度为_____ mol∙L−1。
(1)f在元素周期表中的位置
(2)d、e、f、h的简单离子的半径由大到小的顺序
(3)下列说法正确的是 。
| A.氢化物的稳定性d>b |
| B.含氧酸的酸性h>g>b>f |
| C.bg2中b为+4价;g为−2价可说明g的非金属性强于b |
| D.g阴离子能与Fe3+反应而h的阴离子不能,可说明g的非金属性弱于h |
(5)为降低水源中NO
 对人体的危害,可在强碱性条件下用f的单质将溶液中的NO
对人体的危害,可在强碱性条件下用f的单质将溶液中的NO 还原为N2,该反应的离子方程式为
还原为N2,该反应的离子方程式为(6)将e和f单质各1mol投入足量水中,充分反应后,所得溶液体积为500mL,则该过程可得标况下气体体积
您最近一年使用:0次
10-11高三·河北衡水·阶段练习
4 . 下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
(1)画出B的离子结构示意图______ ;写出D元素最高价氧化物的水化物电子式_________
(2)盐X水溶液显____ (填“酸”“碱”“中”)性,用离子方程式解释其原因________________
(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为________
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同。Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。该燃料电池放电时,正极的电极反应式是________________________________
(5)如右图是一个电解过程示意图。
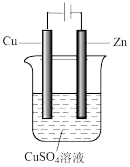
假设使用Y-空气燃料电池作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)_______________ L
| 元素 | 有关信息 |
| A | 元素主要化合价为—2,原子半径为0.074 n m |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102 n m,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物的水化物,能按1∶1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075 n m,最高价氧化物的水化物与其氢化物组成一种盐X |
(2)盐X水溶液显
(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同。Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。该燃料电池放电时,正极的电极反应式是
(5)如右图是一个电解过程示意图。

假设使用Y-空气燃料电池作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)
您最近一年使用:0次
解题方法
5 . 甲、乙、丙、丁4种化合物均含有2种或3种元素,分子中均含有18个电子。甲是气态氢化物。在水中分步电离出两种阴离子。下列推断合理的是
| A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B.乙和甲中同种元素的质量分数相等,则乙中含有化合价为-1的元素 |
| C.丙与氧气的摩尔质量相同,则丙一定仅由两种元素组成 |
| D.丁中含有第二周期ⅣA族元素,则丁一定是甲烷的同系物 |
您最近一年使用:0次
2016-12-09更新
|
419次组卷
|
6卷引用:2015届江苏常州市高三第一次调研试卷化学试卷
2015届江苏常州市高三第一次调研试卷化学试卷2016届河北省武邑中学高三上学期第四次调研化学试卷(已下线)考点06 原子结构 化学键——备战2019年浙江新高考化学考点2020届高三化学大二轮增分强化练——无机综合推断题2020届高三化学无机化学二轮专题复习——高考常考题型:无机化学推断题型【精编精炼】2012年浙江省高中学生化学竞赛试题
2012·河北石家庄·一模
名校
解题方法
6 . 由短周期元素组成的甲、乙、丙、丁四种物质分别含有两种或两种以上元素,它们分子中质子总数均与氩原子的质子数相同,已知甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
| A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
| C.丙中含有第2周期IV A族的元素,则丙一定是甲烷的同系物 |
| D.丁和甲含有某相同元素,且该元素在二者中的百分含量相同,则丁中一定含有-l价元素 |
您最近一年使用:0次
2016-12-09更新
|
370次组卷
|
5卷引用:2012届河北省石家庄市高三补充题、压轴题化学试卷
(已下线)2012届河北省石家庄市高三补充题、压轴题化学试卷2013届河北省衡水中学高三第二次模拟考试化学试卷12013届河北省衡水中学高三第二次模拟考试化学试卷 22017届湖南省衡阳市第八中学高三实验班第三次质检化学试卷安徽省滁州市定远县育才学校2021届高三上学期第三次月考化学试题
真题
名校
7 . 短周期元素甲、乙、丙、丁的原子序数依次增大,甲和丁的原子核外均有两个未成对电子,乙、丙、丁最高价氧化物对应的水化物两两之间能相互反应。下列说法错误的是
| A.元素丙的单质可用于冶炼金属 |
| B.甲与丁形成的分子中有非极性分子 |
| C.简单离子半径:丁 > 乙 > 丙 |
| D.甲与乙形成的化合物均有氧化性 |
您最近一年使用:0次
2016-12-09更新
|
1411次组卷
|
8卷引用:2015年全国普通高等学校招生统一考试化学(上海卷)
2015年全国普通高等学校招生统一考试化学(上海卷)2016届黑龙江省哈尔滨第六中学高三上期中测试化学试卷2016届山西省山西大学附属中学高三上12月月考化学试卷(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)(已下线)专题八 物质结构与元素周期律(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训吉林省长春市东北师大附中2020届高中毕业班二月份网络教学质量监测卷理科综合化学部分四川省武胜烈面中学校2019-2020学年高二下学期期中考试化学试题江苏省南通市2023-2024学年高三下学期化学调研测试卷
名校
8 . 五种短周期元素A、B、C、D、E、F的原子序数依次增大.A和C同族,B和E同族,C离子和B离子具有相同的电子层结构,D的最外层电子数与电子层数相同.A和B、E、F均能形成共价化合物(由分子构成的化合物).A和B形成的化合物在水中呈碱性,C和F形成的化合物在水中呈中性.
回答下列问题:
(1)五种元素中,原子半径最大的是______ (填元素名称).最高价氧化物对应水化物酸性最强的元素为____ (填元素符号),其最高价氧化物对应水化物与NaOH反应的离子方程式为___________________________ .
(2)由A和B、E、F所形成的化合物中,热稳定性最差的是_________________ (用化学式表示).
(3)A和F形成的化合物与A和B形成的化合物反应,产物的化学式为________ .
(4)D元素最高价氧化物的化学式为_______ ,最高价氧化物对应水化物与氢氧化钠反应的离子方程式为___________________________ .
(5)单质F与水反应的离子方程式为___________________ ..
回答下列问题:
(1)五种元素中,原子半径最大的是
(2)由A和B、E、F所形成的化合物中,热稳定性最差的是
(3)A和F形成的化合物与A和B形成的化合物反应,产物的化学式为
(4)D元素最高价氧化物的化学式为
(5)单质F与水反应的离子方程式为
您最近一年使用:0次
2017-02-28更新
|
558次组卷
|
3卷引用:辽宁省瓦房店市高级中学2016-2017学年高一下学期期末考试化学试题
解题方法
9 . 分A、B、C、D、E是中学常见的五种化合物,它们之间有下列转化关系:
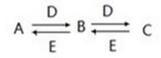
已知A溶液显碱性,可促进水的电离;D溶液显酸性,A、D溶液焰色反应均为黄色。
(1)若A、B、C中含有相同的金属元素,且B能溶于酸也能溶于碱,D能与Ba(OH)2反应生成不溶于盐酸的白色沉淀。则A的化学式为____________ ,D的化学式为_____________ ;A、C反应生成B的离子方程式为________________ 。
(2)若C是一种无色无味的气体,且能使澄清石灰水变浑浊。用离子方程式表示A溶液显碱性的原因_________________ ; C与E反应生成B的化学方程式为______________ 。
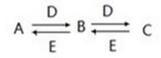
已知A溶液显碱性,可促进水的电离;D溶液显酸性,A、D溶液焰色反应均为黄色。
(1)若A、B、C中含有相同的金属元素,且B能溶于酸也能溶于碱,D能与Ba(OH)2反应生成不溶于盐酸的白色沉淀。则A的化学式为
(2)若C是一种无色无味的气体,且能使澄清石灰水变浑浊。用离子方程式表示A溶液显碱性的原因
您最近一年使用:0次
13-14高三上·辽宁抚顺·期中
解题方法
10 . X,Y,Z,Q,R是五种短周期元素,原子序数依次增大.X,Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z,R分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
(1)上述元素原子半径由大到小的顺序是(写元素符号)____________________ 。
(2)X,Y,Z能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写名称)____________________ 。
该物质能使酸性高锰酸钾溶液褪色同时生成一种生活中常见有机物,此过程的离子方程式为____________________ 。
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系
A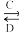 B(在水溶液中进行)
B(在水溶液中进行)
其中C是溶于水显酸性的气体;D是淡黄色固体.
写出C的结构式____________________ 。;
①如果A,B均由三种元素组成,B为两性不溶物,则由A转化为B的离子方程式____________________ 。
②如果A由三种元素组成,B由四种元素组成,A,B溶液均显碱性.用离子方程式表示A溶液显碱性的原因____________________ 。. A,B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是____________________ 。;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有____________________ 。
(1)上述元素原子半径由大到小的顺序是(写元素符号)
(2)X,Y,Z能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写名称)
该物质能使酸性高锰酸钾溶液褪色同时生成一种生活中常见有机物,此过程的离子方程式为
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系
A
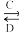 B(在水溶液中进行)
B(在水溶液中进行)其中C是溶于水显酸性的气体;D是淡黄色固体.
写出C的结构式
①如果A,B均由三种元素组成,B为两性不溶物,则由A转化为B的离子方程式
②如果A由三种元素组成,B由四种元素组成,A,B溶液均显碱性.用离子方程式表示A溶液显碱性的原因
您最近一年使用:0次



