解题方法
1 . N、P、 是重要的氮族元素,氮族元素的单质及其化合物的应用较为广泛。回答下列问题:
是重要的氮族元素,氮族元素的单质及其化合物的应用较为广泛。回答下列问题:
(1)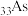 与P位于同一主族,磷原子的结构示意图为
与P位于同一主族,磷原子的结构示意图为___________ ,砷在周期表中的位置是___________ 。
(2)下列能说明N和P非金属性相对强弱的是___________(填标号)。
(3)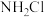 比
比 稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂,
稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂,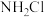 发生水解的化学方程式为
发生水解的化学方程式为___________ 。
(4)白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜反应如下: ,反应中
,反应中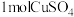 可氧化
可氧化___________ 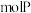 。
。
 是重要的氮族元素,氮族元素的单质及其化合物的应用较为广泛。回答下列问题:
是重要的氮族元素,氮族元素的单质及其化合物的应用较为广泛。回答下列问题:(1)
 与P位于同一主族,磷原子的结构示意图为
与P位于同一主族,磷原子的结构示意图为(2)下列能说明N和P非金属性相对强弱的是___________(填标号)。
A. 比 比 稳定性强 稳定性强 |
B. 溶液与 溶液与 反应生成 反应生成 |
| C.硝酸显强氧化性,磷酸不显强氧化性 |
| D.常温下,氮气是气体,磷单质是固体 |
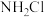 比
比 稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂,
稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂, 发生水解的化学方程式为
发生水解的化学方程式为(4)白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜反应如下:
 ,反应中
,反应中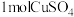 可氧化
可氧化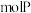 。
。
您最近一年使用:0次
2 . 元素的“价类二维图”体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如下图所示。

回答下列问题:
(1)写出物质R的电子式。_______ 。
(2)下列有关图中所示含N、S物质的叙述,正确的是_______ (填标号)。
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与 溶液反应,都是酸性氧化物
溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
(3)将 的物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是
的物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是_______ 。
(4)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析, 晶体中所含化学键的类型有
晶体中所含化学键的类型有_______ ,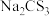 水溶液显
水溶液显_______ (填“酸性”、“碱性”或“中性”)。
(5) (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: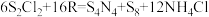 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有_______ ,该反应每生成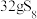 转移电子
转移电子_______  。其中被氧化的元素是
。其中被氧化的元素是_______ (填元素符号)。

回答下列问题:
(1)写出物质R的电子式。
(2)下列有关图中所示含N、S物质的叙述,正确的是
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与
 溶液反应,都是酸性氧化物
溶液反应,都是酸性氧化物e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
(3)将
 的物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是
的物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是(4)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析,
 晶体中所含化学键的类型有
晶体中所含化学键的类型有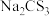 水溶液显
水溶液显(5)
 (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: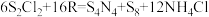 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有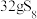 转移电子
转移电子 。其中被氧化的元素是
。其中被氧化的元素是
您最近一年使用:0次
名校
解题方法
3 . X、Y、Z、W、R、Q为原子序数依次增大的六种短周期主族元素。X是原子半径最小的元素;Y原子最外层电子数是核外电子层数的3倍;Z是短周期中金属性最强的元素;W是地壳中含量最多的金属元素;R的最高正价与最低负价代数和为4。请回答下列问题:
(1)Y的元素名称是______ 。
(2)W在周期表中的位置是______ 。
(3)写出化合物Z2R的电子式______ 。
(4)写出化合物X2Y2的结构式______ 。
(5)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是______ (用元素的离子符号表示)。
(6)下列说法能证明非金属性Q强于R的是______ (填序号)。
a.简单阴离子的还原性:Q>R
b.简单氢化物热稳定性:Q>R
c.氧化物对应的水化物的酸性: Q>R
(7)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是______ 。
(1)Y的元素名称是
(2)W在周期表中的位置是
(3)写出化合物Z2R的电子式
(4)写出化合物X2Y2的结构式
(5)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是
(6)下列说法能证明非金属性Q强于R的是
a.简单阴离子的还原性:Q>R
b.简单氢化物热稳定性:Q>R
c.氧化物对应的水化物的酸性: Q>R
(7)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是
您最近一年使用:0次
2021-01-19更新
|
592次组卷
|
5卷引用:辽宁省锦州市2020-2021学年高一上学期期末考试化学试题
解题方法
4 . 元素周期表在学习、研究和生产实践中有很重要的作用。下表显示了元素周期表中的短周期,①〜⑤代表5种元素。
(1)②在元素周期表中的位置是_______ 。
(2)①分别与④、⑤形成的化合物中,稳定性强的是_______ (用化学式表示)。
(3)③和④分别形成的最高价氧化物对应的水化物可以发生反应,离子方程式是_______ 。
(4)③能与⑤形成AB型化合物,用原子结构解释原因:_______ 。
(5)元素Se的原子结构示意图为 。下列推断正确的是
。下列推断正确的是_______ (填序号)。
a.Se位于第4周期、与④同主族
b.Se的最低负化合价为-2价
c.SeO2具有还原性
d.H2SeO3的酸性强于H2SO4
| ① | |||||||
| ② | |||||||
| ③ | ④ | ⑤ |
(2)①分别与④、⑤形成的化合物中,稳定性强的是
(3)③和④分别形成的最高价氧化物对应的水化物可以发生反应,离子方程式是
(4)③能与⑤形成AB型化合物,用原子结构解释原因:
(5)元素Se的原子结构示意图为
 。下列推断正确的是
。下列推断正确的是a.Se位于第4周期、与④同主族
b.Se的最低负化合价为-2价
c.SeO2具有还原性
d.H2SeO3的酸性强于H2SO4
您最近一年使用:0次
2021-01-24更新
|
239次组卷
|
2卷引用:北京市东城区2020-2021学年高一上学期期末考试化学试题
名校
5 . 有A、B、C、D四种元素,A元素是地壳中含量最多的金属元素;B元素的原子其M层电子数比L层少1个电子;C元素的原子得到2个电子,D元素的原子失去1个电子,所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
(1)元素A的名称为___________ ,元素A的单质与 溶液反应的离子方程式为
溶液反应的离子方程式为___________ 。
(2)元素B在周期表中的位置:___________ ,画出B的离子结构示意图:___________ 。
(3)C和D形成的化合物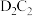 可作供氧剂,写出
可作供氧剂,写出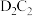 与
与 反应的化学方程式:
反应的化学方程式:___________ 。消耗 生成的氧气在标准状况下的体积为
生成的氧气在标准状况下的体积为___________ 。
(4)设计实验证明D的金属性强于A:___________ 。
(1)元素A的名称为
 溶液反应的离子方程式为
溶液反应的离子方程式为(2)元素B在周期表中的位置:
(3)C和D形成的化合物
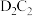 可作供氧剂,写出
可作供氧剂,写出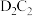 与
与 反应的化学方程式:
反应的化学方程式: 生成的氧气在标准状况下的体积为
生成的氧气在标准状况下的体积为(4)设计实验证明D的金属性强于A:
您最近一年使用:0次
6 . W、X、Y、Z为元素周期表中原子序数依次增大的四种短周期元素,W的单原子阳离子的水溶液中能使紫色石蕊试液显红色,X的最外层电子数为次外层电子数的三倍,Y的单质遇水剧烈反应生成H2,Z位于第三周期VIIA族。下列说法正确的是
| A.Y的单质在空气中燃烧后的产物中阳离子和阴离子的个数比为1:1 |
| B.Al在YXW的水溶液中不反应 |
| C.Z的单质具有强氧化性,可以和KSCN溶液一起用于检测Fe2+ |
| D.检验水溶液中Z的单原子阴离子的方法是在溶液中滴加AgNO3,看是否产生白色沉淀 |
您最近一年使用:0次
名校
解题方法
7 . X、Y、Z、W是原子序数依次增大的短周期元素。W与X位于同一主族; X、 Y、Z三种元素形成的化合物具有强氧化性,能灭活新冠病毒,其结构如图所示。下列叙述不正确的是
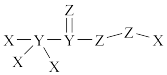
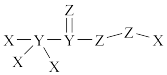
| A.该化合物含极性键和非极性键 |
| B.该化合物中各元素原子均达稳定结构 |
| C.Z、W形成的简单离子半径,Z大于W |
| D.由X、Y、Z、W四种元素形成的化合物一定能与X、Z、W形成的化合物反应 |
您最近一年使用:0次
2021-05-31更新
|
1159次组卷
|
4卷引用:四川省达州市普通高中2021届高三第二次诊断性测试理科综合化学试题
名校
解题方法
8 . 前四周期主族元素V、W、X和Y,原子序数依次增大且最外层电子数之和为11,元素V的一种核素可用于文物断代,W的气态氢化物和其最高价氧化物的水化物能形成离子化合物,X是短周期原子半径最大的原子。下列说法正确的是:
| A.简单离子半径大小:r(W) < r(X ) < r(Y) |
| B.X与氧能形成两种只含离子键的化合物 |
| C.最高价氧化物对应水化物碱性:X > Y |
| D.简单氢化物的稳定性:W > V |
您最近一年使用:0次
名校
9 . 有W、X、Y、Z四种原子序数依次增大的元素。已知:
①W与X或Y形成的化合物的焰色反应均呈黄色;
②X原子次外层电子数为核外电子总数的一半
③X离子、Y离子均与Y的气态氢化物具有相同电子数
④Z可与Y组成常见化合物ZY2和ZY3;请回答:
(1)X的原子结构示意图___ ,
(2)写出工业上电解熔融WY的方法制取W,其化学方程式:__ 当电极上通过0.2mol电子时,生成的气体在标准状况下体积是__ L。
(3)将ZY饱和溶液滴入沸水可得到红褐色液体,此液体的分散系类型是___ 。
a.溶液 b.胶体 c.乳浊液
(4)写出一个能够证明Y单质的氧化性比X单质的氧化性强的化学方程式___ 。
①W与X或Y形成的化合物的焰色反应均呈黄色;
②X原子次外层电子数为核外电子总数的一半
③X离子、Y离子均与Y的气态氢化物具有相同电子数
④Z可与Y组成常见化合物ZY2和ZY3;请回答:
(1)X的原子结构示意图
(2)写出工业上电解熔融WY的方法制取W,其化学方程式:
(3)将ZY饱和溶液滴入沸水可得到红褐色液体,此液体的分散系类型是
a.溶液 b.胶体 c.乳浊液
(4)写出一个能够证明Y单质的氧化性比X单质的氧化性强的化学方程式
您最近一年使用:0次
名校
解题方法
10 . W、X、Y、Z、Q为原子序数依次增大的5种短周期元素,W的阴离子与锂离子具有相同电子层结构,X的气态氢化物可与其最高价含氧酸反应生成离子化合物,X、Y、Z的最高价氧化物对应水化物之间两两反应均可生成盐和水,Q的最高价氧化物对应的的水化物为最强含氧酸。下列说法错误的是
| A.W、Y均可以与氧原子形成1:1、1:2型化合物 |
| B.Y、Z、Q的简单离子半径大小关系:Q> Y >Z |
| C.Q元素单质具有强氧化性、漂白性 |
| D.X的氢化物稳定性比它同周期右边主族元素的氢化物稳定性差 |
您最近一年使用:0次



