名校
1 . 三个相邻周期的主族元素X、Y、Z、W,原子序数依次增大,其中X、Y分别是地壳中含量最高的非金属元素和金属元素,Z原子的最外层电子数是最内层电子数的2倍,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。则下列判断正确的是
| A.原子半径: W>Y>Z>X | B.气态氢化物的稳定性:Z>X |
| C.Y、Z的氧化物都有两性 | D.最高价氧化物对应水化物的碱性:Y>W |
您最近半年使用:0次
2018-05-14更新
|
476次组卷
|
5卷引用:黑龙江省鸡西市第一中学2019-2020学年高一下学期期中考试化学试题
名校
2 . 有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A______ B _____ C _____ D ______
(2)D元素位于周期表中___________ 周期____________ 族
(3)写出AB2与C2B2反应的化学方程式:________________________________________ 。
(4)电子式表示化合物 C2D 的形成过程:________________________________________ 。
(1)元素名称: A
(2)D元素位于周期表中
(3)写出AB2与C2B2反应的化学方程式:
(4)电子式表示化合物 C2D 的形成过程:
您最近半年使用:0次
2018-05-01更新
|
686次组卷
|
9卷引用:黑龙江省齐齐哈尔市第八中学2018-2019学年高一下学期3月月考化学试题
黑龙江省齐齐哈尔市第八中学2018-2019学年高一下学期3月月考化学试题吉林省长春汽车经济开发区第六中学2017-2018学年高一下学期4月月考化学试题新疆哈密市第十五中学2018-2019学年高一第二学期期中考试化学试题福建省漳州市第一中学2019-2020学年高一3月在线测试(实验班)化学试题河北省石家庄实验中学2019-2020学年高一3月月考化学试题山东省德州市齐河县实验中学2019-2020学年高一下学期期中考试化学试题(已下线)第四章 章末测试练习(2)——《高中新教材同步备课》(人教版 必修第一册)四川省内江市威远中学2020-2021学年高一下学期第一次月考化学试题(已下线)第15练 第四章章末质量检测-2022年【寒假分层作业】高一化学(人教版2019)
名校
3 . (1)下图所示元素周期表中全部是金属元素的区域为___________
A.A B.B C.C D.D
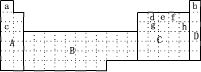
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。______________
②甲、乙两元素相比较,金属性较强的是_________ (填名称),可以验证该结论的实验是_______ 。
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:______ ,比较C、B、D结合氢离子的能力由强到弱的顺序为_________________ (用化学式表示)。
(4)上表中c、h元素形成的简单离子半径之比________ 1(填〉或〈或 =)。
A.A B.B C.C D.D

(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:
(4)上表中c、h元素形成的简单离子半径之比
您最近半年使用:0次
2018-04-13更新
|
500次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2017-2018学年高一4月月考化学试题1
名校
4 . m、n、p、q为原子序数依次增大的短周期主族元素,四种原子最外层电子数之和为17, n3-与p2+具有相同的电子层结构。下列叙述错误的是
| A.氢化物的沸点; q>n>m | B.m、n、q一定是非金属元素 |
| C.离子半径:q>n>p | D.m与q形成的二元化合物一定是共价化合物 |
您最近半年使用:0次
2018-03-17更新
|
314次组卷
|
8卷引用:黑龙江省哈尔滨市第六中学2017-2018学年高一4月月考化学试题
黑龙江省哈尔滨市第六中学2017-2018学年高一4月月考化学试题湖北省武昌区2017届高三5月调研考试理综化学试题江苏省溧水高级中学2017-2018学年高二下学期期末考试(选修)化学试题安徽省芜湖市2018届高三上学期期末考试(一模)理综化学试题(已下线)【段考模拟】高一化学下学期第一次月考(3月)原创B卷【全国市级联考】四川省南充市2018届高三第三次诊断考试理综化学试题(已下线)5.1.1 元素周期律练习(1)——《高中新教材同步备课》(苏教版 必修第一册)解题达人.化学选择题(2021全国卷)提升小卷06
名校
5 . 短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y和W同主族,Z+与Y2-具有相同的电子层结构。下列说法正确的是( )
| A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B.X的最高价氧化物对应水化物的酸性比W的弱 |
| C.Y分别与Z、W形成的化合物中化学键类型相同 |
| D.W的气态简单氢化物的热稳定性比Y的强 |
您最近半年使用:0次
2018-02-01更新
|
426次组卷
|
4卷引用:黑龙江省牡丹江市第一高级中学2017-2018学年高一4月月考化学试题
名校
6 . 短周期主族元素X、Y、Z、W原子序数依次增大,X 与Y、Z、W不在同一周期,Y最外层电子数是次外层电子数的3倍,W与Y同主族,Z是地壳中含量最多的金属元素。下列说法正确的是( )
| A.Y的单质的氧化性比W的弱 |
| B.原子半径:r(X)< r(Y)< r(W)< r(Z) |
| C.化合物X2Y和Z2Y3,含有相同类型的化学键 |
| D.元素Y、Z形成的化合物熔点高,不能用电解法制备其中的金属单质 |
您最近半年使用:0次
2018-01-13更新
|
441次组卷
|
5卷引用:【全国百强校】黑龙江省大庆实验中学2019届高三上学期第一次月考化学试题
名校
7 . 短周期主族元素X、Y、Z、W 的原子序数依次增大,Y 与X 形成的某气态化合物可以使湿润的红色石蕊试纸变蓝,Z 的质子数比Y 多1,非金属元素W 的氧化物熔点高于其它短周期非金属元素。下列说法不正确的是
| A.四种元素任意组合形成的化合物均为共价化合物 |
| B.原子半径大小: W>Y>Z>X |
| C.Y、Z 均可与X 形成含有非极性共价键的化合物 |
| D.简单氢化物的稳定性: Z>Y>W |
您最近半年使用:0次
2017-11-24更新
|
361次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学2017-2018学年高二上学期期末考试化学试题
名校
8 . 短周期元素X、Y、Z、W,它们的原子序数依次增大。X与Z同主族,并且原子序数之和为20。Y原子的质子数为Z原子的质子数的一半,W原子的最外层电子数比Y原子的最外层电子数多2个。下列叙述正确的是( )
| A.Y的最高价氧化物对应的水化物可与其简单气态氢化物发生反应 |
| B.原子半径:Z>W>Y>X |
| C.简单气态氢化物的稳定性:Z>W |
| D.X的简单气态氢化物与足量W的单质在光照条件下反应的生成物均为气体 |
您最近半年使用:0次
2017-07-12更新
|
419次组卷
|
4卷引用:黑龙江省哈尔滨市第六中学2018届高三9月阶段检测化学试题
名校
解题方法
9 . 已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数为D的2倍。F元素在地壳中含量位于金属元素的第二位。试回答下列问题:
(1)F元素价层电子排布式为___________________ 。
(2)关于B2A2的下列说法中正确的是________________ 。
A.B2A2中的所有原子都满足8电子结构
B.每个B2A2分子中σ键和π键数目比为1∶1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子中的B-A键属于s—spσ键
(3) B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是________________ 。
(4) C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因__________ 。
(5) A与D可以形成原子个数比分别为2∶1,1∶1的两种化合物X和Y,其中 Y含有____________ 键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相 等,N的 结构式为________ 。
(6) E的氢化物的价层电子对互斥理论模型为________ ,E 原子的杂化方式为________ 杂化。
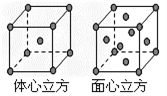
(7) F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为_________ ,F原子配位数之比为__________________ 。
(1)F元素价层电子排布式为
(2)关于B2A2的下列说法中正确的是
A.B2A2中的所有原子都满足8电子结构
B.每个B2A2分子中σ键和π键数目比为1∶1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子中的B-A键属于s—spσ键
(3) B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是
(4) C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因
(5) A与D可以形成原子个数比分别为2∶1,1∶1的两种化合物X和Y,其中 Y含有
(6) E的氢化物的价层电子对互斥理论模型为
(7) F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为

您最近半年使用:0次
2017-05-18更新
|
509次组卷
|
2卷引用:黑龙江省大庆实验中学2017届高三考前得分训练(一)理科综合化学试题2
名校
10 . 短周期元素X、Y可以形成化合物XY2。下列有关叙述正确的是
| A.若XY2是共价化合物,则X与Y的原子序数不可能相差1 |
| B.若XY2是离子化合物,则X与Y的原子序数可能相差8 |
| C.若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 |
| D.若X与Y的原子序数相差5,则离子化合物XY2不溶于水 |
您最近半年使用:0次
2017-05-11更新
|
209次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2016-2017学年高一下学期期中考试化学试题



