名校
1 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是次外层电子数的3倍,Z可与X形成淡黄色化合物Z2X2,X、W的最外层电子数相同。下列说法正确的是
| A.简单离子的半径:Z>Y | B.简单离子的还原性:X>W |
| C.气态氢化物的稳定性:Y>X | D.Z2X2属于共价化合物 |
您最近半年使用:0次
2021-04-11更新
|
715次组卷
|
9卷引用:海南省白沙学校2023-2024学年高一上学期期末考试化学试题
海南省白沙学校2023-2024学年高一上学期期末考试化学试题广西贵港市立德高中2020-2021学年高一3月月考化学试题湖北省黄石市有色第一中学2020-2021学年高一下学期期中考试化学试题广东省广州市海珠区2020-2021学年高一上学期期末考试化学试题广东省广州市西关外国语学校2022-2023学年高一上学期期末考试化学试题广东省广州市第三中学2022-2023学年高一上学期期末考试化学试题广东省广州市白云中学2022-2023学年高一上学期期末考试化学试题广东省广州市黄广中学2023-2024学年高一上学期期末错题专项考化学试卷湖南省长沙市明德中学2023-2024学年高一上学期期末考试化学试题
名校
解题方法
2 . A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A原子核内无中子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的 ,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物.请回答下列问题:
,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物.请回答下列问题:
(1)C元素在元素周期表中的位置是___ ;C、D、E三种元素简单离子半径由大到小的顺序为:___ (用离子符号表示)。
(2)写出分别由A、D与C形成的原子个数比为1:1的化合物的电子式___ 、___ 。
(3)A与C、E间分别形成甲、乙两种共价化合物,且甲有10个电子,乙有18个电子,则沸点较高的是___ (填化学式)。
(4)F含有的化学键类型是___ 、___ 。
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该反应的离子方程式为___ 。
 ,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物.请回答下列问题:
,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物.请回答下列问题:(1)C元素在元素周期表中的位置是
(2)写出分别由A、D与C形成的原子个数比为1:1的化合物的电子式
(3)A与C、E间分别形成甲、乙两种共价化合物,且甲有10个电子,乙有18个电子,则沸点较高的是
(4)F含有的化学键类型是
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该反应的离子方程式为
您最近半年使用:0次
2020-05-11更新
|
155次组卷
|
3卷引用:海南省海南枫叶国际学校2019-2020学年高一上学期期末考试化学试题
名校
解题方法
3 . X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为__________________ 。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)_______________ 。
(3)X、Y、Z三种元素形成盐类化合物的水溶液呈酸性的原因:________________ (用离子方程式表示)。溶液中所含离子浓度由大到小的顺序为______________ 。
(4)YX4M的电子式为______________ ,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为_________________________________ 。
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为______________ 。
(1)R在元素周期表中的位置为
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)
(3)X、Y、Z三种元素形成盐类化合物的水溶液呈酸性的原因:
(4)YX4M的电子式为
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为
您最近半年使用:0次
名校
4 . 三个相邻周期的主族元素X、Y、Z、W,原子序数依次增大,其中X、Y分别是地壳中含量最高的非金属元素和金属元素,Z原子的最外层电子数是最内层电子数的2倍,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。则下列判断正确的是
| A.原子半径: W>Y>Z>X | B.气态氢化物的稳定性:Z>X |
| C.Y、Z的氧化物都有两性 | D.最高价氧化物对应水化物的碱性:Y>W |
您最近半年使用:0次
2018-05-14更新
|
476次组卷
|
5卷引用:海南省琼海市嘉积第三中学2021-2022学年高三下学期第二次月考化学科试题
名校
5 . 右表为元素周期表的一部分。回答下列问题:
(1)Z的元素符号为_________________ 。
(2)X位于元素周期表第_______ 周期_______ 族。
(3)W与Y形成的化合物WY中,W的化合价是________ 。
(4)硫的最简单氢化物与硫的低价氧化物通入水中时,发生反应的化学方程式为_________________________ 。
| W | 氮 | Y | |
| X | 硫 | Z |
(1)Z的元素符号为
(2)X位于元素周期表第
(3)W与Y形成的化合物WY中,W的化合价是
(4)硫的最简单氢化物与硫的低价氧化物通入水中时,发生反应的化学方程式为
您最近半年使用:0次
2017-09-14更新
|
532次组卷
|
3卷引用:海南省(海南中学、文昌中学、海口市第一中学、农垦中学)等八校2018届高三上学期新起点联盟考试化学试题
6 . A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大。B、D的原子序数之差为8,B原子最外层电子数是其次外层电子数的3倍,C原子在同周期主族元素中原子半径最大。
回答下列问题:
(1)B在周期表中的位置为__________________________________ ;
A的单质与E的单质反应的条件是__________________________ 。
(2)B、C、D原子的半径从大到小的顺序是__________ (用元素符号表示);
C单质与A的氧化物反应的化学方程式是__________________________ 。
(3)设计实验证明E的非金属性比D的非金属性强____________________________________________________________ (写出操作步骤及现象)。
(4)A的单质和B的单质能组成电池,当电解质溶液为D的最高价氧化物的水化物的稀溶液时,负极上的电极反应式为________________________ 。
回答下列问题:
(1)B在周期表中的位置为
A的单质与E的单质反应的条件是
(2)B、C、D原子的半径从大到小的顺序是
C单质与A的氧化物反应的化学方程式是
(3)设计实验证明E的非金属性比D的非金属性强
(4)A的单质和B的单质能组成电池,当电解质溶液为D的最高价氧化物的水化物的稀溶液时,负极上的电极反应式为
您最近半年使用:0次
2016-12-09更新
|
120次组卷
|
2卷引用:海南省八所中学2020届高三上学期期末考试化学试题
7 . X、Y、Z、W、Q是五种原子序数依次增大的短周期元素,除Z外的另外四种元素在周期表中的位置如图所示,其中Y、W、Q的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物间均能发生反应,下列说法中正确的是
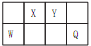

| A.简单离子半径大小关系为:W>Z>X>Y |
| B.原子核外最外层电子数:Q>Y>X>W>Z |
| C.X与氢元素形成的化合物中,只含极性键 |
| D.常见单质的熔沸点:X>W>Z |
您最近半年使用:0次
9-10高一下·海南·期末
解题方法
8 . 短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外M层电子数目比K层多1个,C―比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子。
(1)A离子的离子结构示意图为 ;
(2)C元素在周期表中的位置是 ;
(3)A~D四种元素最高价氧化物对应水化物中,酸性最强的是 ;
(4)向B、C两种元素形成的化合物的水溶液里滴入过量氢氧化钠溶液,写出有关离子方程式__________________________________。
(1)A离子的离子结构示意图为 ;
(2)C元素在周期表中的位置是 ;
(3)A~D四种元素最高价氧化物对应水化物中,酸性最强的是 ;
(4)向B、C两种元素形成的化合物的水溶液里滴入过量氢氧化钠溶液,写出有关离子方程式__________________________________。
您最近半年使用:0次
9 . 下表是元素周期表的一部分,X、Y、Z均为短周期元素,X、Y的质子数之和为23,下列说法正确的是
| X | |||
| Y | Z | ||
| W |
| A.W的原子序数比Z的大19 |
| B.Y的最高价氧化物溶于水,与水反应得到酸 |
| C.W的单质能与Z的一种氧化物的水溶液反应生成两种强酸 |
| D.Z的单质在一定条件下可与铁粉反应生成+3价铁的化合物 |
您最近半年使用:0次



