1 . 化学用语表示:
(1)根据下列几种粒子的结构示意图,回答问题:
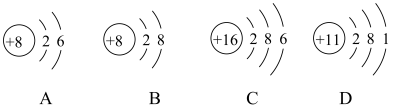
①写出B微粒的符号_________ ;
②若A微粒的中子数为10,写出表示A微粒的组成符号________ ;
③写出A、C、D三种元素形成的某种化合物在水溶液中的电离方程式:_________ ;
(2)写出下列反应的化学方程式:
①氯化铵与氢氧化钠共热____________ ;
②工业上制备氯气____________ 。
(1)根据下列几种粒子的结构示意图,回答问题:

①写出B微粒的符号
②若A微粒的中子数为10,写出表示A微粒的组成符号
③写出A、C、D三种元素形成的某种化合物在水溶液中的电离方程式:
(2)写出下列反应的化学方程式:
①氯化铵与氢氧化钠共热
②工业上制备氯气
您最近一年使用:0次
名校
2 . I、用符号“>”、“<”或“=”连接下列各项关系。
(1)第一电离能:Na__________ Mg,Mg__________ Ca。
(2)电负性:O__________ F,F__________ Cl。
(3)能量高低:ns__________ (n+1)s,ns__________ np。
(4)主族序数__________ 该原子的价电子数__________ 元素最高正化合价。
II、固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,该物质适当加热就分解成两种气体,试完成:
(1)固体A属于__________ 晶体,它的电子式为__________ 。
(2)A溶于水后溶液呈____ 性(填“酸”、“碱”或“中”),其原因是(用化学方程式表示)_______ 。
(1)第一电离能:Na
(2)电负性:O
(3)能量高低:ns
(4)主族序数
II、固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,该物质适当加热就分解成两种气体,试完成:
(1)固体A属于
(2)A溶于水后溶液呈
您最近一年使用:0次
3 . A、B、C、D四种元素的核电荷数依次增大且质子数均小于18。已知A的原子核外最外层电子数是次外层电子数的2倍,B的最外层电子数是内层电子总数的1/2,C原子的核外次外层电子数为8,最外层电子数为6。D是四种元素中质子数最大的,则:
(1)A、B、C、D的元素符号分别是__________ 、_________ 、________ 、__________ 。
(2)B原子结构示意图是_________________ ,C离子结构示意图是_________________ 。
(1)A、B、C、D的元素符号分别是
(2)B原子结构示意图是
您最近一年使用:0次
4 . 画出下列各微粒的结构示意图:
(1)与氖原子电子层结构相同的-2价阴离子:______________________________ 。
(2)最外层电子数为次外层电子数2倍的原子:______________________________ 。
(3)第2层电子数为第1层、第3层电子数之和的原子:______________________ 。
(1)与氖原子电子层结构相同的-2价阴离子:
(2)最外层电子数为次外层电子数2倍的原子:
(3)第2层电子数为第1层、第3层电子数之和的原子:
您最近一年使用:0次
5 . 某微粒的结构示意图如图所示:
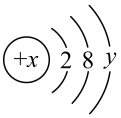
(1)x表示_________________ ,y表示______________________
(2)当y = 7时,若该微粒为中性原子,则x =______________ 。
(3)当y = 8时,若该微粒带有两个单位负电荷,则该微粒的表示符号为_______________ ;若该微粒带有一个单位正电荷,则该微粒的表示符号为________________ 。

(1)x表示
(2)当y = 7时,若该微粒为中性原子,则x =
(3)当y = 8时,若该微粒带有两个单位负电荷,则该微粒的表示符号为
您最近一年使用:0次
6 . 如图是某粒子的结构示意图,试回答:
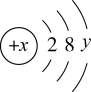
(1)当x-y=10时,该粒子为________ (填“原子”、“阳离子”或“阴离子”)。
(2)当y=8时,该粒子可能是(写微粒符号):______ 、______ 、_____ 、_____ 、_____ ;按离子半径从大到小顺序排列上述离子:____________ 。
(3)写出y=3的元素最高价氧化物对应的水化物与NaOH溶液发生反应的离子方程式______________ 。

(1)当x-y=10时,该粒子为
(2)当y=8时,该粒子可能是(写微粒符号):
(3)写出y=3的元素最高价氧化物对应的水化物与NaOH溶液发生反应的离子方程式
您最近一年使用:0次
解题方法
7 . 下列关于碳和碳的化合物的结构和性质中
(1)和碳同一主族的硅原子中能量最高的电子处在______ 电子层上(填写电子层符号),最外层有___ 种运动状态不同的电子,碳原子核外有______ 种能量不同的电子,有______ 种不同形状的电子云.
(2)1个C原子的单键氢化物分子是CH4,2个C原子的单键氢化物分子则为C2H6.以下各对分子间不存在类似关系的是_________
A.NH3与N2H4 B.H2O与H2O2 C.SF6与S2F10 D.SCl4与S2Cl2
(3)金刚石的熔点低于石墨,原因可能是________
A.石墨中还有范德华力
B.石墨熔化也要破坏共价键,且键长更短
C.石墨热稳定性更好
(4)已知常温下,H2CO3:Ki1=4.3x10﹣7、Ki2=5.6x10﹣11.结合H+的能力Na2CO3溶液______ (填”>”、”<”或“=”)NaHCO3溶液,设计简单实验证明:______ .
(5)在1L 0.3mol/L的NaOH溶液中,通入4.48LCO2(标准状况),反应后所得溶液中离子的浓度之间有一些等量关系,例如:.c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣),另外对此溶液中存在的离子按浓度由大到小排序为______ .
(1)和碳同一主族的硅原子中能量最高的电子处在
(2)1个C原子的单键氢化物分子是CH4,2个C原子的单键氢化物分子则为C2H6.以下各对分子间不存在类似关系的是
A.NH3与N2H4 B.H2O与H2O2 C.SF6与S2F10 D.SCl4与S2Cl2
(3)金刚石的熔点低于石墨,原因可能是
A.石墨中还有范德华力
B.石墨熔化也要破坏共价键,且键长更短
C.石墨热稳定性更好
(4)已知常温下,H2CO3:Ki1=4.3x10﹣7、Ki2=5.6x10﹣11.结合H+的能力Na2CO3溶液
(5)在1L 0.3mol/L的NaOH溶液中,通入4.48LCO2(标准状况),反应后所得溶液中离子的浓度之间有一些等量关系,例如:.c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣),另外对此溶液中存在的离子按浓度由大到小排序为
您最近一年使用:0次
解题方法
8 . 我国自主研制的C919大型客机的机身大量采用第三代铝锂合金减重并提高刚度。某铝锂合金成分(质量百分比)如下(Bal指剩余的百分含量):

为了使合金具有高耐腐性能,通常先用酸腐蚀除去铝锂合金表面的氧化层,再进行氧化处理,并进行适当封闭,以提高合金表面耐腐蚀性能。仔细阅读上述信息,回答下列问题:
(1)铝锂合金可用于制造飞机,铝锂合金材料的主要特点是______________________________ 。
(2)铝元素原子核外有_____ 种不同运动状态的电子,最外层电子排布式为___________ 。
(3)碱腐蚀工艺采用40~60g/L的NaOH溶液,在40~55℃下处理0.5~2min时间。写出碱腐蚀主要反应的化学方程式_____________________________ (写一个即可)。
(4) 镁与铝也是构成轻合金的两种常见金属,请从原子结构角度分析比较它们金属性的强弱_____________
(5) 向镁铝合金滴入盐酸至恰好全部溶解,再逐渐滴入氢氧化钠溶液至过量,在滴氢氧化钠过程中观察到的现象有:______________________________________ ;写出其现象中的一个离子方程式_________________ 。

| 成分 | Si | Fe | Cu | Mn | Mg | Zn | Ti | Li | Al |
| 含量 | 0.08 | 0.1 | 2.9~3.5 | 0.5 | 0.25~0.8 | 0.25 | 0.1 | 0.8~1.1 | Bal |
(1)铝锂合金可用于制造飞机,铝锂合金材料的主要特点是
(2)铝元素原子核外有
(3)碱腐蚀工艺采用40~60g/L的NaOH溶液,在40~55℃下处理0.5~2min时间。写出碱腐蚀主要反应的化学方程式
(4) 镁与铝也是构成轻合金的两种常见金属,请从原子结构角度分析比较它们金属性的强弱
(5) 向镁铝合金滴入盐酸至恰好全部溶解,再逐渐滴入氢氧化钠溶液至过量,在滴氢氧化钠过程中观察到的现象有:
您最近一年使用:0次
9 . 某元素单质R质量为5.4g,跟足量的氯气反应可生成RCl3质量为26.7g,已知R原子中质子数比中子数少一个。
(1)求R的相对原子质量;___
(2)写出R的原子结构示意图和R离子的电子式。___ 、___
(1)求R的相对原子质量;
(2)写出R的原子结构示意图和R离子的电子式。
您最近一年使用:0次
解题方法
10 . 金属“钙线”是炼制优质钢材的脱氧脱磷剂,某“钙线”的主要成分为金属M和Ca。
(1)Ca元素在元素周期表中的位置是_____ ,最外层电子排布式为________ 。
(2)CaF2的电子式为_____ ,CaF2熔点比SiF4熔点_______ (选填“高”、“低”或“相同”),原因是_____ 。
(3)将“钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为_____ ,检测Mn+的另一种方法是_____ 。
(4)配平下列化学方程式: P+ FeO+ CaO→ Ca3(PO4)2+ Fe,________ ,若生成的Fe为2.8g,则转移的电子数目为_____ 个。
(1)Ca元素在元素周期表中的位置是
(2)CaF2的电子式为
(3)将“钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为
(4)配平下列化学方程式: P+ FeO+ CaO→ Ca3(PO4)2+ Fe,
您最近一年使用:0次



